Похожие презентации:
Реакционная способность химических соединений (лекция 2)
1.
Лекция 2Реакционная способность
химических соединений
Sir Christopher (Kelk) Реутов Олег Александрович
1920-1998
Ingold 1893-1970
Roald Hoffmann
1937
2.
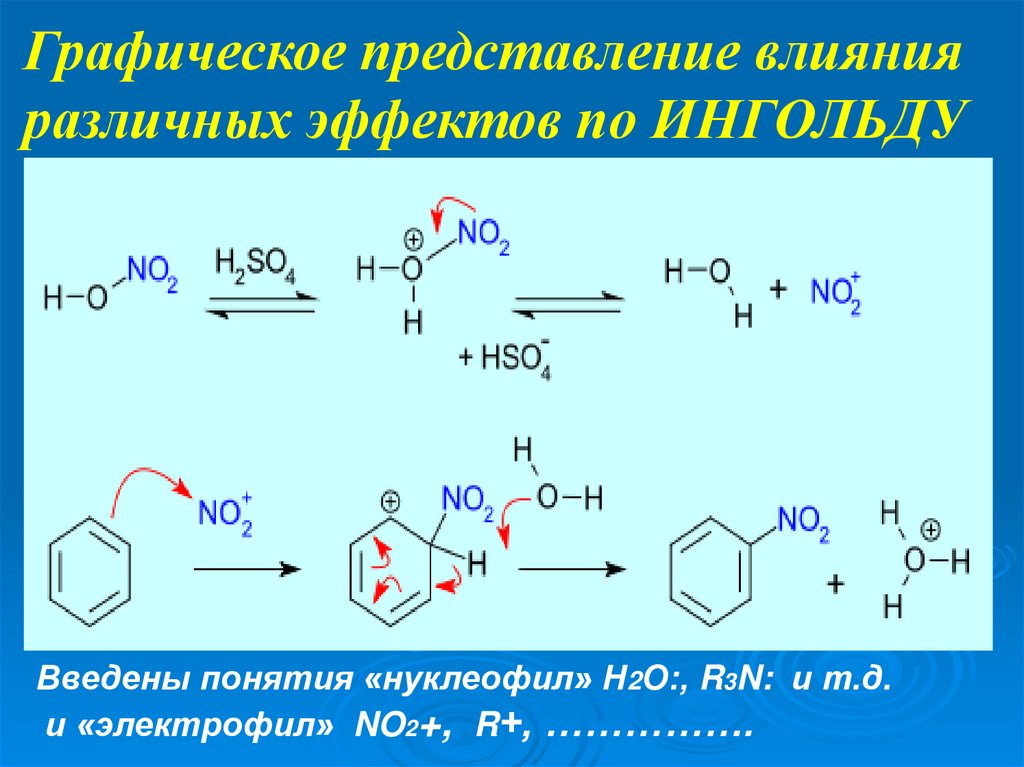
Графическое представление влиянияразличных эффектов по ИНГОЛЬДУ
Введены понятия «нуклеофил» Н2О:, R3N: и т.д.
и «электрофил» NO2+, R+, …………….
3.
Реутов Олег Александрович 1920-1998Лайнус Карл Полинг 1901 - 1994
4.
B5.
Механизмы органических реакцийВключает два понятия –
- установление схемы реакции, состоящей из
последовательности элементарных стадий.
- установление причин тех или иных изменений в
реагирующих молекулах.
Первое показывает – что происходит
Второе - как и почему это происходит.
6.
Механизмы органических реакцийСуществует два решения второй задачи
- установление причин тех или иных изменений в
реагирующих молекулах, т.е. как и почему это
происходит.
«квантово –механическое»
«классическое»
На основе
законов
электростатики
На основе законов квантовой
механики (химии)
p
RH
+
Cl*
RH
Cl*
7. Классификация химических реакций
ХИМИЧЕСКИЕРЕАКЦИИ
ПРОСТЫЕ
СЛОЖНЫЕ
8. Простые химические реакции
Простая или элементарная реакцияпротекает в одну стадию, без образования
промежуточных веществ. Peакции делятся
на:
мономолекулярные
бимолекулярные
трехмолекулярные
9. Мономолекулярная реакция
– в элементарном акте участвует однамолекула (разложение, изомеризация )
A продукты
СaCO3 CaO + CO2
N2O4 2 NO2
S >0
10. Бимолекулярная реакция
- в элементарном акте участвуют 2 молекулы(столкновение двух молекул)
A + В продукты
H2 + J2 2 HJ
2 HJ H2 + J2
если [B]0>> [A]0
S < 0
[A] =[A]0 exp(-k*[B]0*t)
11. Трехмолекулярная реакция
в элементарном акте участвуют три молекулы,вероятность их столкновения мала
2 NO + Cl2 2 NOCl
S <<0
12. Классификация химических реакций
а) Гомогенные- реакции в которых реагенты находятся водном агрегатном состоянии
2SO2( газ ) О2( газ ) 2SO3( газ )
б) Гетерогенные- реакции в которых реагенты находятся в
различных агрегатных состояниях.
Fe2O3( тв ) 3Н 2( газ ) 3Fe( тв ) 3Н 2О( газ )
б) Топохимические реакции реакции в которых реагент(ы)
находятся в твердой фазе.
CaCO3 CaO + CO2
дегидратация кристаллогидратов,
окисление металлов
13. Сложные реакции
Сложные реакции протекают внесколько стадий с образованием
промежуточных продуктов. Сложные
реакции бывают:
последовательные
параллельные реакции
цепные реакции (последовательные)
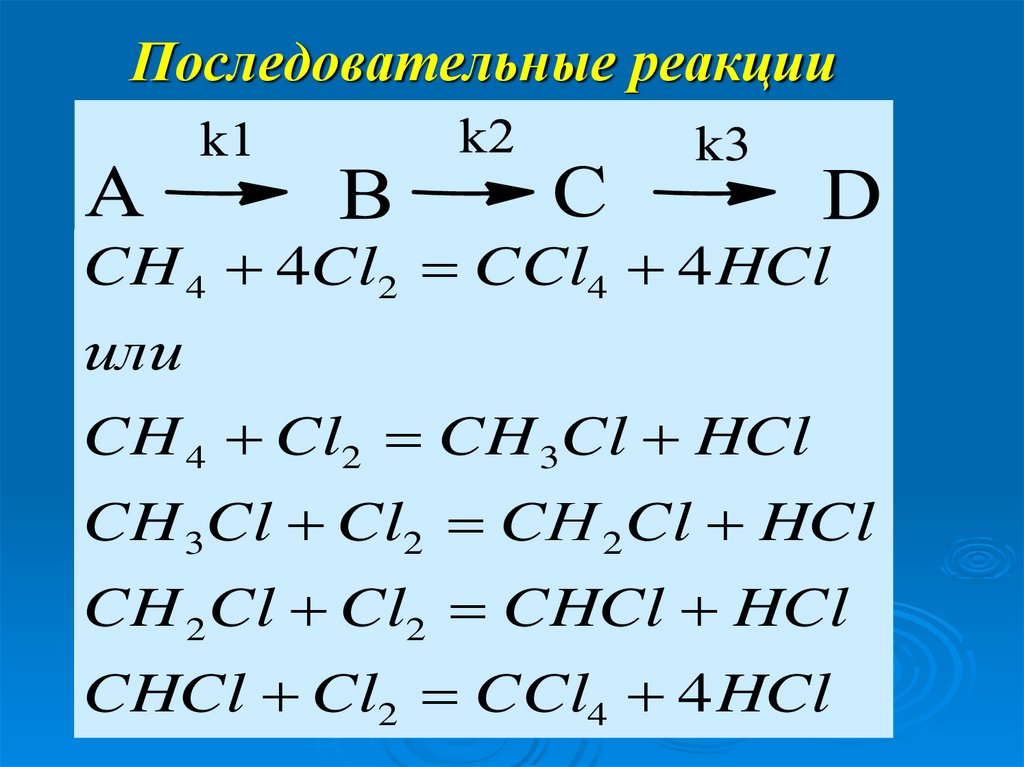
14. Последовательные реакции
CH 4 4Cl2 CCl4 4 HClили
CH 4 Cl2 CH 3Cl HCl
CH 3Cl Cl2 CН 2Cl HCl
CH 2Cl Cl2 CHCl HCl
CHCl Cl2 CCl4 4 HCl
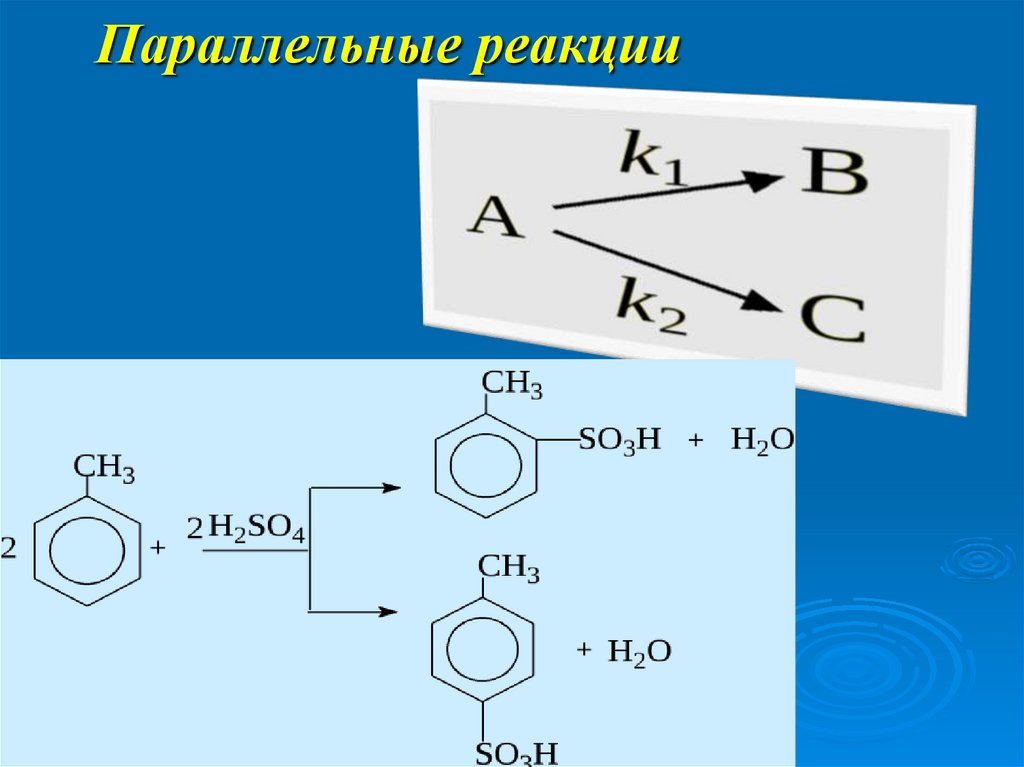
15. Параллельные реакции
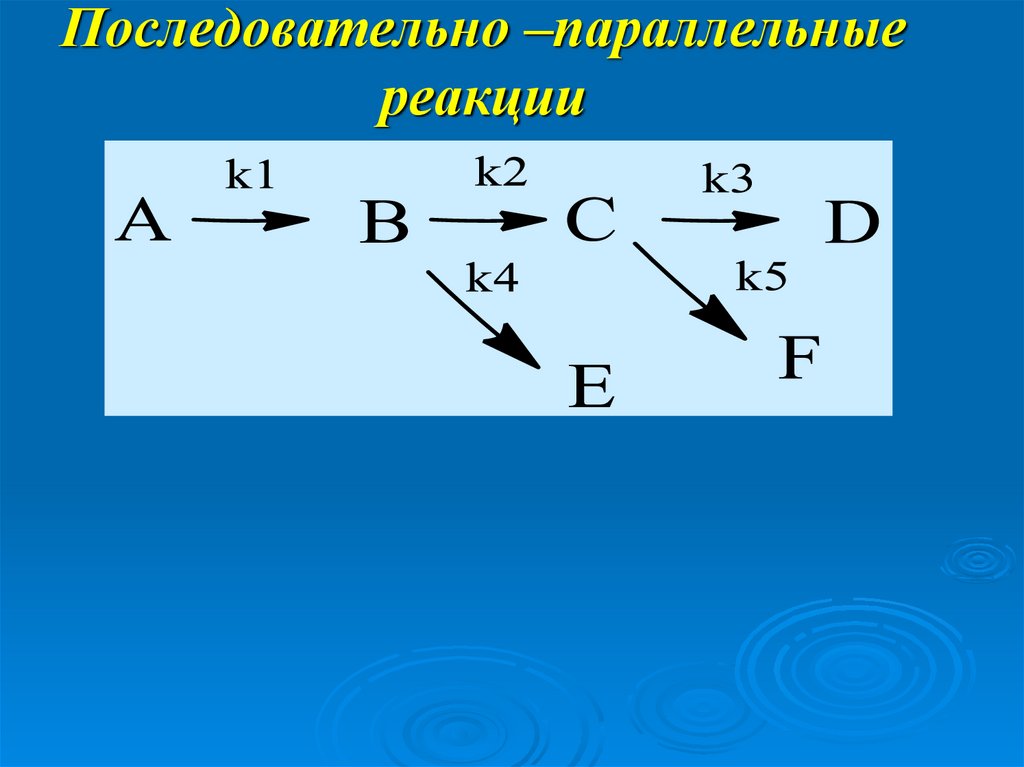
16. Последовательно –параллельные реакции
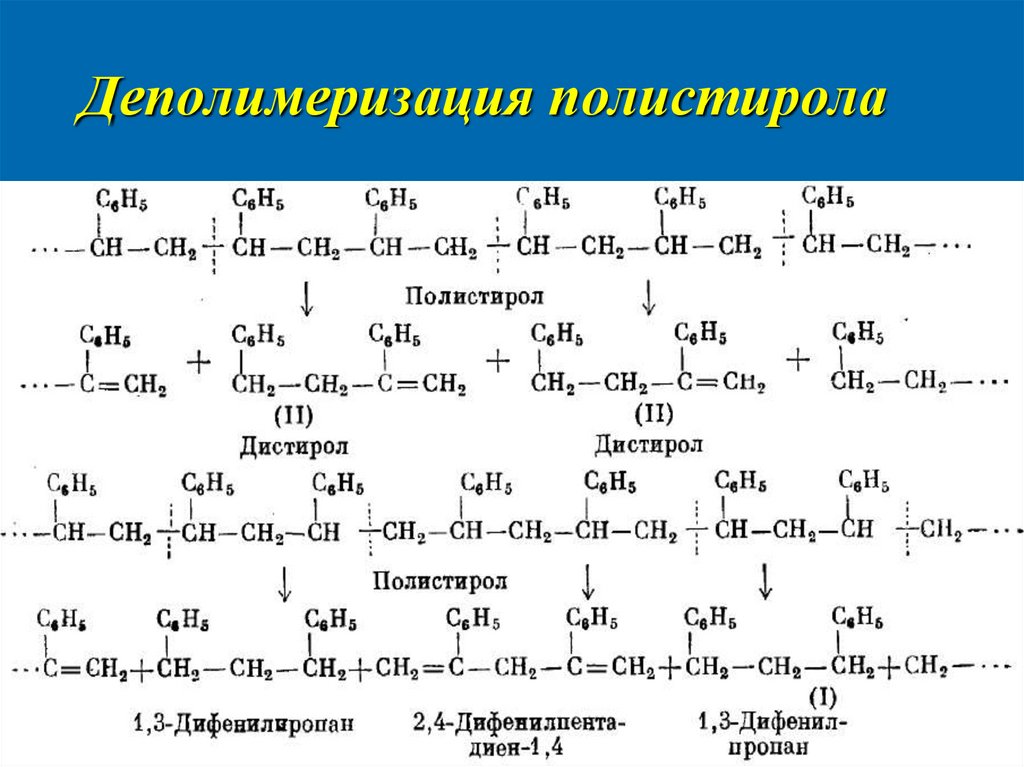
17. Деполимеризация полистирола
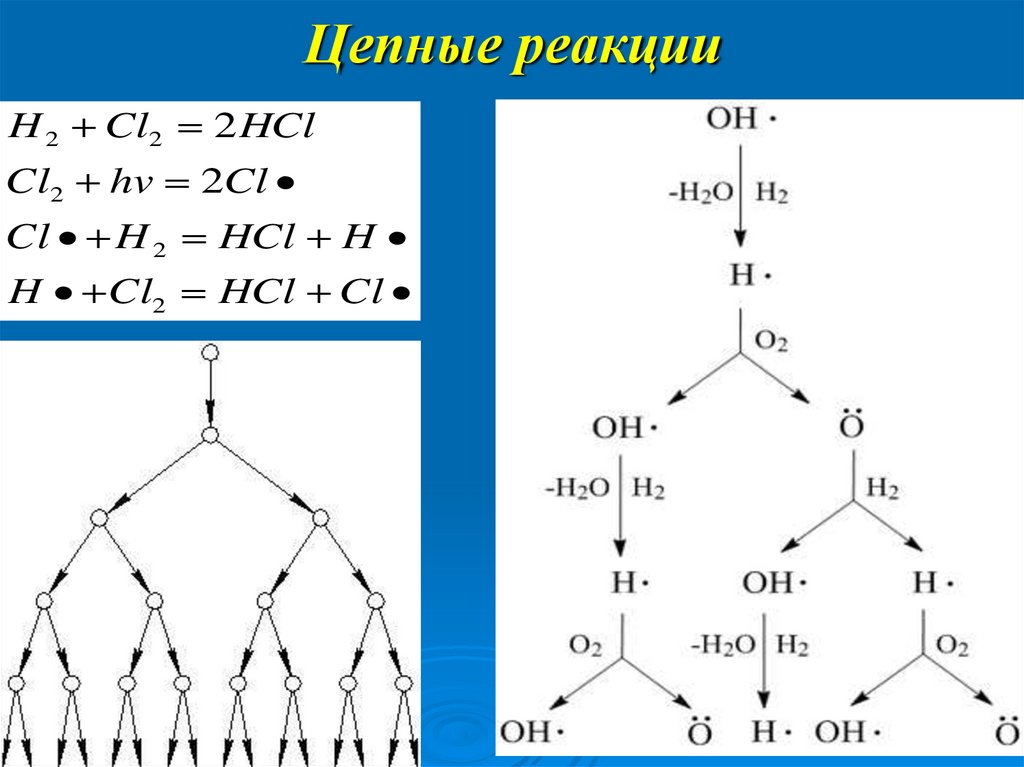
18. Цепные реакции
H 2 Cl2 2 HClCl2 hv 2Cl
Cl H 2 HCl H
H Cl2 HCl Cl
19.
Влияние различных параметров напротекание химических реакций
- влияние температуры
- влияние давления
- влияние растворителя
20. Влияние температуры на скорость химической реакции.
Правило Вант-Гоффа:Чем выше температура, тем больше
скорость химической реакции.
Скорость химической реакции
увеличивается в 2-4 раза при
увеличении температуры на каждые
100 .
21. Температурный коэффициент
V2V1
T2 T1
10
Где Т2 > Т1
γ – температурный
коэффициент ВантГоффа, показывает
во сколько раз
возросла скорость
химической
реакции.
22. Влияние температуры на скорость химической реакции.
Сва́нте А́вгуст Арре́ниус(Svante August Arrhenius; 1859
- 1927)
Нобелевской премии по химии
(1903).
∆G
/
RT
k=A e
k A e
Ea
RT
23. Уравнение Аррениуса
k A eEa
RT
К – константа скорости реакции,
Т – температура, в К,
R – молярная газовая постоянная 8,31
Дж/моль*К
Еа – энергия активации, Дж/моль,
А – предэкспоненциальный множитель,
показывает общее число столкновений.
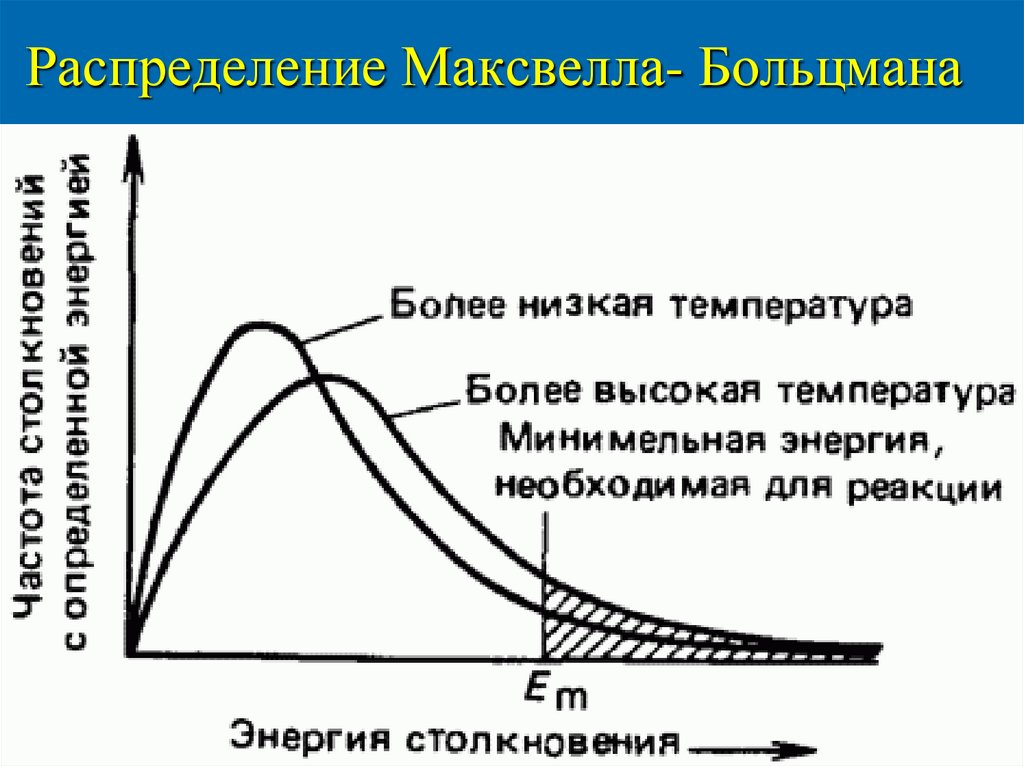
24. Энергия активации
Первое условие протекания реакции являетсястолкновение реагирующих молекул;
не каждое столкновение приводит к реакции;
реагируют только те молекулы, у которых
кинетическая ЕК достаточна для преодоления
отталкивания электронных оболочек,
эта энергия называется энергией активации
Еа кДж/моль.
25. Распределение Максвелла- Больцмана
26.
Реакция начинается только между темичастицами, которые обладают повышенной
энергией, такие частицы при столкновении
сначала образуют активированный комплекс,
что-то вроде промежуточного соединения,
существующего в течение очень короткого
времени.
Затем активированный комплекс разрушается с
образованием продуктов реакции.
Образование активированного комплекса более
энергетически выгодно, чем предварительный
полный распад молекул, вступающих в реакцию
27. Важно!
Энергия активации характеристикареакции в целом, а не для вещества;
энергия активации - это наименьшая
энергия необходимая для того, чтобы
прошла реакция;
Энергия активации основывается
на теории активных столкновений
28.
Теория активированного комплексаили «переходного» состояния
Разработана Э. Вигнером, М. Поляни, Г. Эйрингом,
М. Эвансом в 30-х гг. 20 в.
ABC# ,
представляет собой активированный комплекс
29.
Теория активированного комплексаили «переходного» состояния
Разработана Э. Вигнером, М. Поляни, Г. Эйрингом,
М. Эвансом в 30-х гг. 20 в.
многомерная поверхность
потенциальной энергии
(ППЭ) реакции
Кривая линия, проходящая по
дну долин через барьер,координата реакции.
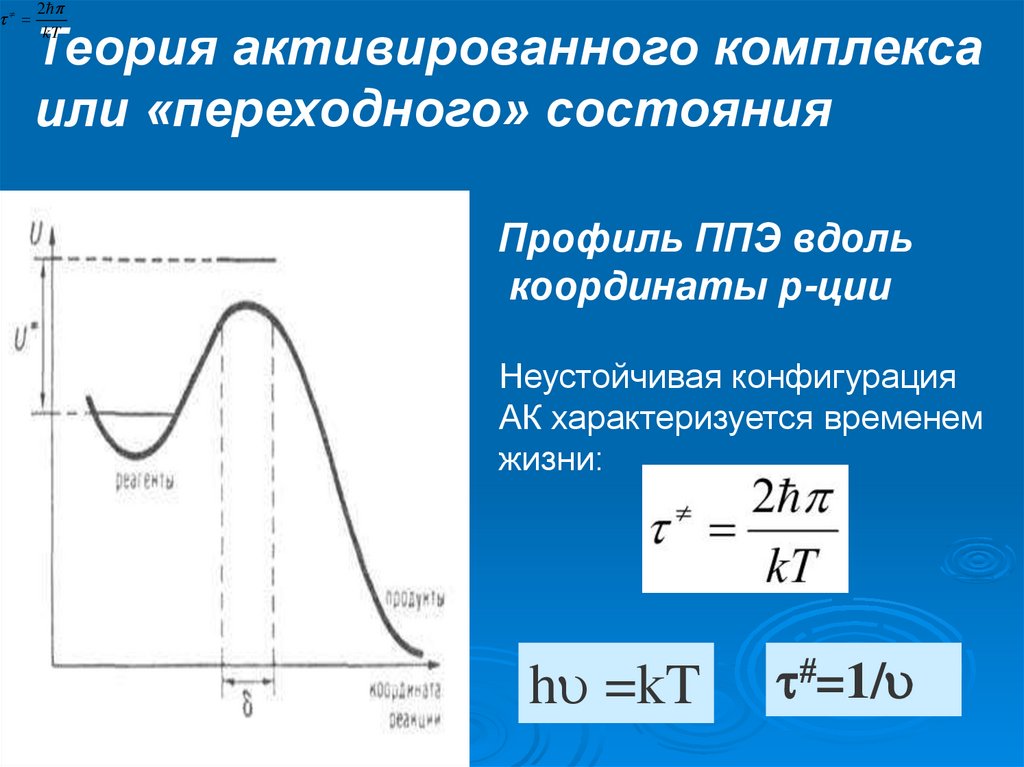
30.
2kT
Теория активированного комплекса
или «переходного» состояния
Профиль ППЭ вдоль
координаты р-ции
Неустойчивая конфигурация
АК характеризуется временем
жизни:
h =kT
=1/
31.
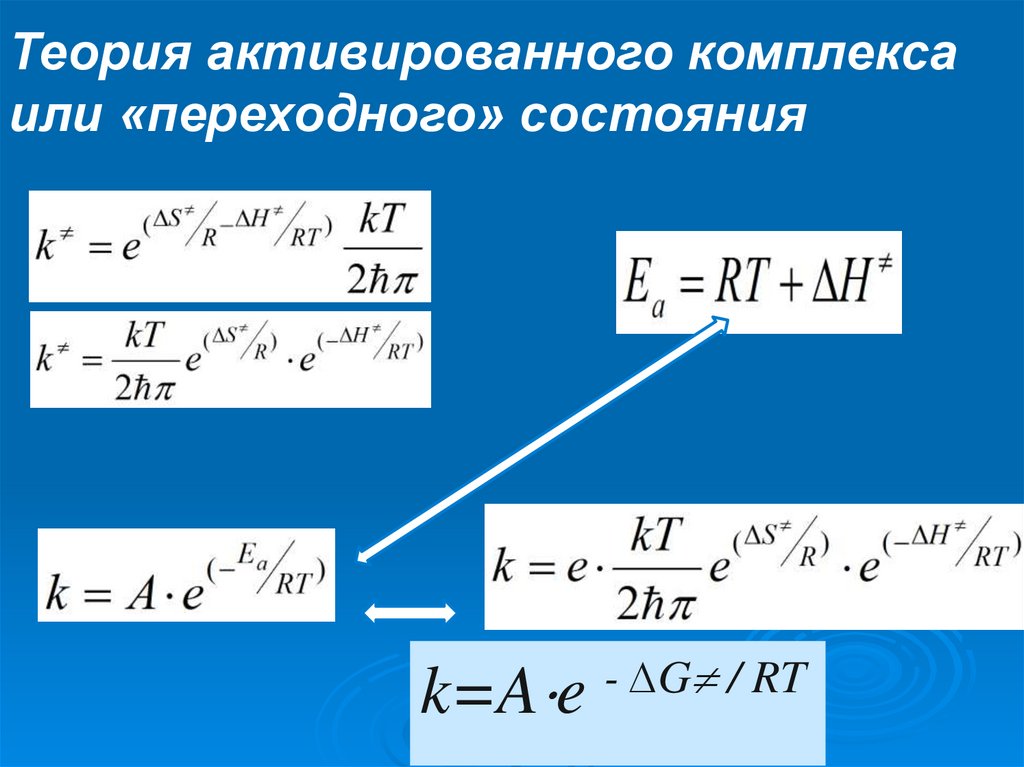
Теория активированного комплексаили «переходного» состояния
Неустойчивая конфигурация АК характеризуется
временем жизни:
А скорость этого процесса будет
32.
Теория активированного комплексаили «переходного» состояния
∆G
/
RT
k=A e
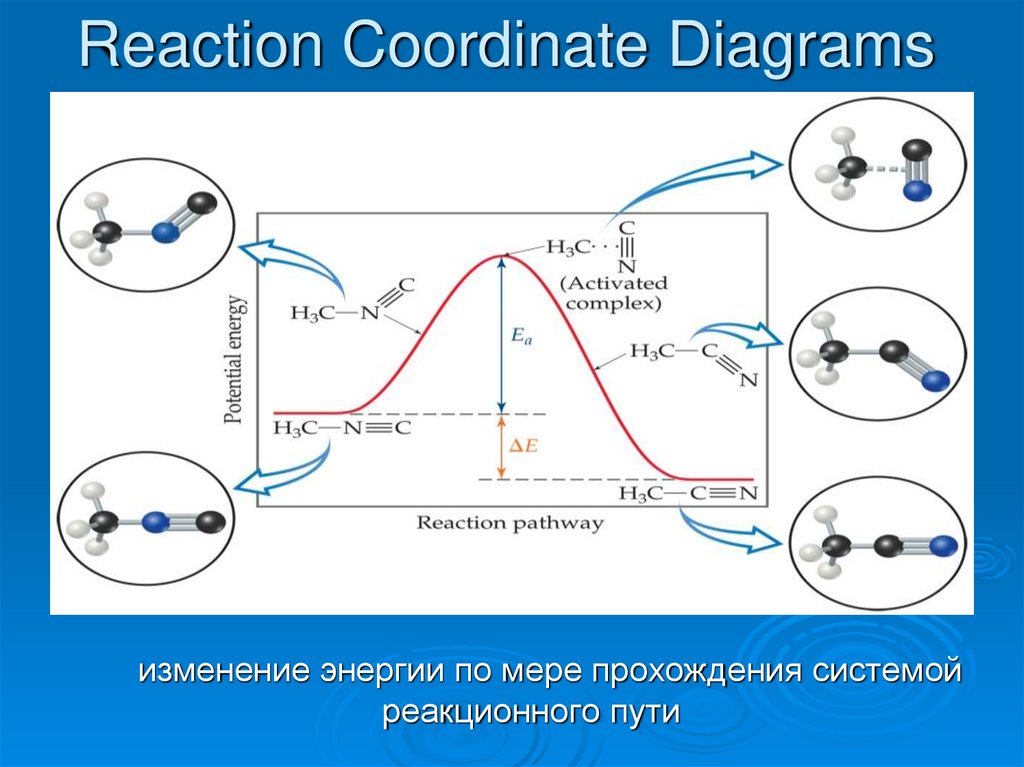
33. Reaction Coordinate Diagrams
изменение энергии по мере прохождения системойреакционного пути
34. Влияние давления на скорость химической реакции
Если в реакции участвуют газообразные вещества,то повышение давления равносильно сжатию газа,
т.е. увеличению его концентрации.
При увеличении концентрации газообразного
компонента скорость реакции в соответствии с
законом действующих масс возрастает.
При понижении давления газ расширяется, и его
концентрация в системе падает, это вызывает
уменьшение скорости реакции.
Но это только одна сторона влияния давления
35.
При образовании активированного комплекса объеммолекулы Vo изменяется на величину объема активации.
Для деформации среды на эту величину требуется
затратить дополнительную энергию Е, на которую и
увеличивается энергия активации реакции Е.
Для газофазных реакций влияние давления
незначительно, но для жидкофазных и, особенно, для
твердофазных реакций изменение давления может
определять не только скорость, но и путь реакции
36.
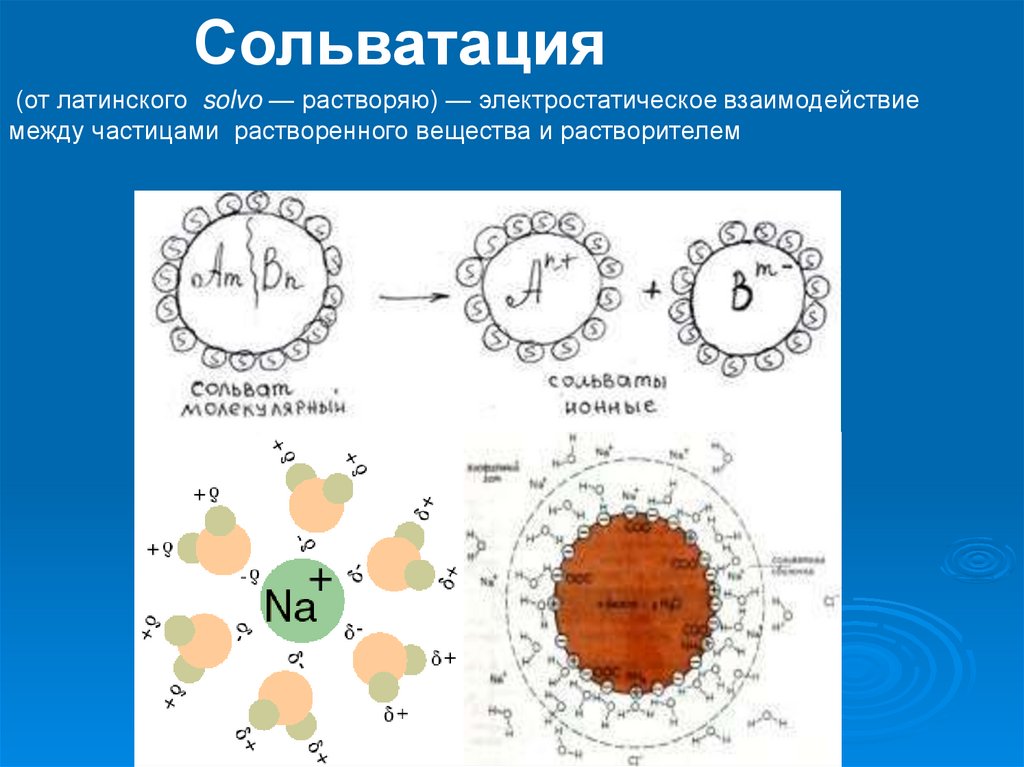
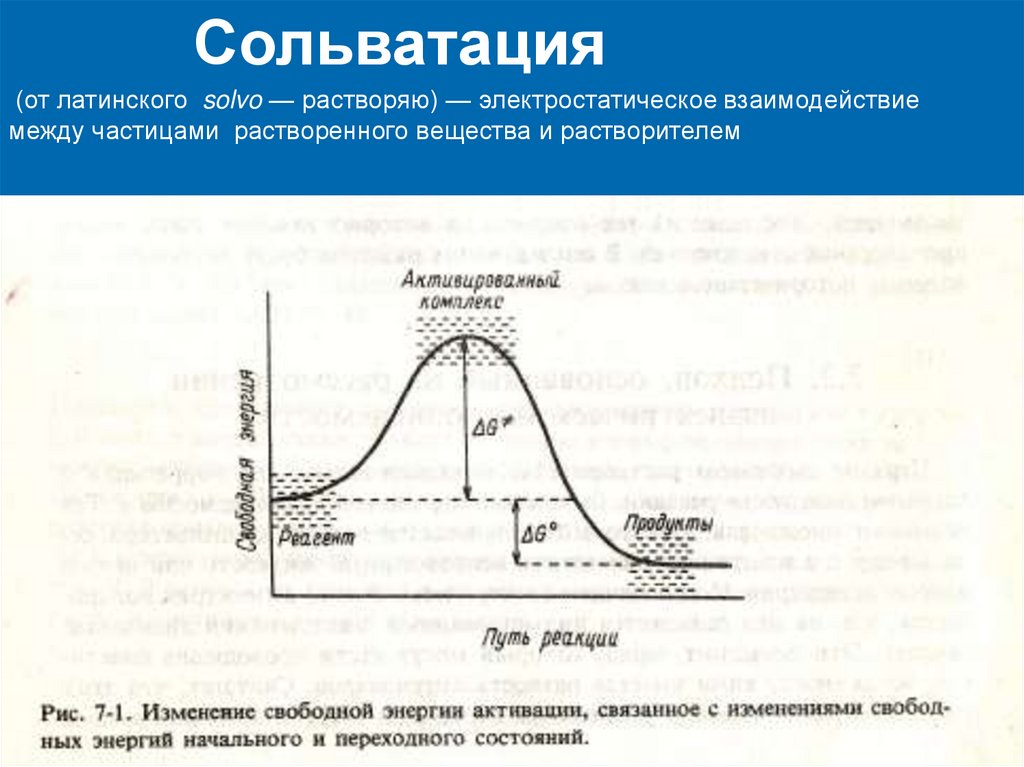
Сольватация(от латинского solvo — растворяю) — электростатическое взаимодействие
между частицами растворенного вещества и растворителем
37.
Сольватация(от латинского solvo — растворяю) — электростатическое взаимодействие
между частицами растворенного вещества и растворителем
38.
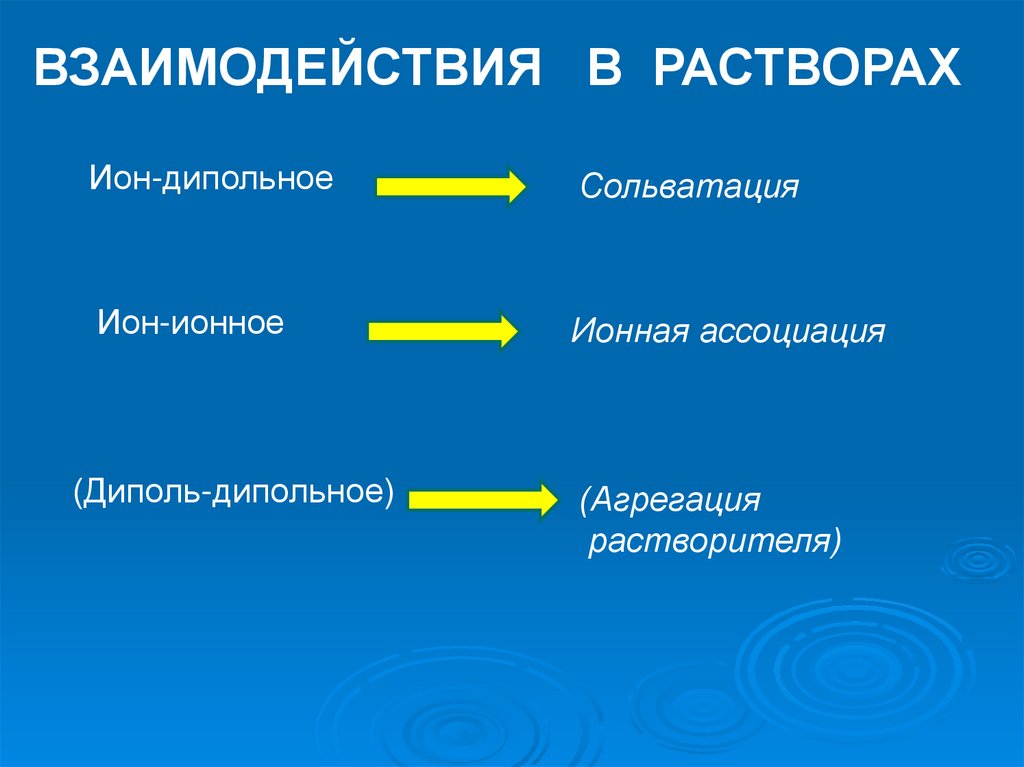
ВЗАИМОДЕЙСТВИЯ В РАСТВОРАХИон-дипольное
Сольватация
Ион-ионное
Ионная ассоциация
(Диполь-дипольное)
(Агрегация
растворителя)
39.
ИдеяНернста и Борна
Использовать закон
Кулона
Идея Кирквуда
для
взаимодействующих
диполей
Использовать уравнение
поляризуемости (Р)
n2 1
P 2
2n 1
отсюда
G0 const ( 1 )
или
ki
Ln
const ( 1 )
k0
Формула применима везде,
где участвуют ионы
отсюда
1
ki
Ln
const
k
2 1
0
Формула применима везде,
где изменяются диполи
40.
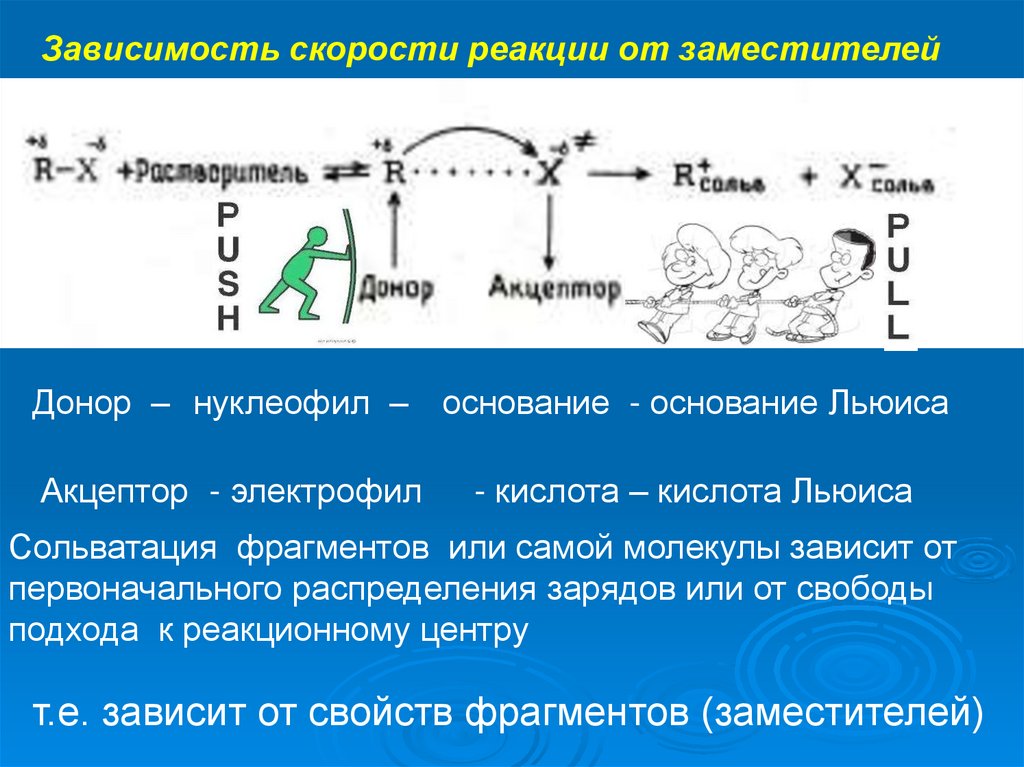
Зависимость скорости реакции от заместителейДонор – нуклеофил – основание - основание Льюиса
Акцептор - электрофил
- кислота – кислота Льюиса
Сольватация фрагментов или самой молекулы зависит от
первоначального распределения зарядов или от свободы
подхода к реакционному центру
т.е. зависит от свойств фрагментов (заместителей)
41.
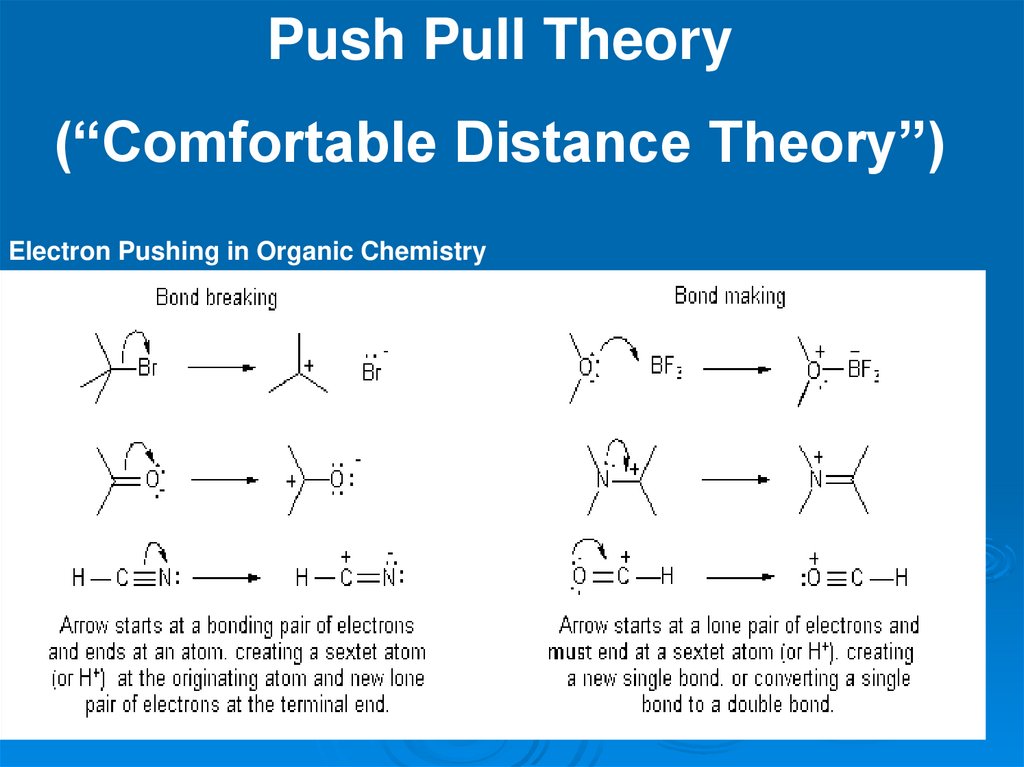
Push Pull Theory(“Comfortable Distance Theory”)
Electron Pushing in Organic Chemistry


























 Химия
Химия








