Похожие презентации:
Окислительно-восстановительные реакции в органической химии
1.
ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕРЕАКЦИИ
В ОРГАНИЧЕСКОЙ ХИМИИ
2.
«Думать легко, действовать трудно, апревратить мысль в действие — самая трудная
вещь на свете» И. Гете
Окислительно-восстановительные реакции в органической химии
представляют наибольший интерес, т.к. селективность перехода из
одной степени окисления в другую сильно зависит от правильного
выбора реагента и условий проведения реакций.
Но ОВР изучают в обязательном курсе химии недостаточно
полно. Следует обратить особое внимание учащихся на
окислительно-восстановительные процессы, происходящие с
участием органических веществ. Это связано с тем, что
окислительно-восстановительные реакции в контрольноизмерительных материалах ЕГЭ встречаются не только в заданиях
С1 и С2 , но и заданиях СЗ, представляющих цепочку превращений
органических веществ.
В школьных учебниках часто окислитель записывают над
стрелкой как [О]. Требованием к выполнению таких заданий на ЕГЭ
является обязательное обозначение всех исходных веществ и
продуктов реакции с расстановкой необходимых коэффициентов.
Окислительно-восстановительные реакции традиционно важны, и
в то же время изучение в 10 классе, в курсе «Органическая химия»
вызывает у учащихся определенные трудности.
3. С3 . Задания этого блока проверяют знания по органической химии
В цепочках превращений органическихвеществ в подавляющем большинстве заданий
встречаются ОВР. Эксперт имеет право
начислить балл только в том случае, если
записано уравнение, а не схема реакции, т.е.
верно расставлены коэффициенты. В реакциях
с участием неорганических окислителей
(перманганат калия, соединения хрома (VI),
пероксид водорода и др.) сделать это бывает
непросто, без электронного баланса.
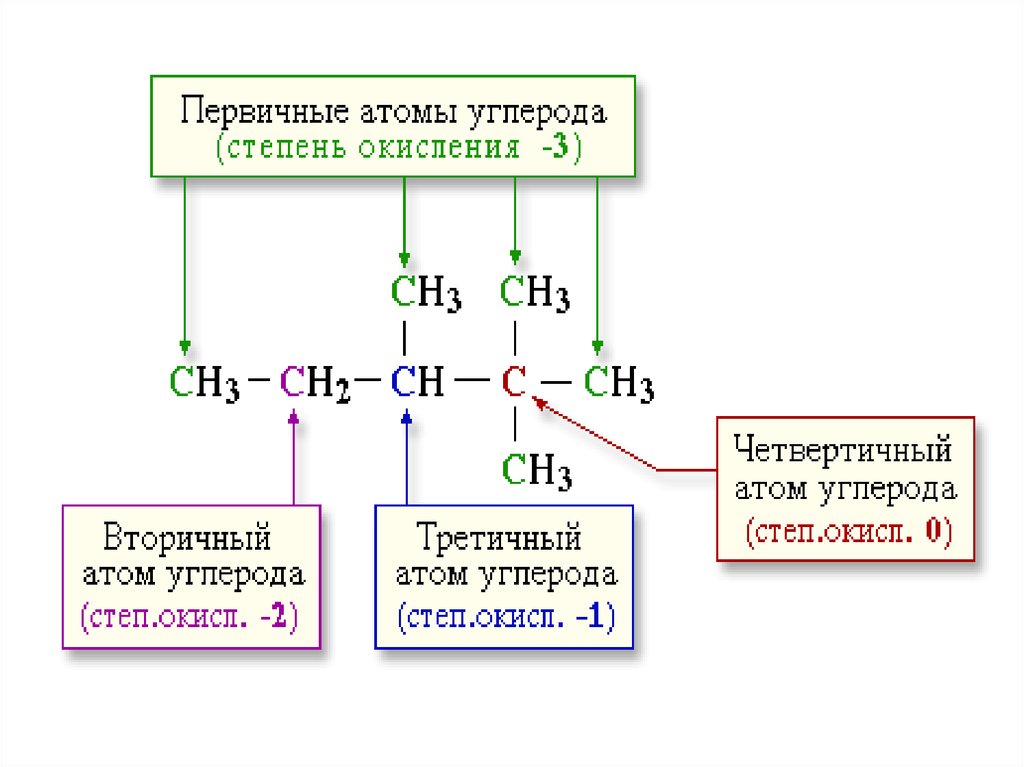
4. Определение степени окисления атомов в молекулах органических соединений
ПРАВИЛО:СО (атома) = число связей с более ЭО
атомами минус число связей с менее ЭО
атомами.
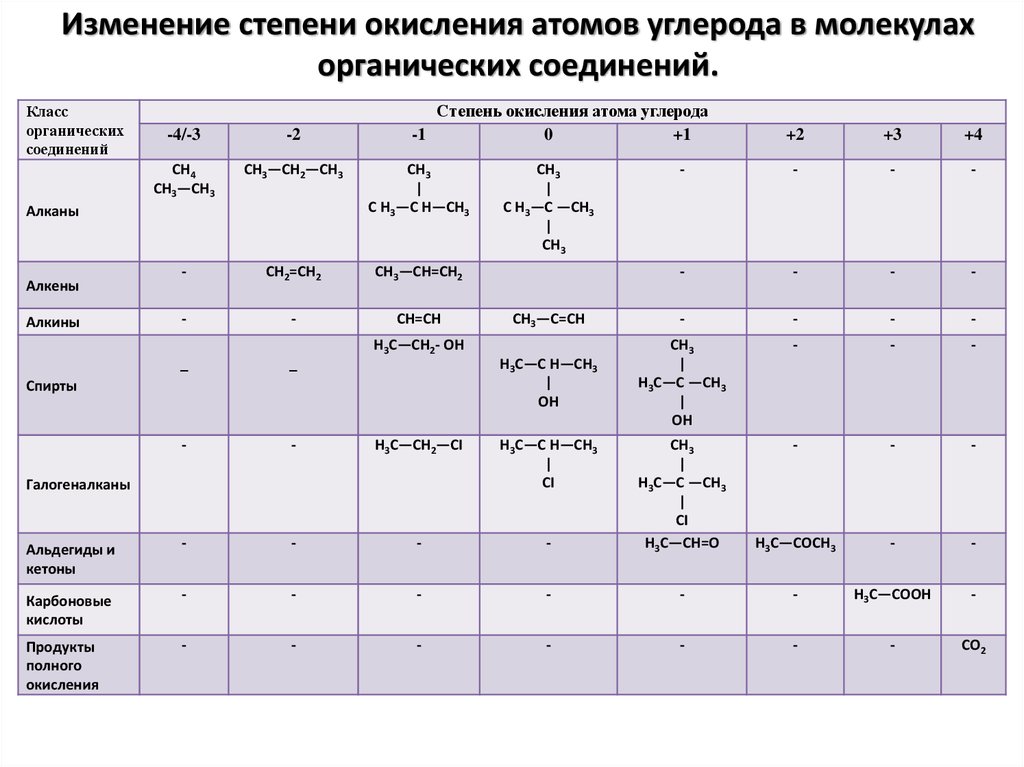
5. Изменение степени окисления атомов углерода в молекулах органических соединений.
Классорганических
соединений
Степень окисления атома углерода
-1
0
+1
-4/-3
-2
CH4
CH3—CH3
CH3—CH2—CH3
CH3
|
C H3—C H—CH3
-
CH2=CH2
CH3—CH=CH2
-
-
CH=CH
_
_
-
-
H3C—CH2—CI
H3C—C H—CH3
|
CI
Альдегиды и
кетоны
-
-
-
Карбоновые
кислоты
-
-
Продукты
полного
окисления
-
-
Алканы
Алкены
Алкины
+2
+3
+4
-
-
-
-
-
-
-
-
CH3—C=CH
-
-
-
-
CH3
|
H3C—C —CH3
|
OH
-
-
-
H3C—C H—CH3
|
OH
-
-
-
-
CH3
|
H3C—C —CH3
|
CI
H3C—CH=O
H3C—COCH3
-
-
-
-
-
-
H3C—COOH
-
-
-
-
-
-
CO2
CH3
|
C H3—C —CH3
|
CH3
H3C—CH2- ОН
Спирты
Галогеналканы
6.
7. Склонность органических соединений к окислению связывают с наличием:
• кратных связей (легко окисляются алкены, алкины, алкадиены);• функциональных групп, способных легко окисляться
( –OH, - СНО, - NH2);
• активированных алкильных групп, расположенных по соседству с
кратными связями или бензольным кольцом (например, пропен
может быть окислен до непредельного альдегида акролеина,
окисление толуола до бензойной кислоты перманганатом калия в
кислой среде);
• наличие атомов водорода при атоме углерода, содержащем
функциональную группу.
8. 1.МЯГКОЕ ОКИСЛЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Для мягкого окисления органических соединений (спиртов,альдегдов, непредельных соединений) используются соединения
хрома (VI) – оксид хрома (VI), CrO3, дихромат калия К2Сr2O7 и др. Как
правило, окисление проводится в кислой среде, продуктами
восстановления являются соли хрома (III), например:
3CH3–CHO + K2Cr2O7 + 4H2SO4 → 3CH3–COOH + 4K2SO4 + Cr2(SO4)3 + 4H2O
t
3CH3–CH2OH+2K2Cr2O7+8H2SO4 →3CH3–COOH + 2K2SO4 + 2Cr2(SO4)3 + 11H2O
При окислении спиртов дихроматом калия на холоду окисление
можно остановить на стадии образования альдегида, при нагревании
же образуются карбоновые кислоты:
3CH3–CH2OH+K2Cr2O7+4H2SO4 →3CH3–CНO+K2SO4+Cr2(SO4)3+7H2O
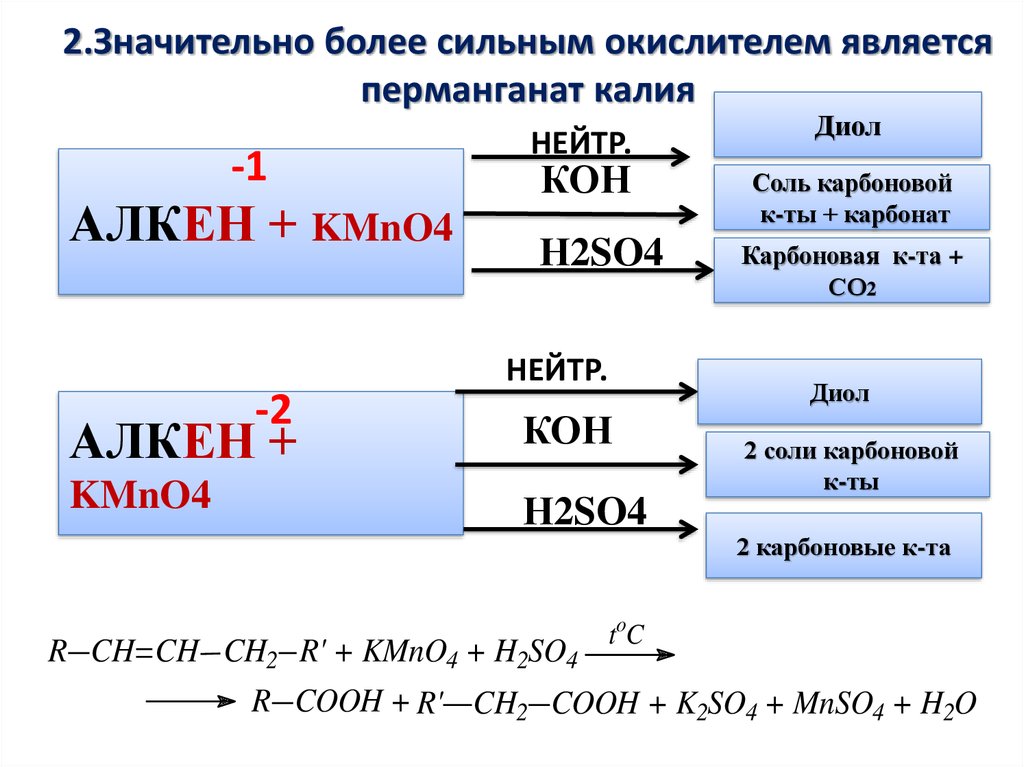
9.
2.Значительно более сильным окислителем являетсяперманганат калия
-1
АЛКЕН + KMnO4
НЕЙТР.
КОН
Н2SO4
НЕЙТР.
-2
Соль карбоновой
к-ты + карбонат
Карбоновая к-та +
СО2
Диол
АЛКЕН +
КОН
KMnO4
Н2SO4
R CH CH CH2 R' + KMnO4 + H2SO4
Диол
2 соли карбоновой
к-ты
2 карбоновые к-та
toC
R COOH + R' CH2 COOH + K2SO4 + MnSO4 + H2O
10.
-1АЛКИН + KMnO4
-2
АЛКИН + KMnO4
КОН
Н2SO4
КОН
Н2SO4
Соль карбоновой
к-ты + карбонат
Карбоновая
к-та + СО2
2 соли карб . к-ты
2 карбоновых
к-ты
C2H2 + 2KMnO4 +3H2SO4 =2CO2 + 2MnSO4 + 4H2O + K2SO4
5CH3C = CH + 8KMnO4 + 12H2SO4 = 5CH3COOH + 5CO2 + 8MnSO4
+ 4K2SO4 + 12H2O
11.
НЕЙТР.Гомологи бензола +
KMnO4
КОН
Н2SO4
Бензоат
бензойная
кислота
5C6H5-CH3 +6 KMnO4 + H2SO4 5C6H5COOH +
6MnSO4 + K2SO4 + 14H2O
C6H5CH3 +2KMnO4 C6H5COOK + 2MnO2 + KOH
+ H2O
C6H5CH2CH3 + 4KMnO4 C6H5COOK + K2CO3 +
2H2O + 4MnO2 + KOH
12. Окислительно-восстановительные свойства кислородсодержащих соединений
Окислителями спиртов чаще всего являются оксид меди (II) илиперманганат калия, а окислителями альдегидов и кетонов - гидроксид меди
(II), аммиачный раствор оксида серебра и другие
окислители
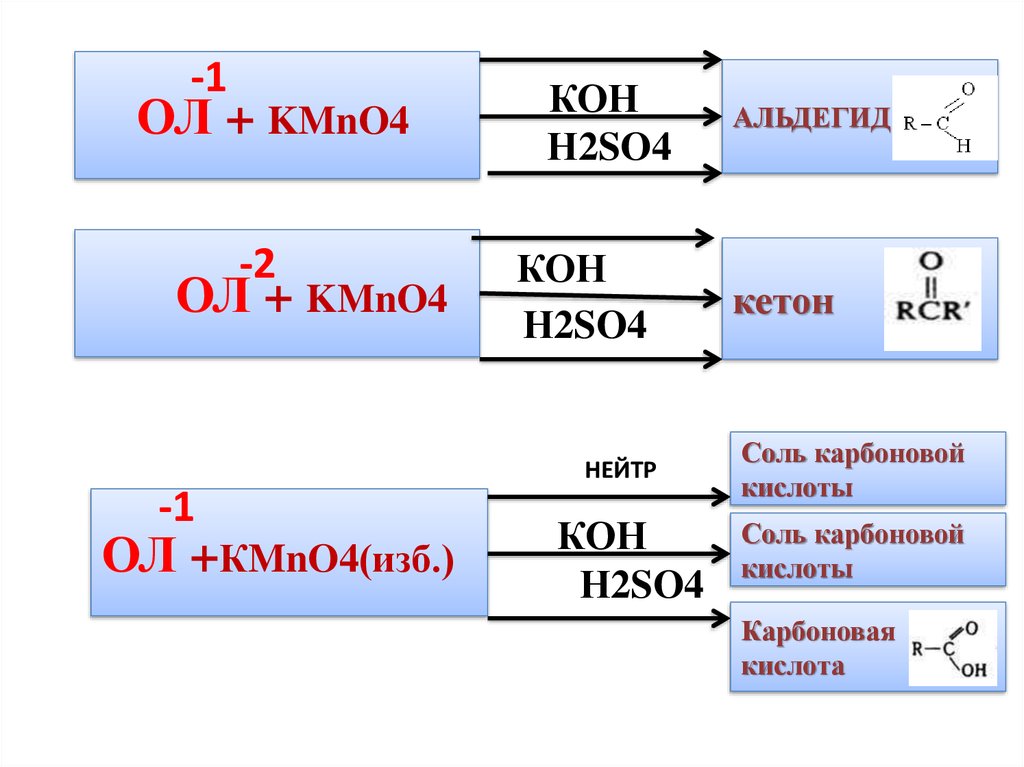
13.
-1ОЛ + KMnO4
-2
ОЛ + KMnO4
КОН
Н2SO4
КОН
Н2SO4
НЕЙТР
-1
ОЛ +КMnO4(изб.)
КОН
Н2SO4
АЛЬДЕГИД
кетон
Соль карбоновой
кислоты
Соль карбоновой
кислоты
Карбоновая
кислота
14.
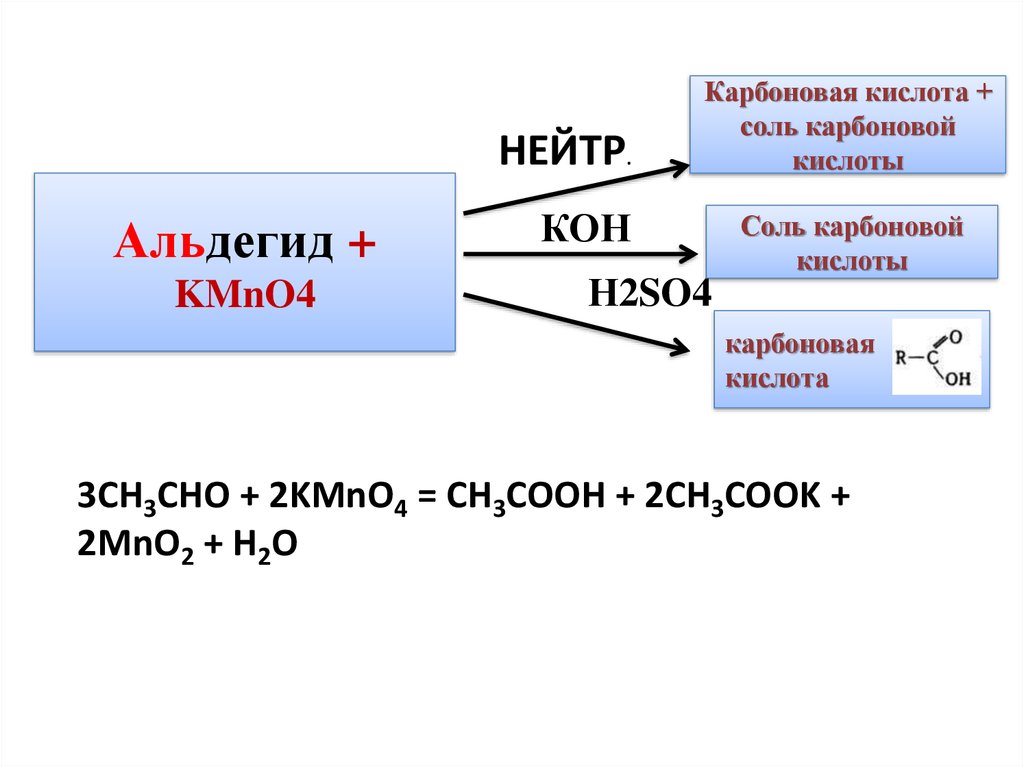
НЕЙТР.Альдегид +
KMnO4
Карбоновая кислота +
соль карбоновой
кислоты
КОН
Н2SO4
Соль карбоновой
кислоты
карбоновая
кислота
3CH3CHO + 2KMnO4 = CH3COOH + 2CH3COOK +
2MnO2 + H2O
15.
Альдегиды – довольносильные восстановители, и
поэтому легко окисляются
различными окислителями
CH3CHO + 2[Ag(NH3)2]OH
CH3COONH4 + 2Ag + H2O + 3NH3
16. Алгоритм подбора коэффициентов
Поскольку в задании С3 при составлении уравнений ОВР не требуется написанияуравнений электронного баланса, подбирать коэффициенты удобно методом
подстрочного баланса – упрощенным способом баланса электронного.
1. Составляется схема ОВР. Например, для окисления толуола до бензойной кислоты
подкисленным раствором перманганата калия схема реакции такова:
С6Н5-СН3 + KMnO4 + H2SO4 С6Н5-СOOН + K2SO4 + MnSO4 + H2O
2. Указываются с.о. атомов. С.о. атома углерода определяется по приведенному выше способу.
С6Н5-С-3Н3 + KMn+7O4 + H2SO4 С6Н5-С+3OOН + K2SO4 + Mn+2SO4 + H2O
3. Число электронов, отданных атомом углерода (6), записывается как коэффициент перед
формулой окислителя (перманганата калия):
С6Н5-С-3Н3 + 6KMn+7O4 + H2SO4 С6Н5-С+3OOН + K2SO4 + Mn+2SO4 + H2O
4. Число электронов, принятых атомом марганца (5), записывается как коэффициент перед
формулой восстановителя (толуола):
5С6Н5-С-3Н3 + 6KMn+7O4 + H2SO4 С6Н5-С+3OOН + K2SO4 + Mn+2SO4 + H2O
5. Важнейшие коэффициенты на месте. Дальнейший подбор не составляет труда:
5С6Н5-СН3 + 6KMnO4 + 9H2SO4 5С6Н5-СOOН + 3K2SO4 + 6MnSO4 + 14H2O
17. Пример тестового задания(С3)
Пример тестового задания(С3)1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Hg2+, H+
KMnO4, H+
Сl2 (эквимол.), h
С2Н2 Х1 СН3СООН Х2 СН4 X3
1. реакция Кучерова.
Hg2+, H+
CH CH + H2O CH3CHO
2.Альдегиды легко окисляются до карбоновых кислот, в том числе таким
сильным окислителем, как перманганат калия в кислой среде.
CH3CHO + KMnO4 + H2SO4 CH3COOH + K2SO4 + MnSO4 + H2O
СН3С+1Н О + KMn+7O4 + H2SO4 СН3-С+3OOН + K2SO4 + Mn+2SO4 + H2O
5 CH3CHO + 2 KMnO4 + 3 H2SO4 5 CH3COOH + K2SO4 + 2 MnSO4 + 3 H2O
3.Для выполнения следующего звена цепочки необходимо оценить вещество Х2 с двух позиций: во-первых, оно в одну
стадию образуется из уксусной кислоты, во-вторых, из него можно получить метан. Это вещество – ацетат щелочного
металла. Записываются уравнения третьей и четвертой реакций.
CH3COOH + NaOH CH3COONa + H2O
сплавление
4. CH3COONa + NaOH CH4 + Na2CO3
5.Условия протекания следующей реакции (свет) однозначно указывают на ее радикальный характер. С учетом указанного
соотношения реагентов (эквимолярное) записывается уравнение последней реакции:
h
CH4 + Cl2 CH3Cl + HCl
18. Сайты тренажеры:
• http://reshuege.ru/ (Решу ЕГЭ)• http://4ege.ru/himiya/4181-demoversiya-ege-pohimii-2014.html (ЕГЭ портал)
• http://www.alleng.ru/edu/chem3.htm
(Образовательные ресурсы Интернета - Химия)
• http://ege.yandex.ru/ (онлайн-тесты)














 Химия
Химия








