Похожие презентации:
Окислительные методы получения органических соединений
1. Окислительные методы получения органических соединений
• Практическое значение - чрезвычайно велико.• В промышленности путем окисления получают жирные
кислоты, малеиновый и фталевый ангидриды, окиси
этилена и пропилена, акрилонитрил, ацетальдегид и др.
• Это крупнотоннажные производства, в которых, как
правило, используются непрерывные технологические
схемы,
высокоэффективные
катализаторы
и
производительное оборудование.
• Окислительные процессы широко применяются и в
синтезе лекарственных веществ и витаминов (оксолина,
левомицетина,
цистамина,
хиноксидина,
нитроксолина, этамида, витамина РР и многих
других).
1
2. Процессы окисления
— Окисление — это реакция, в результате которой поддействием
окислителя
уменьшается
электронная
плотность молекулы или ее фрагмента.
• Механизм реакция может протекать с отрывом пары
электронов (ионный), или с отрывом одного электрона
(радикальный).
• При окислении субстрата степень окисления атомов
увеличивается.
• Например, при окислении толуола, степень окисления
атома углерода метильной группы увеличивается от (–3)
до (+3). При этом изменяется и состав молекулы:
Ph CH3
–3
Ph CH2OH
Ph CH=O
Ph COOH
–1
+1
+3
• Легкость окисления субстрата возрастает вместе с
ростом его электронной плотности и нуклеофильности (N,
S, двойные и тройные связи).
2
3. Окислители
В качестве окислителей используются сильныеэлектрофилы:
– простые вещества — кислород, озон, сера, галогены;
– оксиды элементов — оксиды серебра, меди (II),
хрома (VI), марганца (IV), селена (IV), серы (VI), азота
и др.;
– пероксиды — перекиси водорода, металлов,
органические гидроперекиси, надкислоты;
– кислородсодержащие кислоты и их соли — азотная,
хлорная HClO4, иодная HIO4, хромовая H2CrO4
кислоты, гипогалогениты, перманганат калия KMnO4,
бихроматы калия и натрия Na2Cr2O7, тетраацетат
свинца Pb(CH3COO)4 и др.;
– некоторые органические соединения
(нитросоединения, циклогексанон).
3
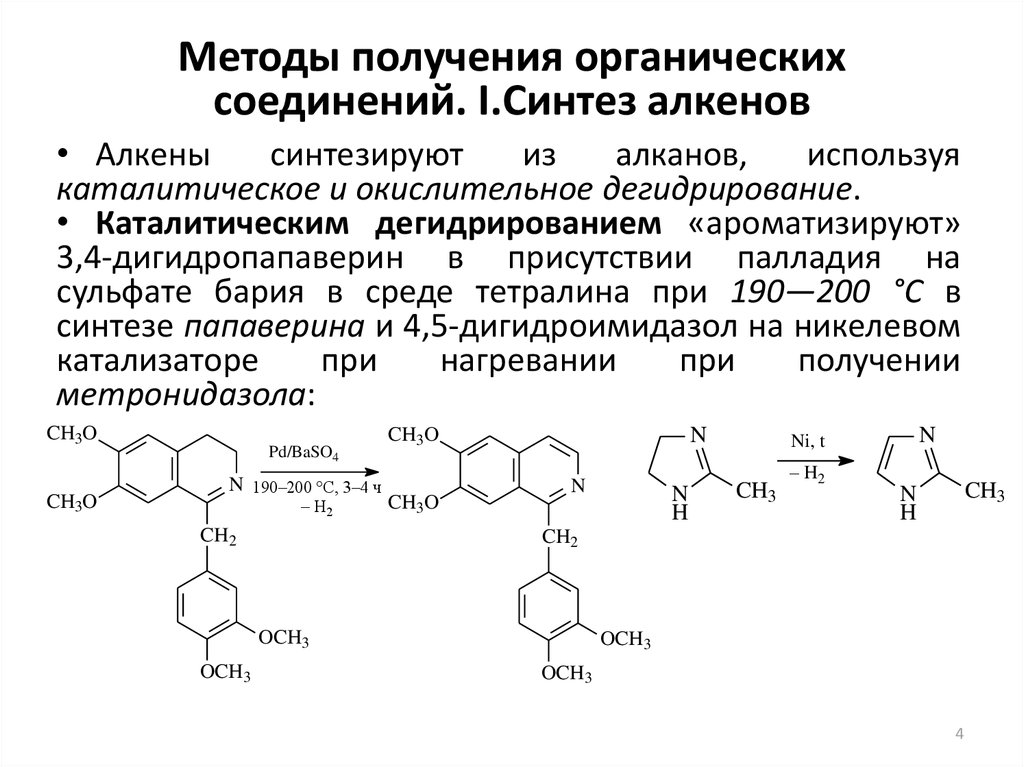
4. Методы получения органических соединений. I.Синтез алкенов
• Алкенысинтезируют
из
алканов,
используя
каталитическое и окислительное дегидрирование.
• Каталитическим дегидрированием «ароматизируют»
3,4-дигидропапаверин в присутствии палладия на
сульфате бария в среде тетралина при 190—200 °С в
синтезе папаверина и 4,5-дигидроимидазол на никелевом
катализаторе
при
нагревании
при
получении
метронидазола:
CH3O
CH3O
Pd/BaSO4
N 190–200 °C, 3–4 ч
– H2
CH2
N
CH3O
CH3O
N
CH3
– H2
CH3
N
H
CH2
OCH3
OCH3
N
H
N
Ni, t
OCH3
OCH3
4
5. Синтез алкенов окислительным дегидрированием
• Окислительное дегидрирование чаще всего проводятхлоранилом (2,3,5,6-тетрахлор-1,4-бензохинон) и ДДХ
(2,3-дихлор-5,6-дициано-1,4-бензохинон), и в
значительно более мягких условиях (при температуре
около 100 °С) с выходом более 80 %:
Cl
Cl
Cl
O
O
O
CH2
CH2 Ar +
(2,3-дихлор-5,6-дициано-1,4-бензохинон)
Cl
Cl
O
O
NC
CN
ДДХ
(2,3,5,6-тетрахлор-1,4-бензохинон)
Ar
O
CN
Cl
Cl
хлоранил
Cl
Cl
CN
Ar
CH
CH Ar +
Cl
HO
OH
CN
CN
5
6. II.Окислительные методы получения альдегидов
• 1.Альдегиды, как правило, окисляются легче, чемсубстрат, а также полимеризуются и конденсируются,
поэтому их лучше всего получать дегидрированием
спиртов в присутствии катализаторов на основе меди.
Процесс идет с хорошим выходом, но при более 200 °С.
кат.[Cu,Co(5 %),Cr(2 %)],
C2H5OH
275 °С, выход 85–90 %,
– H2
CH3CHO
• Окисление органических соединений в альдегиды
возможно лишь при использовании селективных
окислителей
и
катализаторов
и
специальных
технологических приемов
6
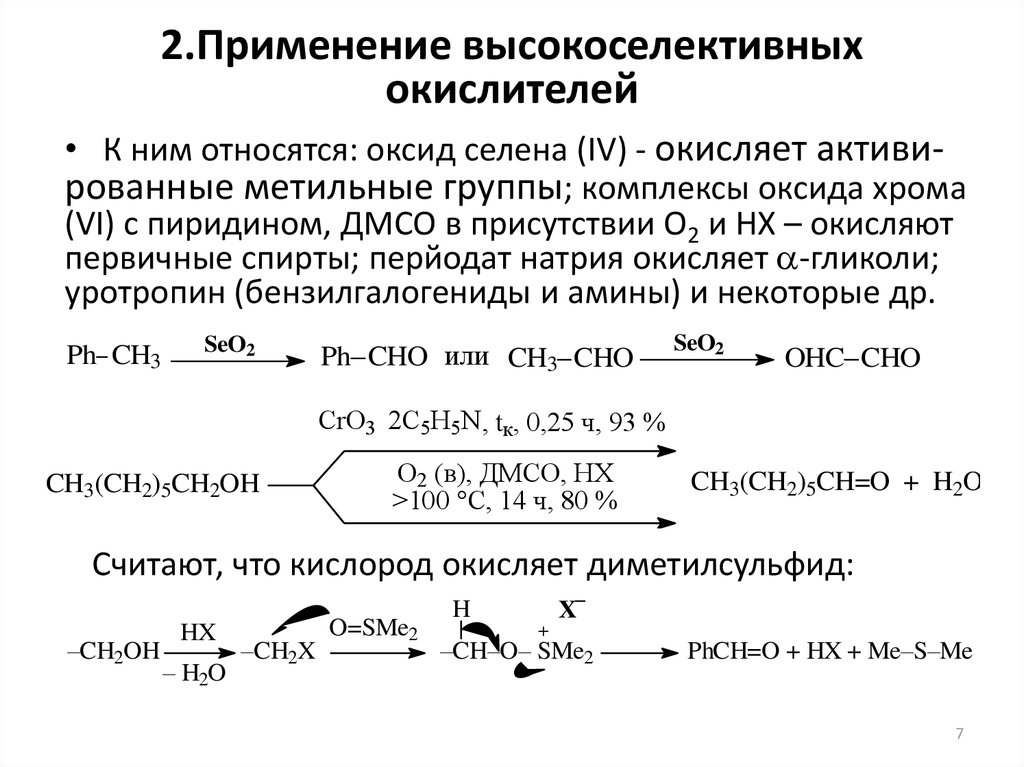
7. 2.Применение высокоселективных окислителей
• К ним относятся: оксид селена (IV) - окисляет активированные метильные группы; комплексы оксида хрома(VI) с пиридином, ДМСО в присутствии О2 и HX – окисляют
первичные спирты; перйодат натрия окисляет a-гликоли;
уротропин (бензилгалогениды и амины) и некоторые др.
Ph CH3
SeO2
Ph CHO или CH3 CHO
SeO2
OHC CHO
CrO3 2C5H5N , tк, 0,25 ч, 93 %
CH3(CH2)5CH2OH
O2 (в), ДМСО, HX
>100 °C, 14 ч, 80 %
CH3(CH2)5CH=O + H2O
Считают, что кислород окисляет диметилсульфид:
–CH2OH
HX
– H2O
–CH2X
O=SMe2
–
H
X
+
–CH–O– SMe2
PhCH=O + HX + Me–S–Me
7
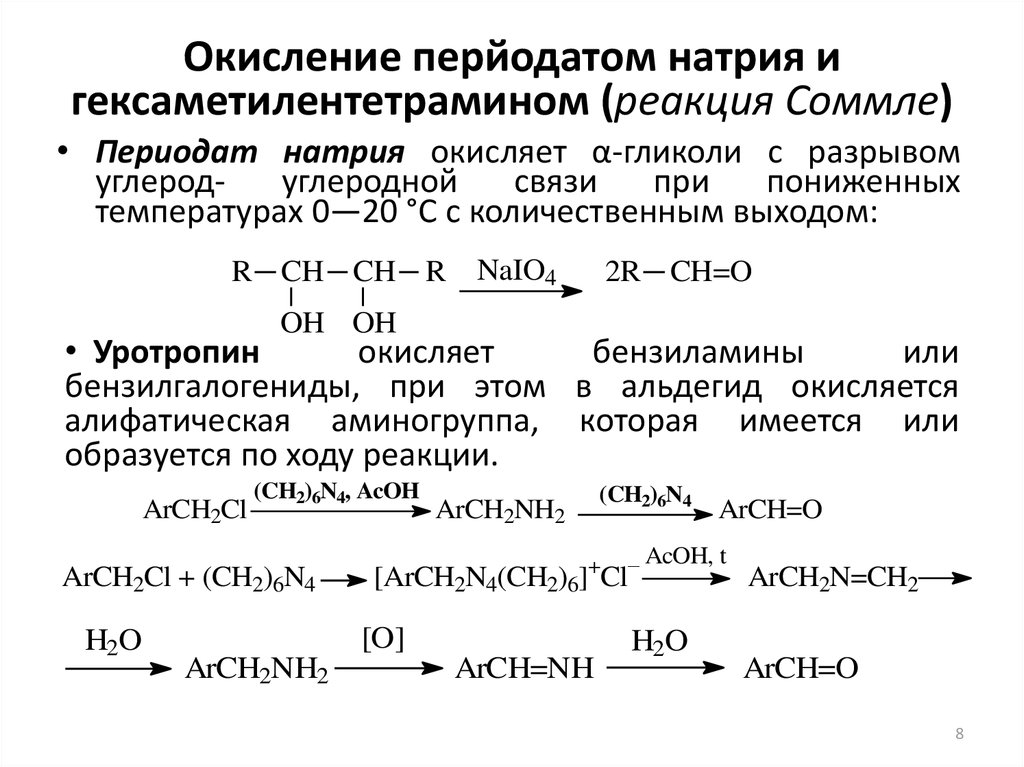
8. Окисление перйодатом натрия и гексаметилентетрамином (реакция Соммле)
• Периодат натрия окисляет α-гликоли с разрывомуглеродуглеродной
связи
при
пониженных
температурах 0—20 °C с количественным выходом:
R CH CH R
NaIO4
2R CH=O
OH OH
• Уротропин
окисляет
бензиламины
или
бензилгалогениды, при этом в альдегид окисляется
алифатическая аминогруппа, которая имеется или
образуется по ходу реакции.
ArCH2Cl
(CH2)6N4, AcOH
ArCH2Cl + (CH2)6N4
H2O
ArCH2NH2
ArCH=O
– AcOH, t
[ArCH2N4(CH2)6]+Cl
[O]
ArCH2NH2
(CH2)6N4
ArCH=NH
H2O
ArCH2N=CH2
ArCH=O
8
9. 3.Применение кислорода и высокоселективных катализаторов
• Неселективное окисление толуола и его производныхвоздухом в жидкой и газовой фазах приводит к
образованию смеси продуктов. Основным продуктом
является бензойная кислота и ее производные.
Бензальдегид образуется при этом в относительно
небольших количествах.
• Применение
высокоселективных
катализаторов
(оксиды урана, молибдена и меди) при окислении
толуола повышает выход бензальдегида до 85—90 %.
Реакцию ведут в газофазной среде пропусканием смеси
паров толуола и воздуха над катализатором при
температуре 475—500 °С:
[O], kat
PhCH3
PhCH=O
UO3, MoO3, CuO2...
9
10. 4.Применение специальных технологических приемов
• При использовании обычных окислителей необходимоприменять специальные технологические приемы
(удаление альдегидов из зоны реакции, превращение в
стабильные производные и др.):
Ar
CH3
CrO3, H+, Ac2O
Cr+3, AcOH
Ar
CH(OAc)2
H2O, H+
AcOH
Ar
CHO
K2Cr2O7, H2SO4
CH3CH2CH2OH
CH3O
CH=CH–CH3
CH3CH2CH=O
Na2Cr2O7, AcOH, H2SO4
Cr2(SO4)3, 50 °C, толуол
3PhCH2Cl + K2Cr2O7 + NaOH
CH3O
CH=O
3PhCH=O + Cr2O3 + 2H2O
10
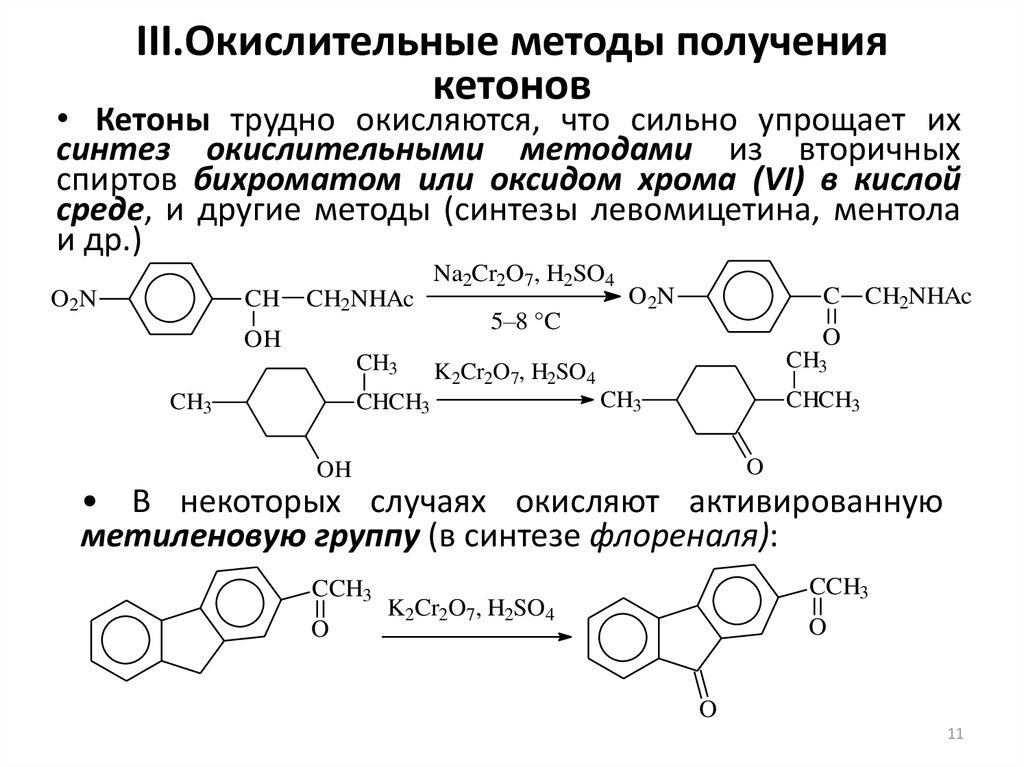
11. III.Окислительные методы получения кетонов
• Кетоны трудно окисляются, что сильно упрощает ихсинтез окислительными методами из вторичных
спиртов бихроматом или оксидом хрома (VI) в кислой
среде, и другие методы (синтезы левомицетина, ментола
и др.)
O2N
CH
CH2NHAc
OH
CH3
CH3
Na2Cr2O7, H2SO4
O2N
C CH2NHAc
5–8 °C
O
CH3
K2Cr2O7, H2SO4
CHCH3
CH3
CHCH3
O
OH
• В некоторых случаях окисляют активированную
метиленовую группу (в синтезе флореналя):
CCH3
O
CCH3
K2Cr2O7, H2SO4
O
O
11
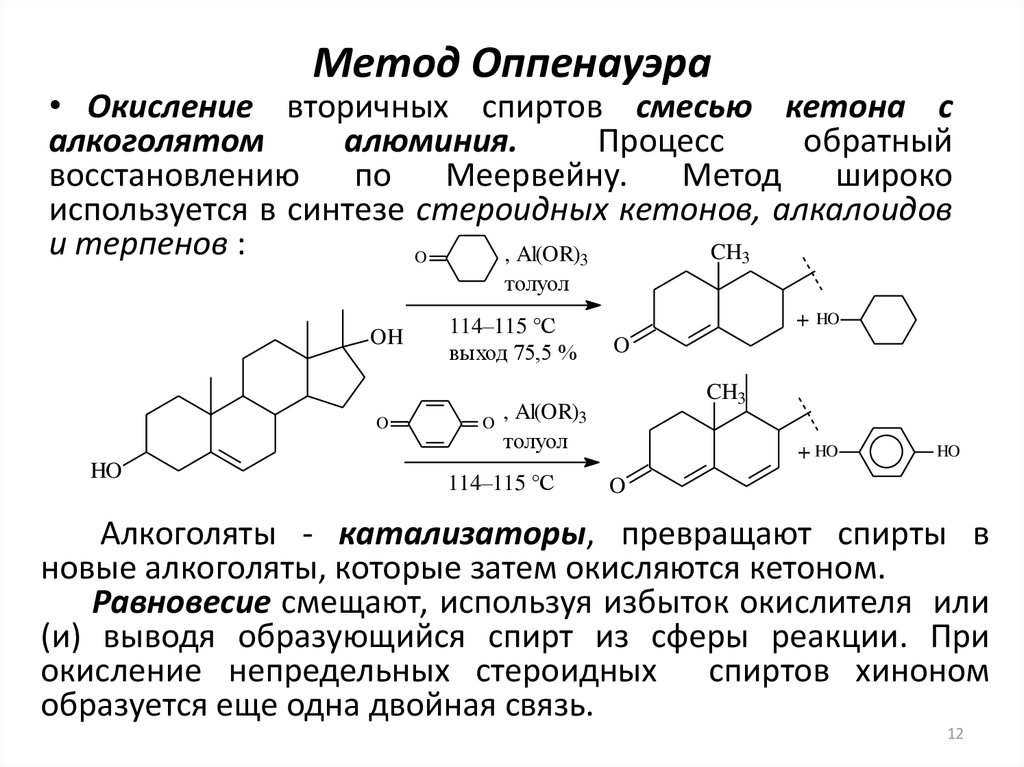
12. Метод Оппенауэра
• Окисление вторичных спиртов смесью кетона салкоголятом
алюминия.
Процесс
обратный
восстановлению
по
Меервейну.
Метод
широко
используется в синтезе стероидных кетонов, алкалоидов
и терпенов :
CH3
, Al(OR)3
O
толуол
OH
O
HO
114–115 °С
выход 75,5 %
O
+
O
CH3
, Al(OR)3
толуол
114–115 °С
HO
+ HO
HO
O
Алкоголяты - катализаторы, превращают спирты в
новые алкоголяты, которые затем окисляются кетоном.
Равновесие смещают, используя избыток окислителя или
(и) выводя образующийся спирт из сферы реакции. При
окисление непредельных стероидных спиртов хиноном
образуется еще одна двойная связь.
12
13. Окисление бензоина в бензил
• Окисление бензоина в уксусной кислоте 71 % азотнойкислотой при температуре около 100 С сопровождается
выделением окислов азота.
• На производстве его окисляют нитратом аммония в
присутствии хлорида железа (III) и соляной кислоты
кипячением реакционной массы в 20 % уксусной
кислоте. При этом железо выполняет роль катализатора.
Это значительно улучшает экологические показатели
производства.
C6H5
NH4NO3, AcOH, H2O
CH C C6H5
HCl / FeCl3
102–105 °C
OH O
H
+3
2Fe
C6H5
O O
бензил (96 %)
+
C
+2
OH
+2
C C
2e–
C
2Fe
C6H5
2Fe
+
+
OH
+H
+3
+ 2H + NH4NO3 = 2Fe
+
–H
C
O
+ N2 + 3H2O
13
14. IV.Каталитическое окисление парафинов кислородом воздуха в карбоновые кислоты
• Неразветвленныеалканы
трудноокисляемые
соединениями. Обычные окислители не действуют на
них. Лишь горячая хромовая смесь окисляет алканы, но с
образованием большого числа продуктов.
• Промышленным окислением алканов кислородом
воздуха в присутствии катализаторов получают
синтетические карбоновые кислоты, которые широко
используются в промышленности, в том числе в синтезе
лекарств.
CH3(CH2)nCH3
O2/ kt
CH3COOH + CH3(CH2)n-2COOH + CH3CH2COOH ...
• Сырье - твердые и жидкие парафины (С5 С23).
Окисление ведут в жидкой фазе при 100—150 °С.
Механизм
в
условиях
гомогенного
катализа
радикальный. Выход продукции 60—70 %. Получают
смесь жирных кислот с цепями разной длины, т.к.
окисляемость всех метиленовых групп одинакова.
14
15. V.Окисление активированных групп в карбоновые кислоты
• Активированные алкильные группы (связанные скарбонильной группой, ароматическим кольцом и
другими акцепторными группами) –
-окисляются сильными окислителями;
- легче, чем алканы;
- как правило, по α-углеродному атому;
- окислители: разбавленная азотная кислота, бихромат и
хромовый ангидрид в кислой среде, перманганат калия и
др.
- используется
каталитическое
окисление
и
окислительное
амминирование
в
присутствии
катализатора.
Ar-CH2-CH3
Na2Cr2O7, H2SO4
60°C
Ar
COOH
15
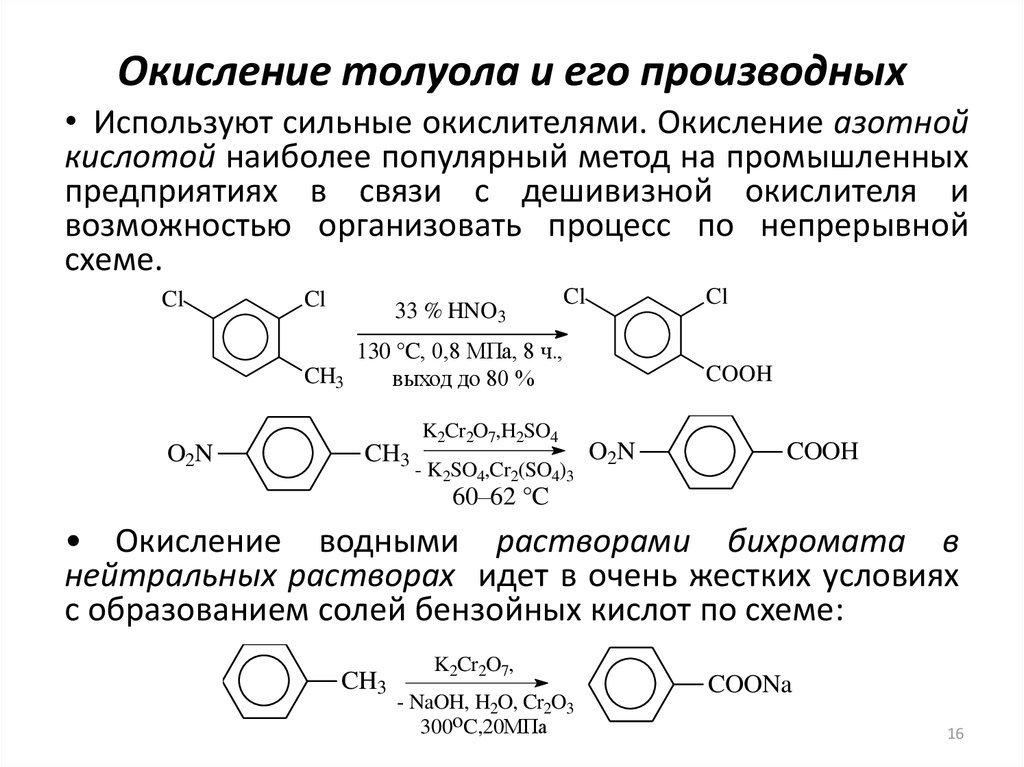
16. Окисление толуола и его производных
• Используют сильные окислителями. Окисление азотнойкислотой наиболее популярный метод на промышленных
предприятиях в связи с дешивизной окислителя и
возможностью организовать процесс по непрерывной
схеме.
Cl
Cl
33 % HNO3
Cl
Cl
130 °C, 0,8 МПа, 8 ч.,
CH3
выход до 80 %
O2N
CH3
K2Cr2O7,H2SO4
- K2SO4,Cr2(SO4)3
COOH
O2N
COOH
60–62 °C
• Окисление водными растворами бихромата в
нейтральных растворах идет в очень жестких условиях
с образованием солей бензойных кислот по схеме:
CH3
K2Cr2O7,
- NaOH, H2O, Cr2O3
300oC,20МПа
COONa
16
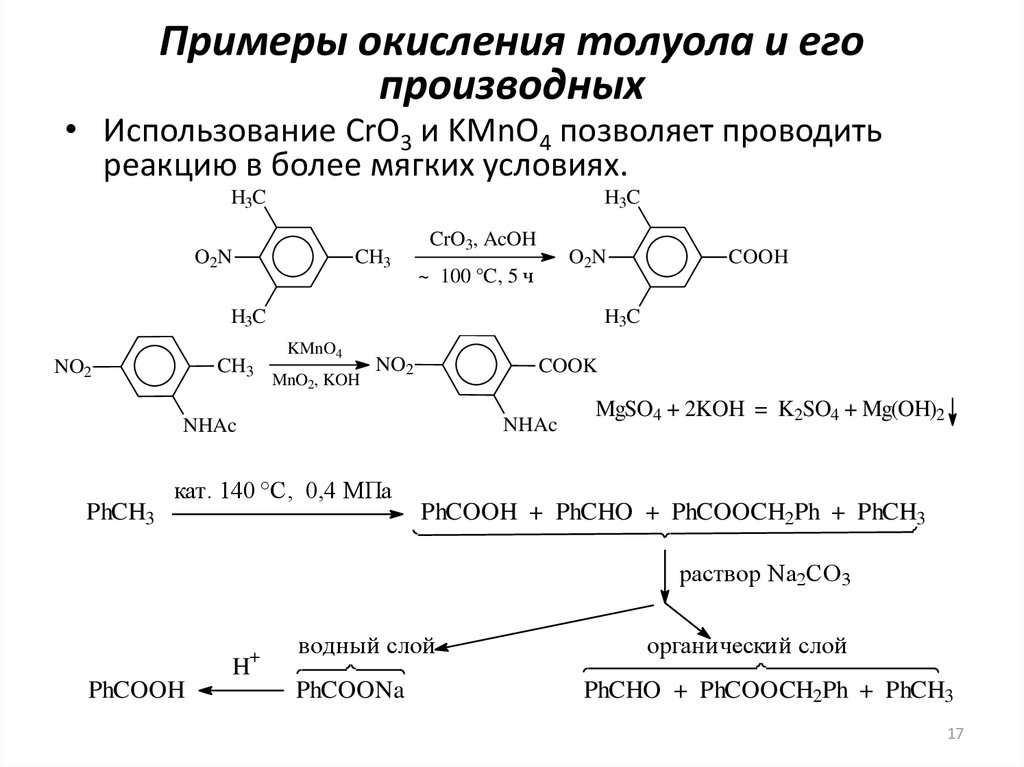
17. Примеры окисления толуола и его производных
• Использование CrO3 и KMnO4 позволяет проводитьреакцию в более мягких условиях.
H3C
H3C
O2N
CH3
CrO3, AcOH
O2N
~ 100 °C, 5 ч
H3C
CH3
NO2
H3C
KMnO4
MnO2, KOH
NO2
COOK
NHAc
NHAc
PhCH3
COOH
кат. 140 °С, 0,4 МПа
MgSO4 + 2KOH = K2SO4 + Mg(OH)2
PhCOOH + PhCHO + PhCOOCH2Ph + PhCH3
раствор Na2CO3
+
H
PhCOOH
водный слой
PhCOONa
органический слой
PhCHO + PhCOOCH2Ph + PhCH3
17
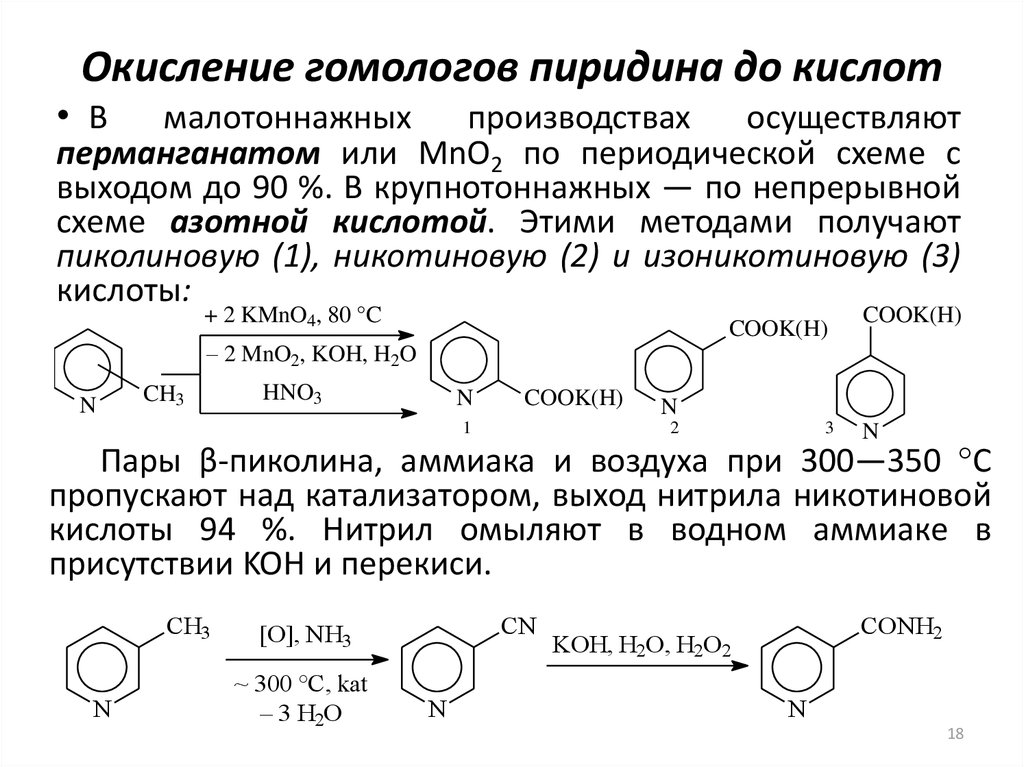
18. Окисление гомологов пиридина до кислот
• Вмалотоннажных
производствах
осуществляют
перманганатом или MnO2 по периодической схеме с
выходом до 90 %. В крупнотоннажных — по непрерывной
схеме азотной кислотой. Этими методами получают
пиколиновую (1), никотиновую (2) и изоникотиновую (3)
кислоты:
+ 2 KMnO4, 80 °C
COOK(H)
– 2 MnO2, KOH, H2O
N
CH3
HNO3
N
COOK(H)
1
COOK(H)
N
2
3
N
Пары β-пиколина, аммиака и воздуха при 300—350 °С
пропускают над катализатором, выход нитрила никотиновой
кислоты 94 %. Нитрил омыляют в водном аммиаке в
присутствии KOH и перекиси.
CH3
N
CN
[O], NH3
~ 300 °C, kat
– 3 H2O
N
CONH2
KOH, H2O, H2O2
N
18
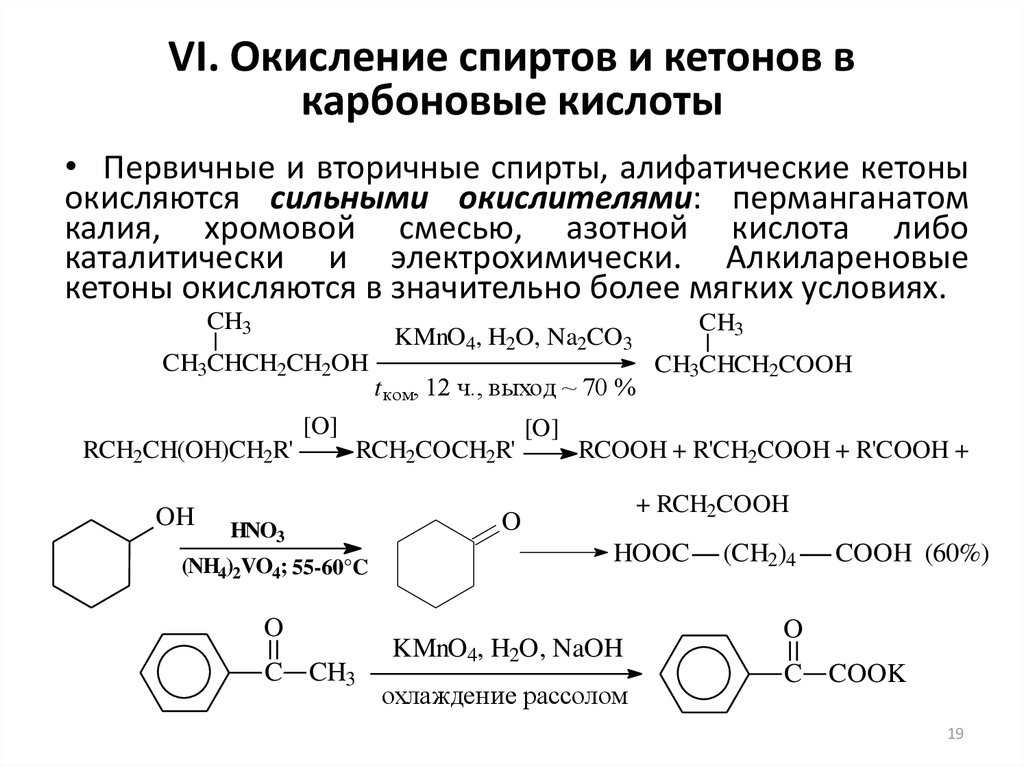
19. VI. Окисление спиртов и кетонов в карбоновые кислоты
• Первичные и вторичные спирты, алифатические кетоныокисляются сильными окислителями: перманганатом
калия, хромовой смесью, азотной кислота либо
каталитически и электрохимически. Алкилареновые
кетоны окисляются в значительно более мягких условиях.
CH3
CH3CHCH2CH2OH
t ком, 12 ч., выход ~ 70 %
[O]
RCH2CH(OH)CH2R'
OH
RCH2COCH2R'
HNO3
(NH4)2VO4; 55-60°C
O
C CH3
CH3
KMnO4, H2O, Na2CO3
[O]
CH3CHCH2COOH
RCOOH + R'CH2COOH + R'COOH +
+ RCH2COOH
O
HOOC
KMnO4, H2O, NaOH
охлаждение рассолом
(CH2)4
COOH (60%)
O
C COOK
19
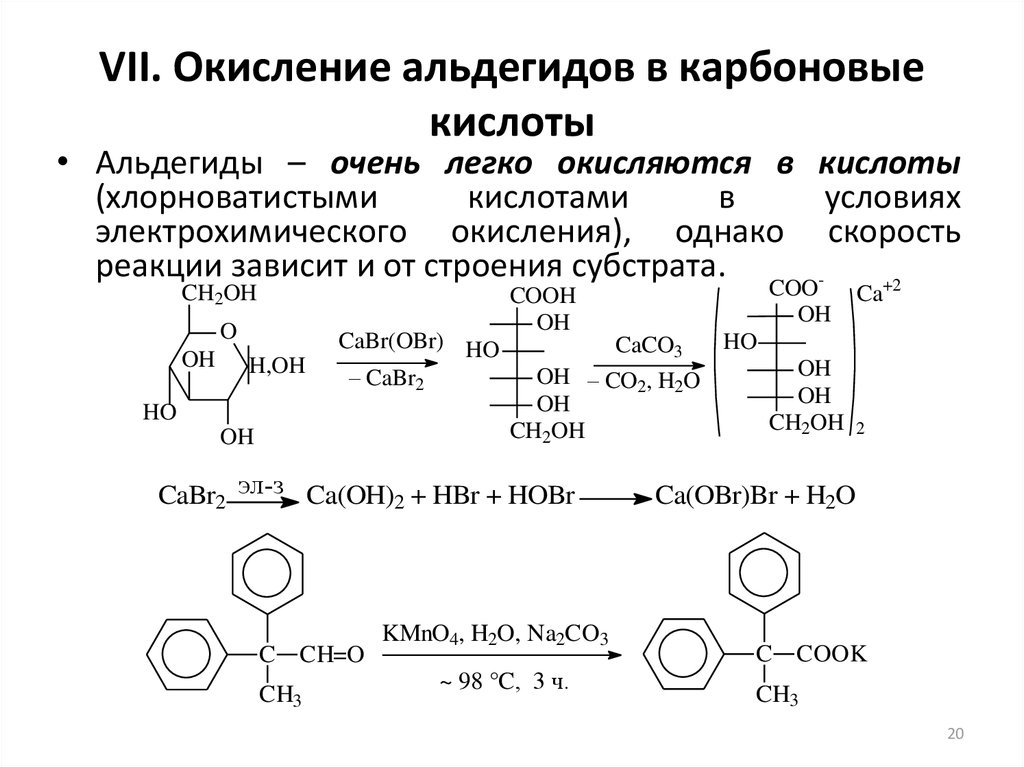
20. VII. Окисление альдегидов в карбоновые кислоты
• Альдегиды – очень легко окисляются в кислоты(хлорноватистыми
кислотами
в
условиях
электрохимического окисления), однако скорость
реакции зависит и от строения субстрата.
+2
CH2OH
O
OH
H,OH
CaBr(OBr) HO
– CaBr2
HO
OH
CaCO3
OH – CO2, H2O
OH
CH2OH
CaBr2 эл-з Ca(OH)2 + HBr + HOBr
C CH=O
CH3
COO
OH
COOH
OH
KMnO4, H2O, Na2CO3
~ 98 °C, 3 ч.
Ca
HO
OH
OH
CH2OH
2
Ca(OBr)Br + H2O
C COOK
CH3
20
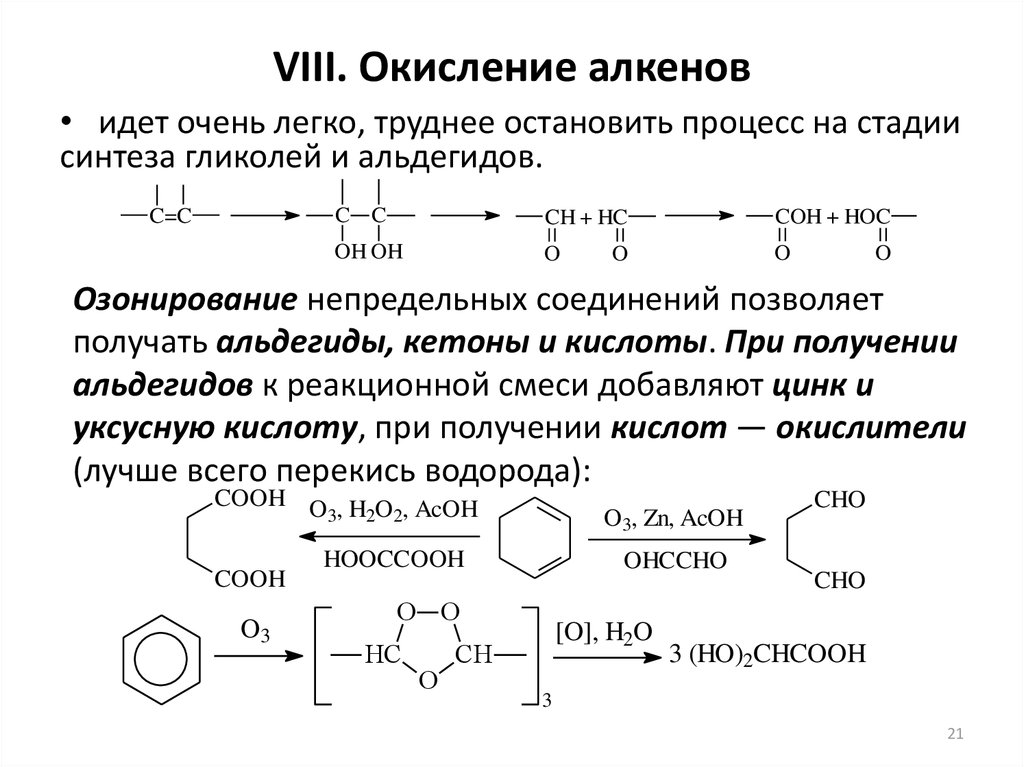
21. VIII. Окисление алкенов
• идет очень легко, труднее остановить процесс на стадиисинтеза гликолей и альдегидов.
C=C
C C
CH + HC
COH + HOC
OH OH
O
O
O
O
Озонирование непредельных соединений позволяет
получать альдегиды, кетоны и кислоты. При получении
альдегидов к реакционной смеси добавляют цинк и
уксусную кислоту, при получении кислот — окислители
(лучше всего перекись водорода):
COOH O , H O , AcOH
3
2 2
COOH
O3
O3, Zn, AcOH
HOOCCOOH
OHCCHO
O O
HC
O
[O], H2O
CH
CHO
CHO
3 (HO)2CHCOOH
3
21
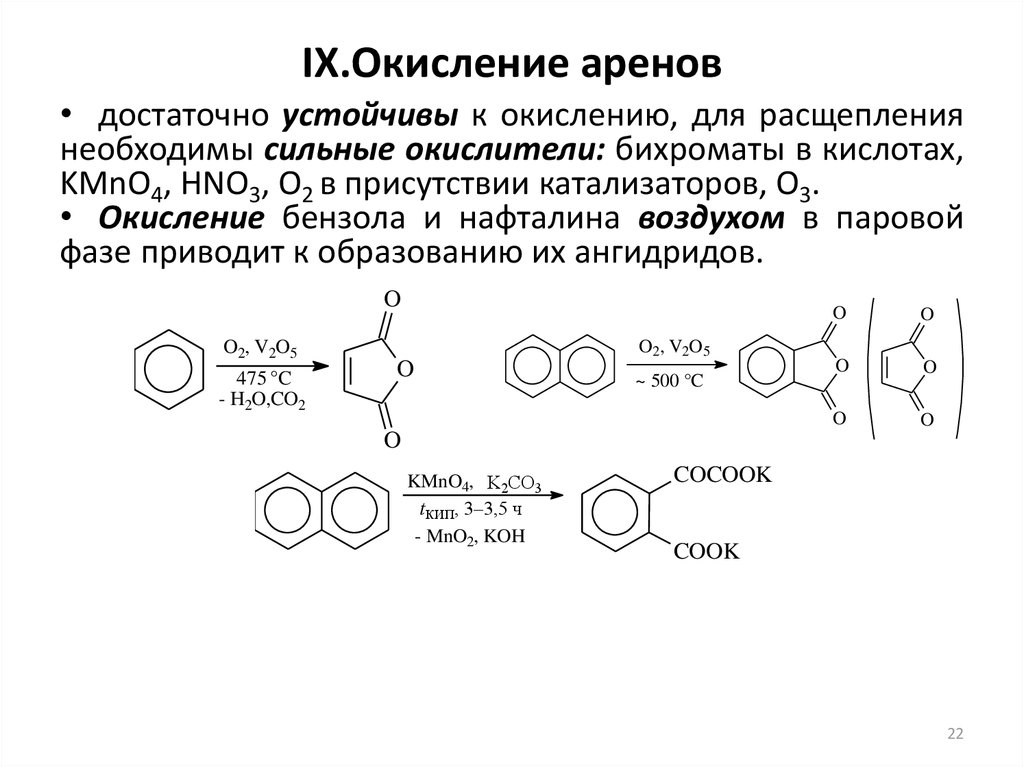
22. IX.Окисление аренов
• достаточно устойчивы к окислению, для расщеплениянеобходимы сильные окислители: бихроматы в кислотах,
KMnO4, HNO3, O2 в присутствии катализаторов, O3.
• Окисление бензола и нафталина воздухом в паровой
фазе приводит к образованию их ангидридов.
O
O2, V2O5
475 °C
- H2O,CO2
O2, V2O5
O
~ 500 °C
O
O
O
O
O
O
O
KMnO4, K2CO3
tкип, 3–3,5 ч
- MnO2, KOH
COCOOK
COOK
22
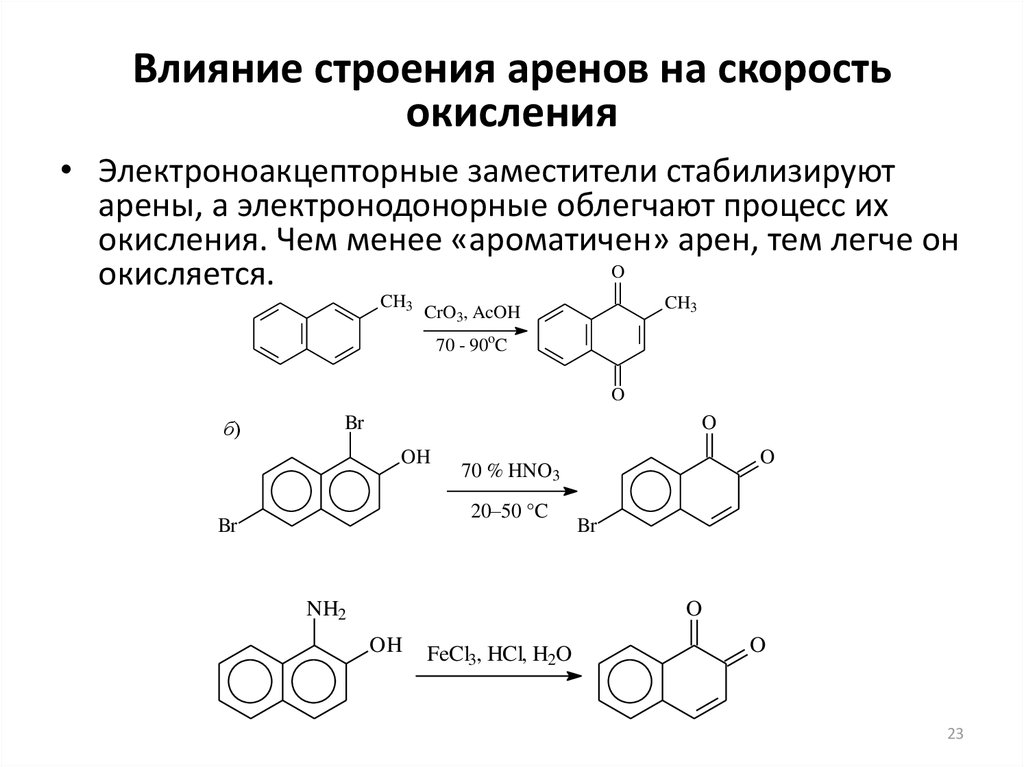
23. Влияние строения аренов на скорость окисления
• Электроноакцепторные заместители стабилизируютарены, а электронодонорные облегчают процесс их
окисления. Чем менее «ароматичен» арен, тем легче он
O
окисляется.
CH3
CH3
CrO3, AcOH
70 - 90oC
O
б)
Br
O
OH
20–50 °C
Br
O
70 % HNO3
NH2
Br
O
OH
FeCl3, HCl, H2O
O
23
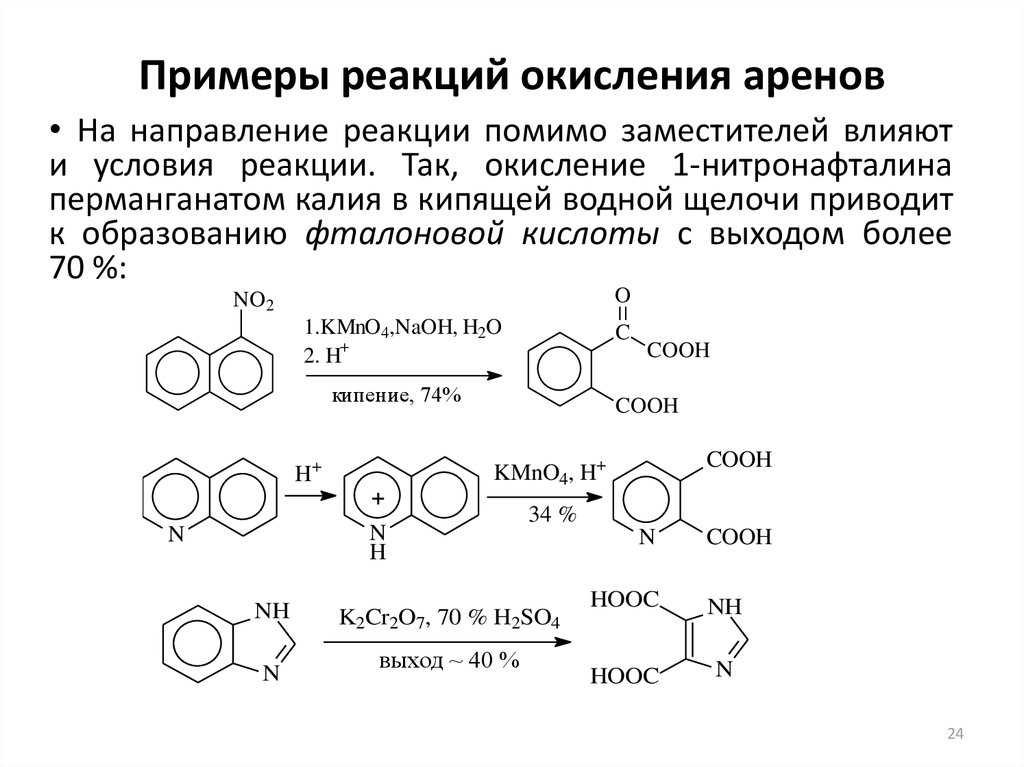
24. Примеры реакций окисления аренов
• На направление реакции помимо заместителей влияюти условия реакции. Так, окисление 1-нитронафталина
перманганатом калия в кипящей водной щелочи приводит
к образованию фталоновой кислоты с выходом более
70 %:
O
NO2
1.KMnO4,NaOH, H2O
+
2. H
C
кипение, 74%
COOH
+
N
H
NH
N
COOH
KMnO4, H+
H+
N
COOH
34 %
K2Cr2O7, 70 % H2SO4
выход ~ 40 %
N
COOH
HOOC
NH
HOOC
N
24
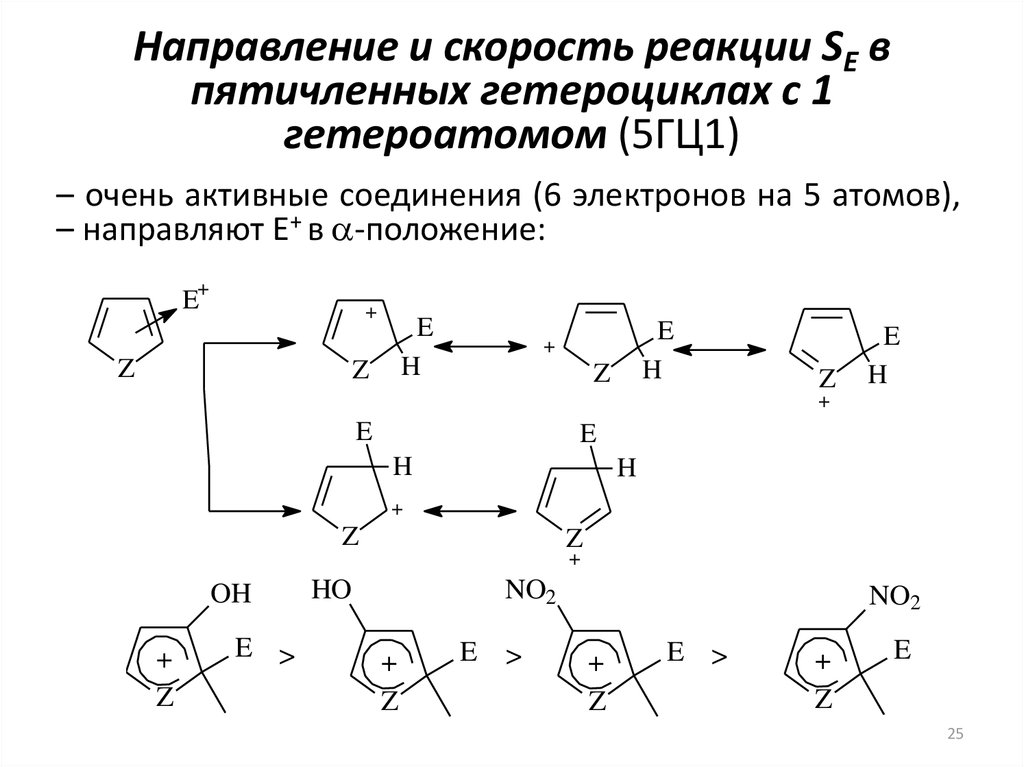
25. Направление и скорость реакции SE в пятичленных гетероциклах с 1 гетероатомом (5ГЦ1)
– очень активные соединения (6 электронов на 5 атомов),– направляют E+ в a-положение:
+
E
+
Z
E
H
Z
E
H
+
Z
Z
E
H
+
E
E
H
H
+
Z
OH
+
Z
E >
Z
+
HO
NO2
+
Z
E
>
NO2
+
Z
E >
+
Z
E
25
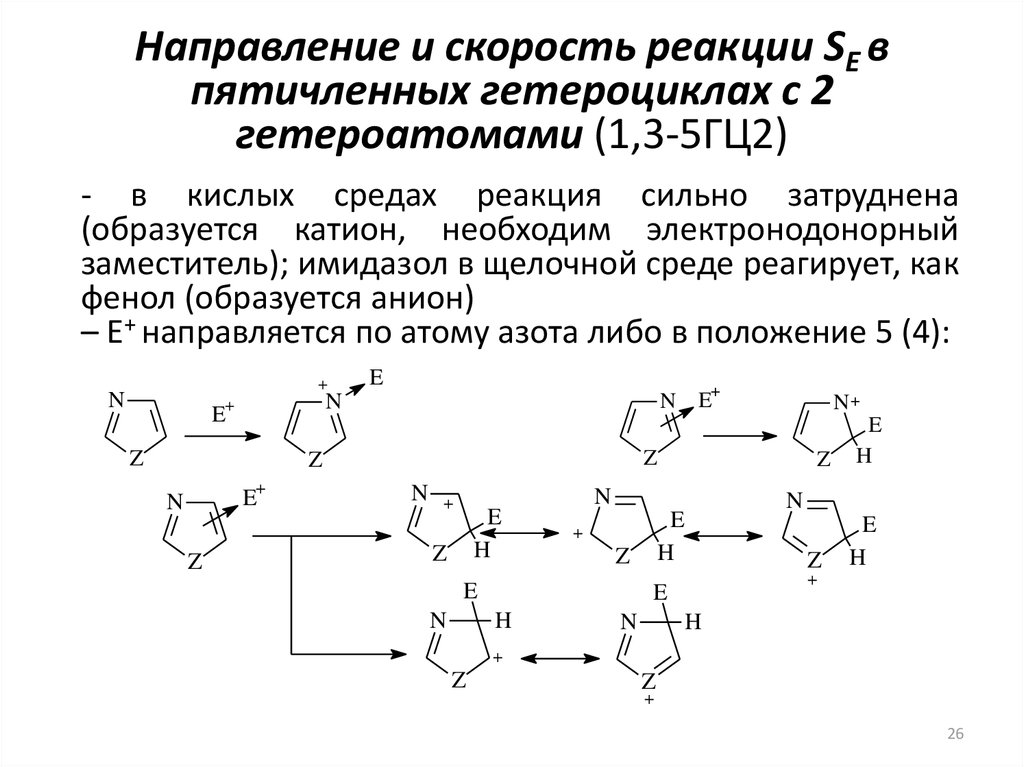
26. Направление и скорость реакции SE в пятичленных гетероциклах с 2 гетероатомами (1,3-5ГЦ2)
- в кислых средах реакция сильно затруднена(образуется катион, необходим электронодонорный
заместитель); имидазол в щелочной среде реагирует, как
фенол (образуется анион)
– E+ направляется по атому азота либо в положение 5 (4):
+
N
E
+
N E
N
+
E
Z
Z
Z
+
E
N
Z
N+
N
+
E
H
Z
N
N
E
H
+
Z
E
N
Z
Z
N
E
H
+
E
H
E
H
H
+
Z
Z
+
26
27. Направление и скорость реакции SE в пятичленных гетероциклах с 2 гетероатомами (1,2-5ГЦ2)
• в кислых средах реакция сильно затруднена(образуется катион, необходим электронодонорный
заместитель); пиразол в щелочной среде реагирует,
как фенол (образуется анион)
• E+ направляется по атому азота либо в положение 4:
E+
N
+
N
Z
E
Z
N+
E
+
N
Z
E
Z
E
N
+
Z
27
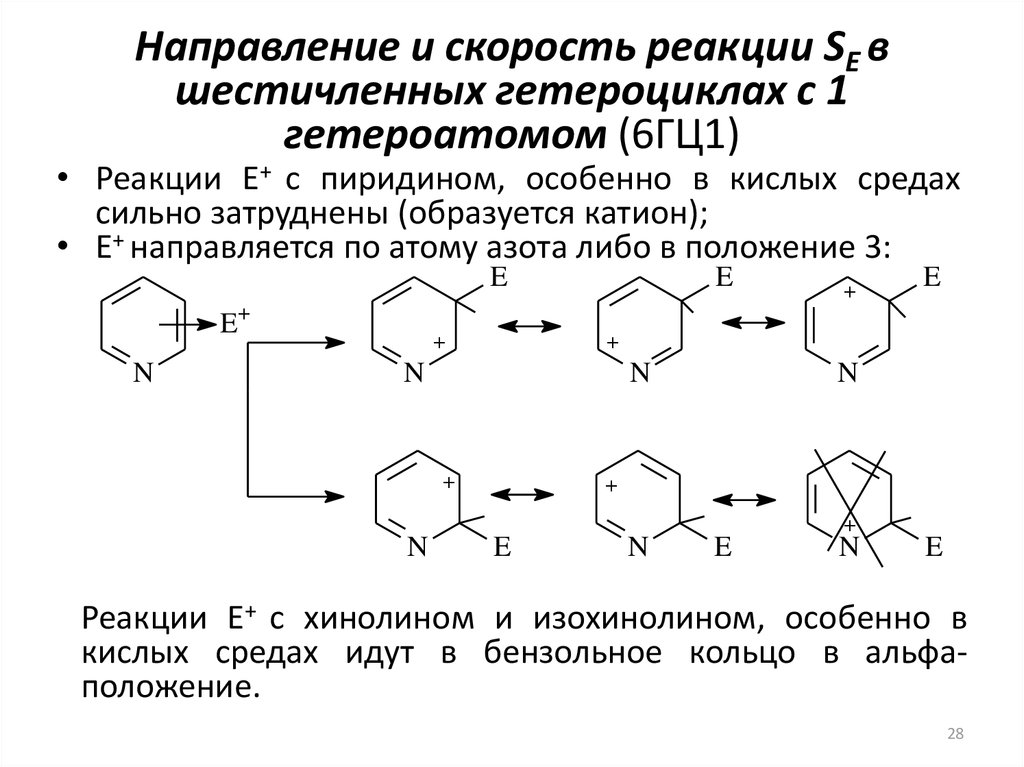
28. Направление и скорость реакции SE в шестичленных гетероциклах с 1 гетероатомом (6ГЦ1)
• Реакции E+ с пиридином, особенно в кислых средахсильно затруднены (образуется катион);
• E+ направляется по атому азота либо в положение 3:
E
E+
N
+
E
+
E
+
N
N
+
N
+
+
N
E
N
E
N
E
Реакции E+ с хинолином и изохинолином, особенно в
кислых средах идут в бензольное кольцо в альфаположение.
28
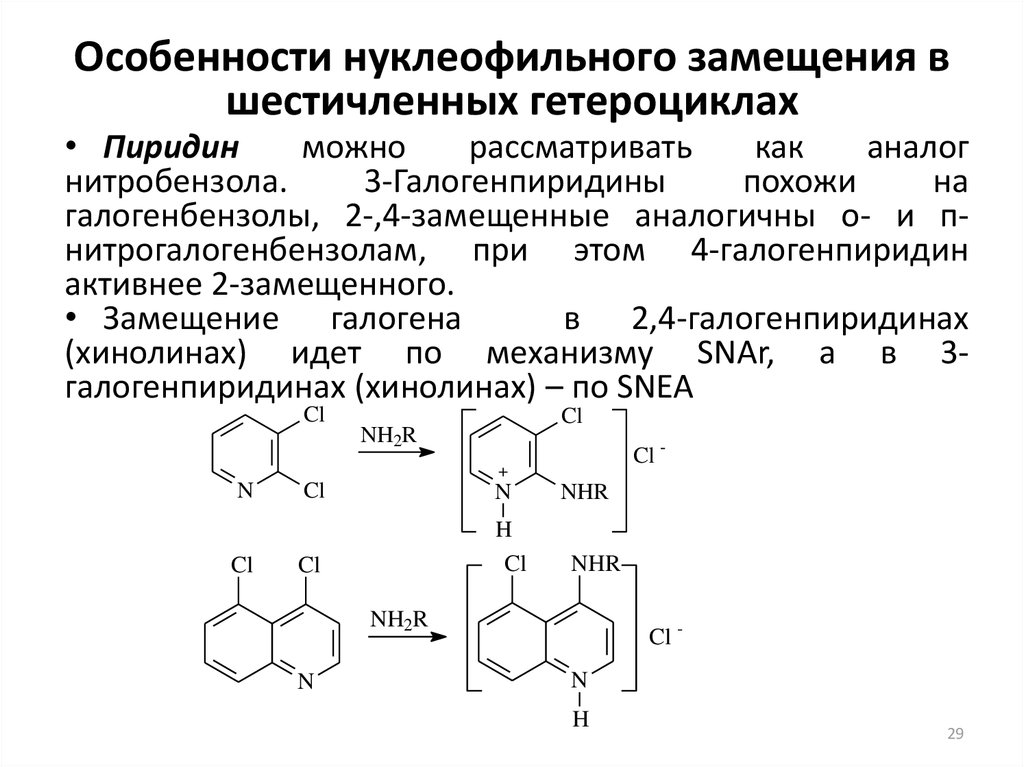
29. Особенности нуклеофильного замещения в шестичленных гетероциклах
• Пиридинможно
рассматривать
как
аналог
нитробензола.
3-Галогенпиридины
похожи
на
галогенбензолы, 2-,4-замещенные аналогичны о- и пнитрогалогенбензолам, при этом 4-галогенпиридин
активнее 2-замещенного.
• Замещение галогена
в 2,4-галогенпиридинах
(хинолинах) идет по механизму SNAr, а в 3галогенпиридинах (хинолинах) – по SNEA
Cl
Cl
NH2R
Cl -
+
N
Cl
N
NHR
H
Cl
Cl
Cl
NHR
NH2R
N
Cl N
H
29
30. Особенности нуклеофильного замещения в шестичленных гетероциклах
• В диазинах нуклеофильная подвижность атома галогенаувеличивается. 2-Хлорпиразин и 3-хлорпиридазин
активнее 2-хлорпиридина, а галогенпиримидины еще
активнее.
• 2-Хлорпиримидин реагирует с бутиламином уже при
комнатной температуре, а 4-хлорпиримидин трудно
выделить в индивидуальном состоянии из-за легкого
отщепления хлора.
Cl
~
<<
N
Cl
Cl
Cl
Cl
N
Cl
N
~
N
<
<<
N
N
Cl N
как п-нитрохлординитрохлорбензол
бензол
<
Cl
N
N
<
N
N
тринитрохлорбензол
30
31. ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ №
ДисциплинаОХТ
Кафедра
ХТЛВ
1. C-, N-, O-Нитрозирование (вторичных и третичных
аминов, фенолов, спиртов, алканов): схемы и механизмы
реакций, влияние строение субстрата на направление и
скорость реакции, влияние условий реакции на выход
продукта.
2. О-Алкилирование фенолов: схемы и механизмы реакций,
алкилирующие агенты и их активность, влияние строения
субстрата на скорость реакции, катализаторы, примеры
реакций.
3. Сульфирование аренов концентрированной серной
кислотой: область применения; тепловой эффект, влияние
концентрации и температуры на направление и скорость
реакции; аппаратура.
Одобрено на заседании кафедры 5 декабря 2017 г (протокол №5)
Заведующий кафедрой, доц.
Лалаев Б.Ю.
31













 Химия
Химия








