Похожие презентации:
Общие пути обмена аминокислот. Конечные продукты азотистого обмена
1. Кировский государственный медицинский университет
ОБЩИЕ ПУТИ ОБМЕНААМИНОКИСЛОТ.
КОНЕЧНЫЕ ПРОДУКТЫ
АЗОТИСТОГО ОБМЕНА.
2. Значение белков. Функции.
Ферментативная
Гормональная (инсулин)
Рецепторная
Транспортная
Структурная (мембраны)
Опорная (коллаген,эластин)
Трофическая (овоальбумин)
Энергетическая (17.1 кДж – 1 г)
3. Значение белков. Функции
Механохимическая (актин, миозин)
Электроосмотическая (Na, K-АТФ-аза)
Энерготрансформаторная (АТФ-синтаза)
Когенетическая
Генно-регуляторная
Иммунологическая
Обезвреживающая
Гемостатическая (фибриноген и белки
сверт.крови)
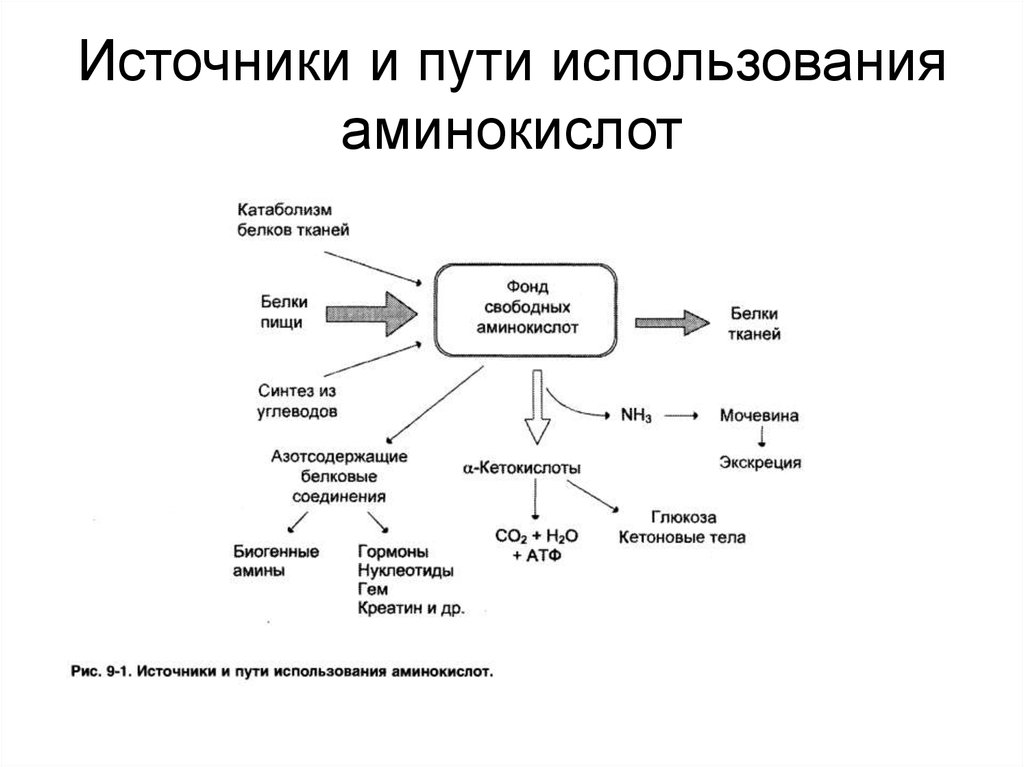
4. Источники и пути использования аминокислот
• Аминокислоты - 30 г.• В крови - 35 - 65 мг/дл.
• Белки - 15 кг
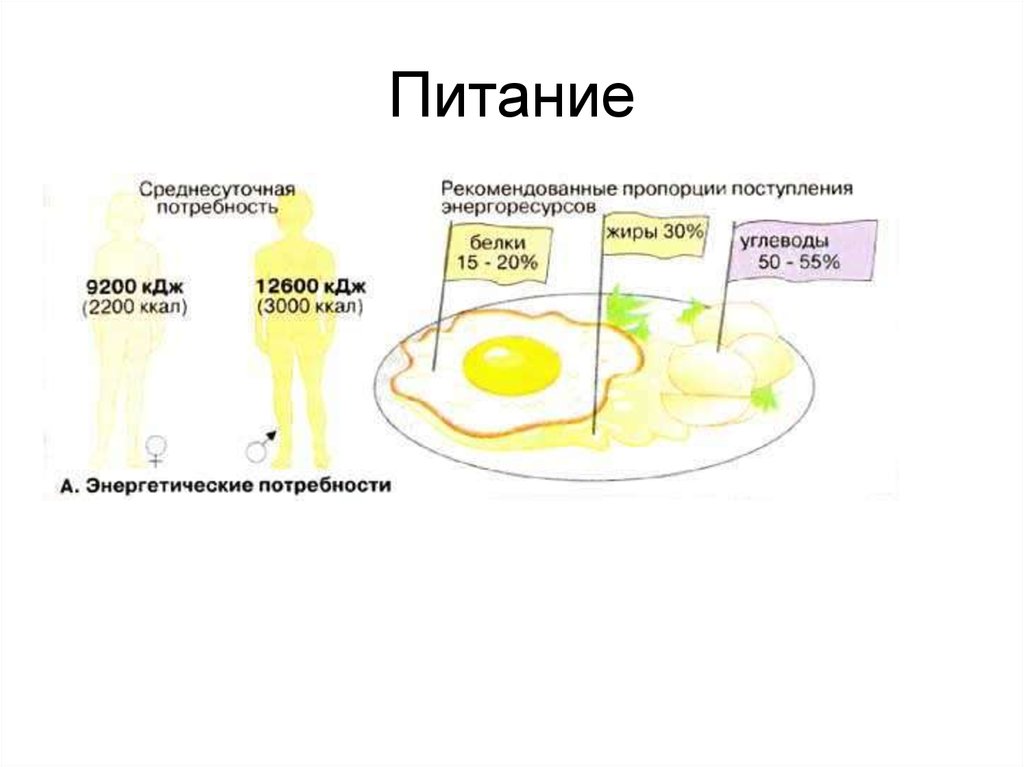
5. Питание
6. Источники и пути использования аминокислот
7.
8. Азотистый баланс
Метаболизм азота связан с обменом АК и внорме сбалансирован.
Азотистое равновесие - количества
поступающего и выделяемого белкового
N2 равны.
Положительный баланс – выделяется
только часть вновь поступающего N2
(рост организма).
Отрицательный баланс - выделяется N2
больше, чем поступает (следствие
заболеваний).
9.
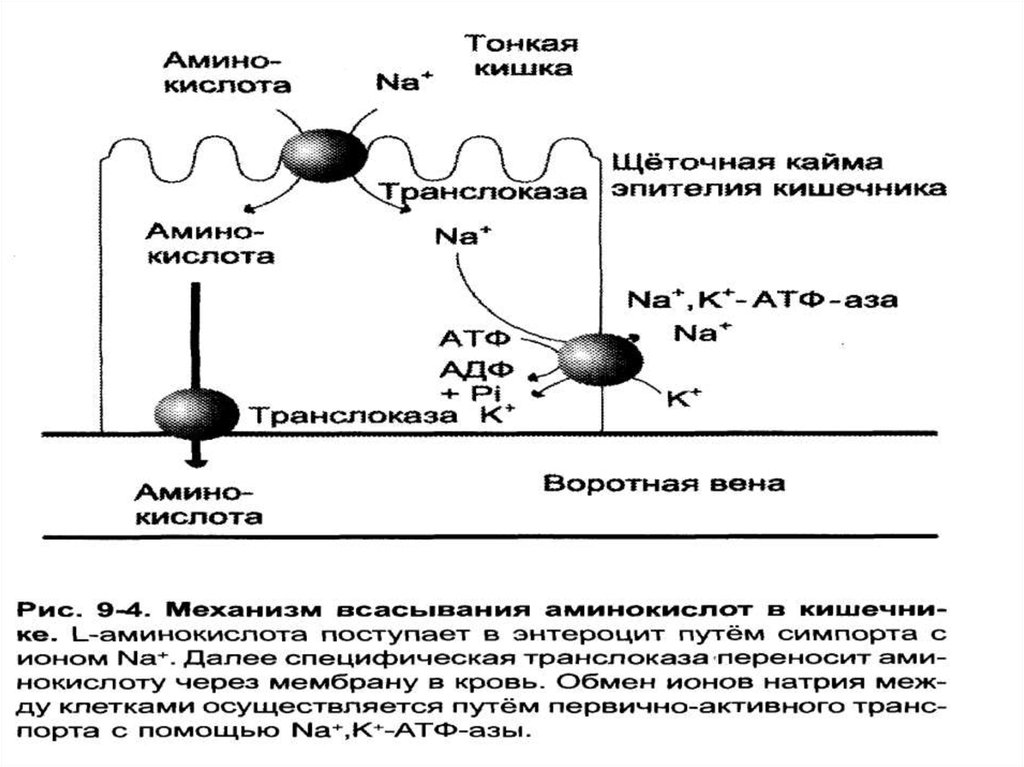
• Полученные с пищей белкиподвергаются полному гидролизу в
ЖКТ до АК, которые всасываются и
распределяются в организме.
• 8 из 20 протеиногенных АК у
человека незаменимые АК.
10. НЕЗАМЕНИМЫЕ АК
Val, Leu, Ile, Tre,Lys, Met, Phe,Trp
11.
12. Общие пути обмена АК
ДЕЗАМИНИРОВАНИЕ
ТРАНСАМИНИРОВАНИЕ
ДЕКАРБОКСИЛИРОВАНИЕ
БИОСИНТЕЗ ЗАМЕНИМЫХ
АМИНОКИСЛОТ
13. ДЕЗАМИНИРОВАНИЕ
• Элиминация от АК NH2-группыв виде аммиака.
Реакция протекает по различным
механизмам.
14.
4 вида дезаминирования:
- ВОССТАНОВИТЕЛЬНОЕ
- ГИДРОЛИТИЧЕСКОЕ
- ОКИСЛИТЕЛЬНОЕ
- ВНУТРИМОЛЕКУЛЯРНОЕ
(ЭЛИМИНИРУЮЩЕЕ).
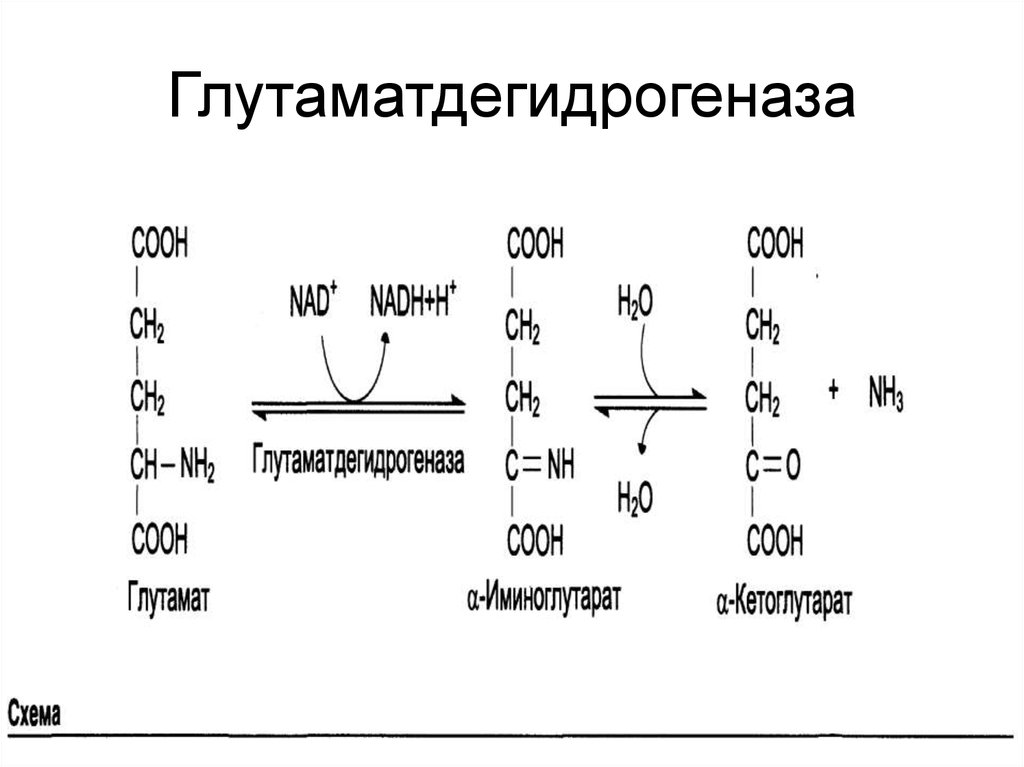
15. Химизм окислительного дезаминирования
• Окислительное дезаминирование.Аминогруппа вначале окисляется до
иминогруппы (водороды
переносятся на НАД+). На второй
стадии происходит гидролитическое
отщепление иминогруппы и
образуется 2-кетокислота.
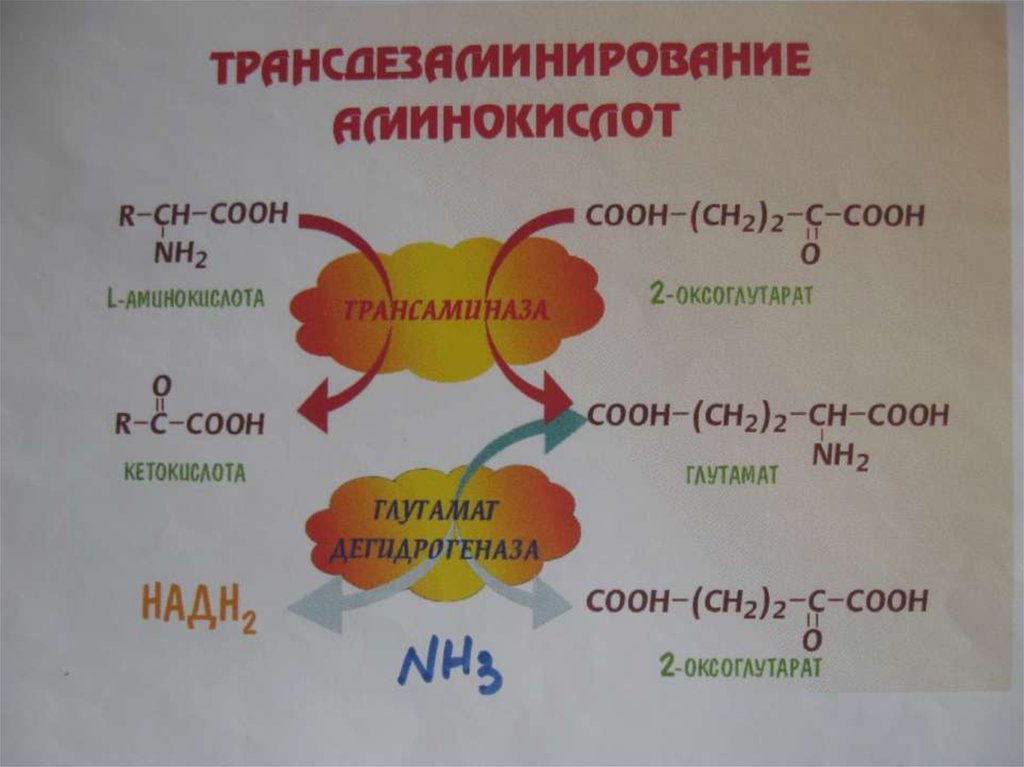
16. Глутаматдегидрогеназа
17.
18. ТРАНСАМИНИРОВАНИЕ
• А.Е. Браунштейн• М.Г. Крицман (1937)
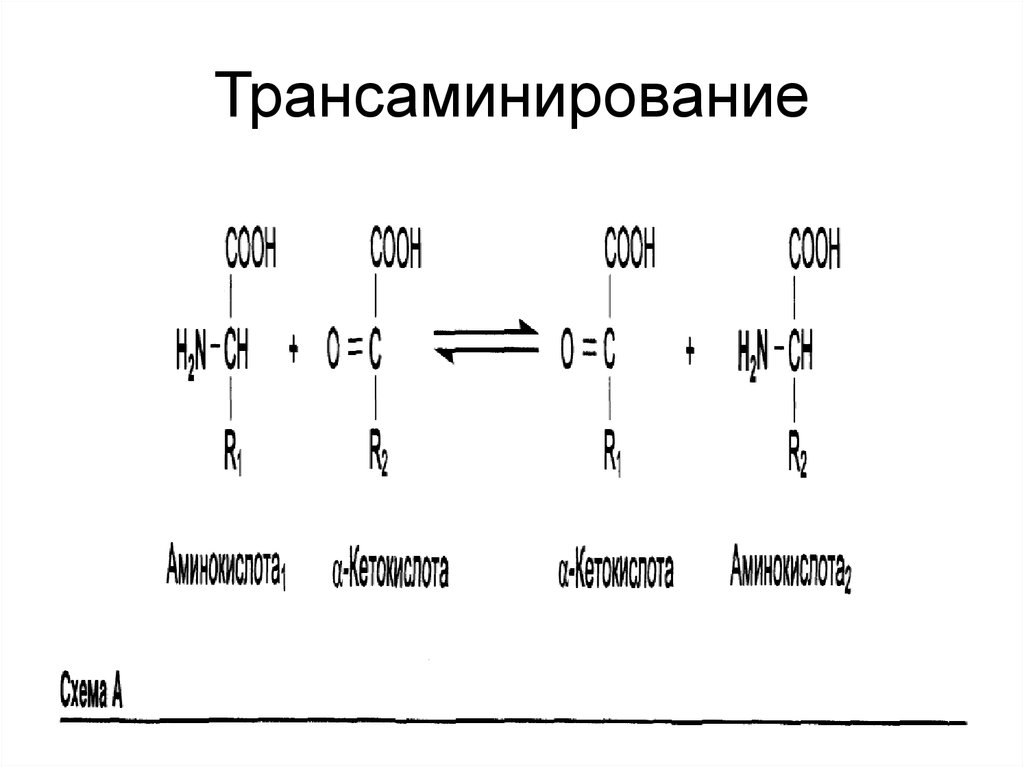
19. Трансаминирование
• Перенос аминогруппы с любой АК наальфа-кетокислоту без
промежуточного образования
аммиака.
• АК + кетокислота Новая АК + новая
кетокислота
• Глу + ПВК альфа-КГ + Ала
20. Трансаминирование
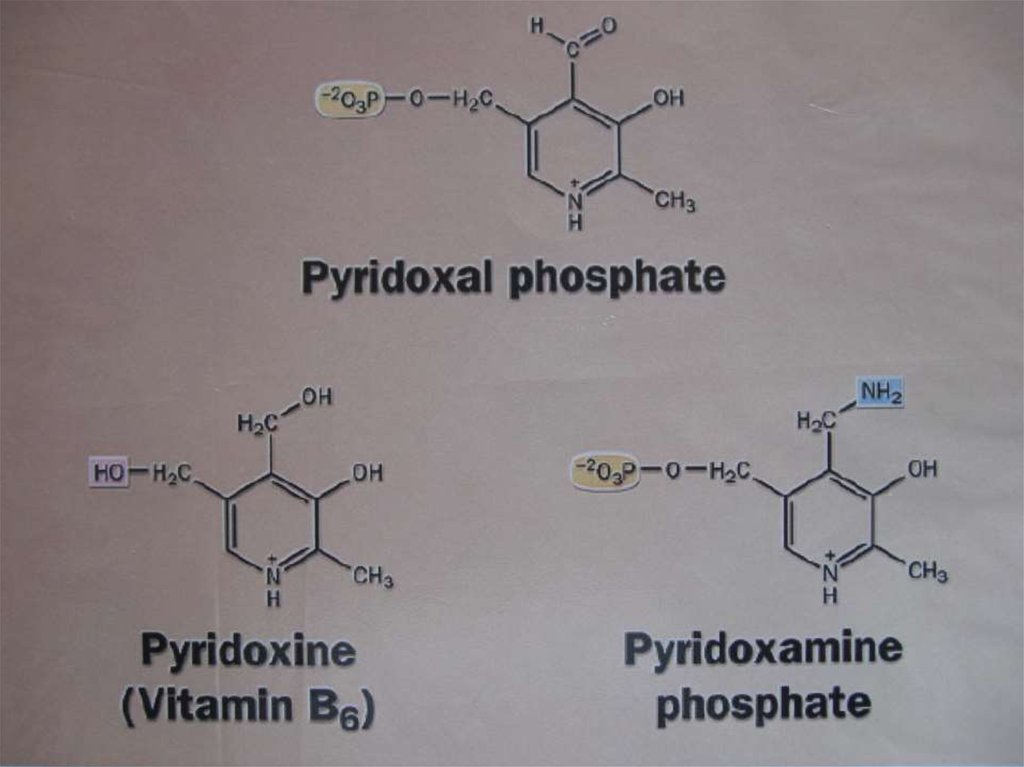
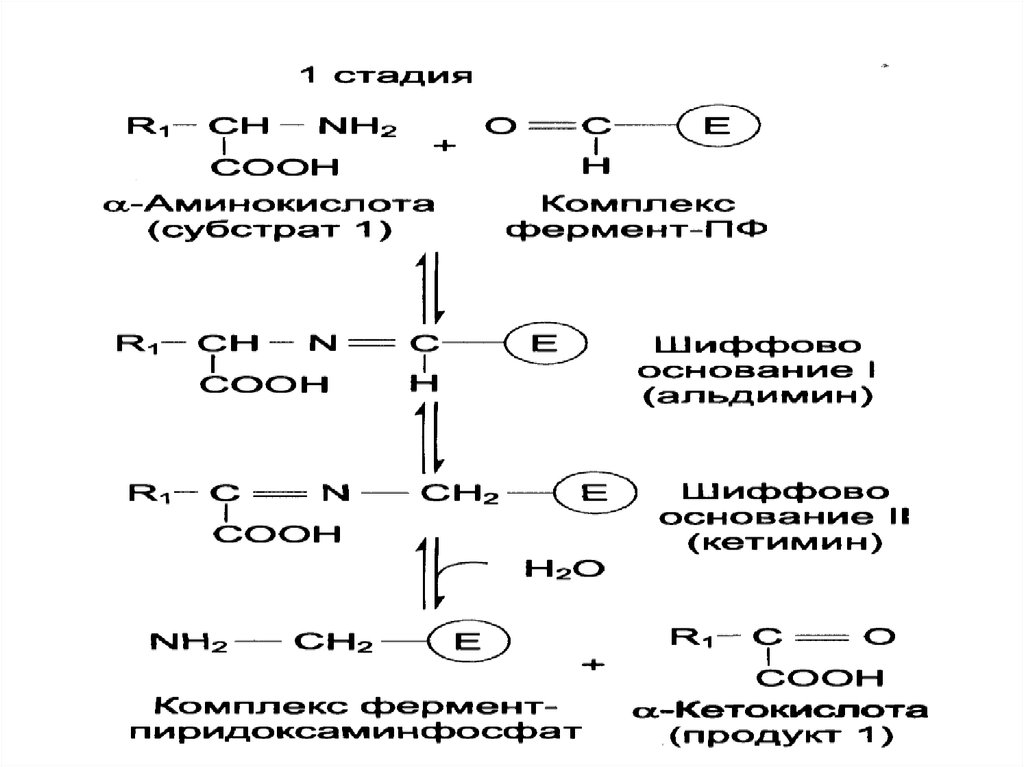
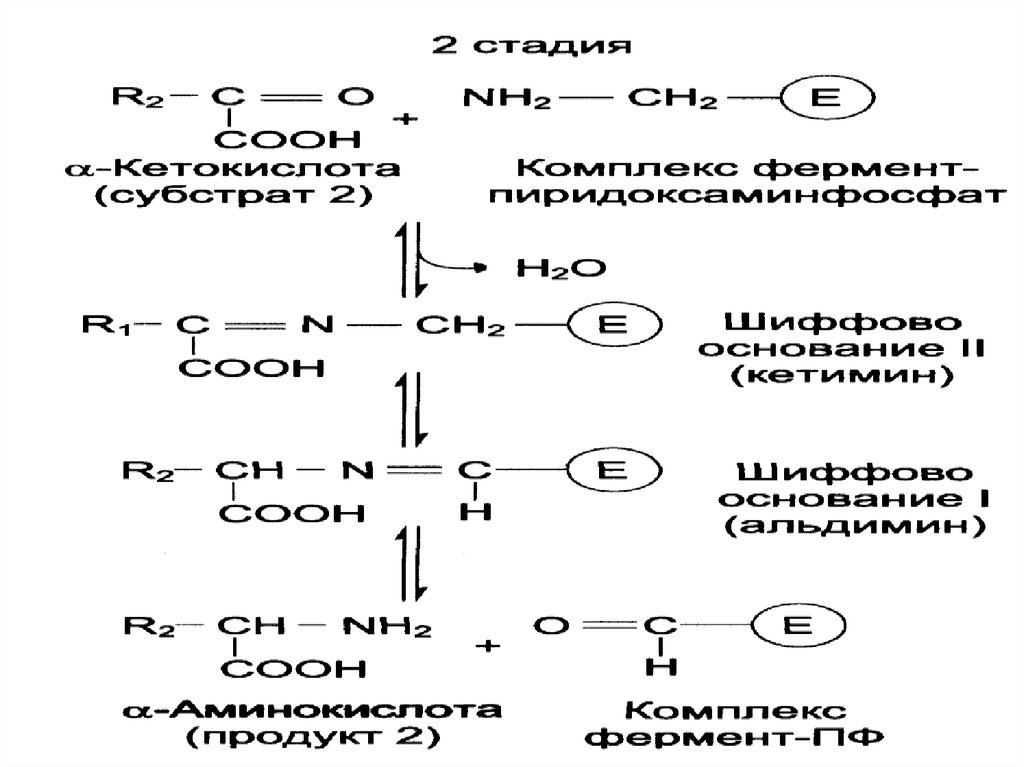
21. Аминотрансферазы
• Трансаминирование катализируютаминотрансферазы. Переносимая
NH2-группа временно присоединяется к
связанному с ферментом
пиридоксальфосфату, который
переходит в пиридоксаминофосфат.
22.
23.
24.
25.
26.
КОНЕЧНЫЕ ПРОДУКТЫАЗОТИСТОГО ОБМЕНА
27. АММИАК
• При дезаминировании АК, прираспаде пуринов и пиримидинов
освобождается аммиак.
28.
29. ТОКСИЧНОСТЬ АММИАКА
• Аммиак - NH3 - клеточный яд, привысоких конц. повреждает нервные
клетки (гепатаргическая кома).
• В норме распад 70 г АК в сутки – конц.
NH3 в крови 60 мкмоль/л.
30. Токсичность аммиака
• В опытах на кроликах концентрацияNH3 3 ммоль/л вызывала смерть!
• Причины токсичности:
1. при рН крови в виде NH4+,
проникает через плазм. и МХ
мембраны с большим трудом.
31.
• Нейтр. мол. своб. NH3 легкопроходят эти мембраны.
• При рН 7,4 только 1% NH3 от
общего количества аммиака
проникает в клетки мозга и МХ.
32. Причины токсичности
NH3 + альфа-КГ + НАДФН2 -Глу + НАДФ+ Н2О
Отток альфа- КГ из ЦТК
(снижение скорости
окисления глюкозы)
33. Механизмы детоксикации аммиака
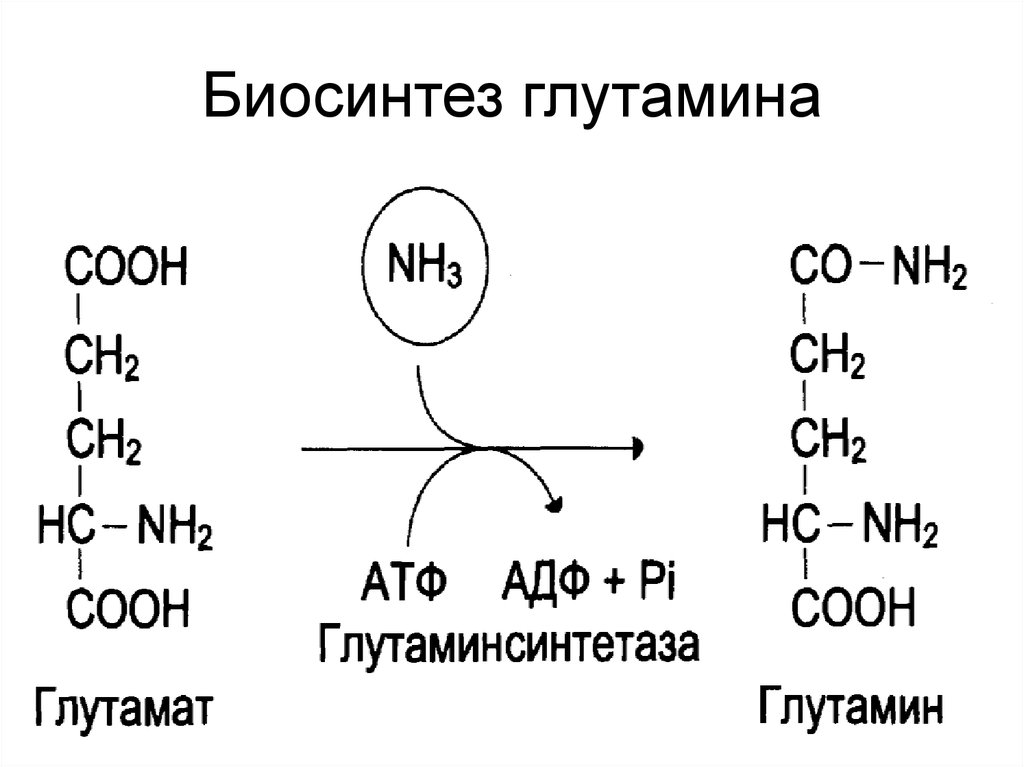
• 1. Синтез глутамина: Глн,аспарагина: Асн.
• 2. Синтез мочевины.
• 3. Аминирование а-КГ --> Глу.
• 4. Амидирование белков.
34. Механизмы детоксикации аммиака
• 5.Синтез пурин. и пиримид.структур.
• 6. Нейтрализация в почках
кислотами и выделение с мочой
аммонийных солей.
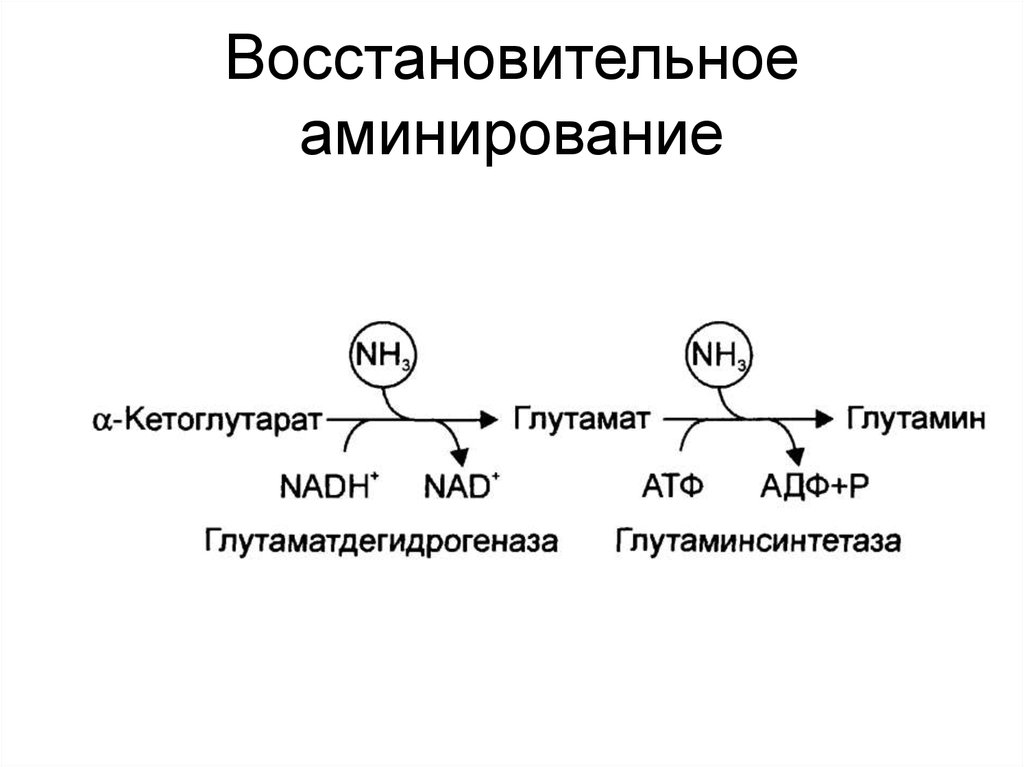
35. Восстановительное аминирование
Реутилизация аммиака за
счет глутаматдегидрогеназной реакции
36. Восстановительное аминирование
37. Биосинтез глутамина
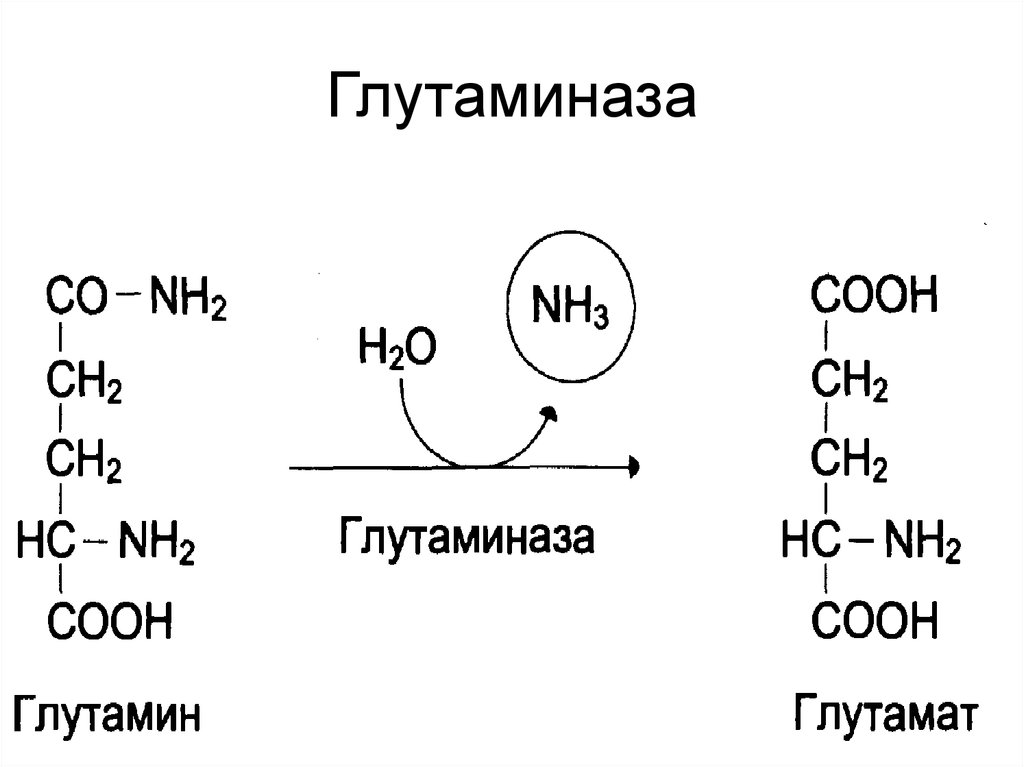
38. Глутаминаза
39.
40. МОЧЕВИНА
• У человека инактивация NH3осуществляется за счет
синтеза мочевины, часть NH3
выводится почками.
41. СТАДИИ СИНТЕЗА МОЧЕВИНЫ
• Мочевина образуется в результатециклической последовательности
реакций, протекающих в печени.
42. Первая стадия
• Из гидрокарбоната (НСО3-) иаммиака с потреблением 2
молекул АТФ образуется
карбамоилфосфат.
43. Синтез карбамоилфосфата
44. Вторая стадия
• Карбамоильный остаток переноситсяна орнитин с образованием
цитруллина.
45. Синтез цитруллина
46. Третья стадия
• Вторая аминогруппа длямочевины поставляется за счет
реакции аспартата с
цитруллином.
47. Синтез аргининосукцината
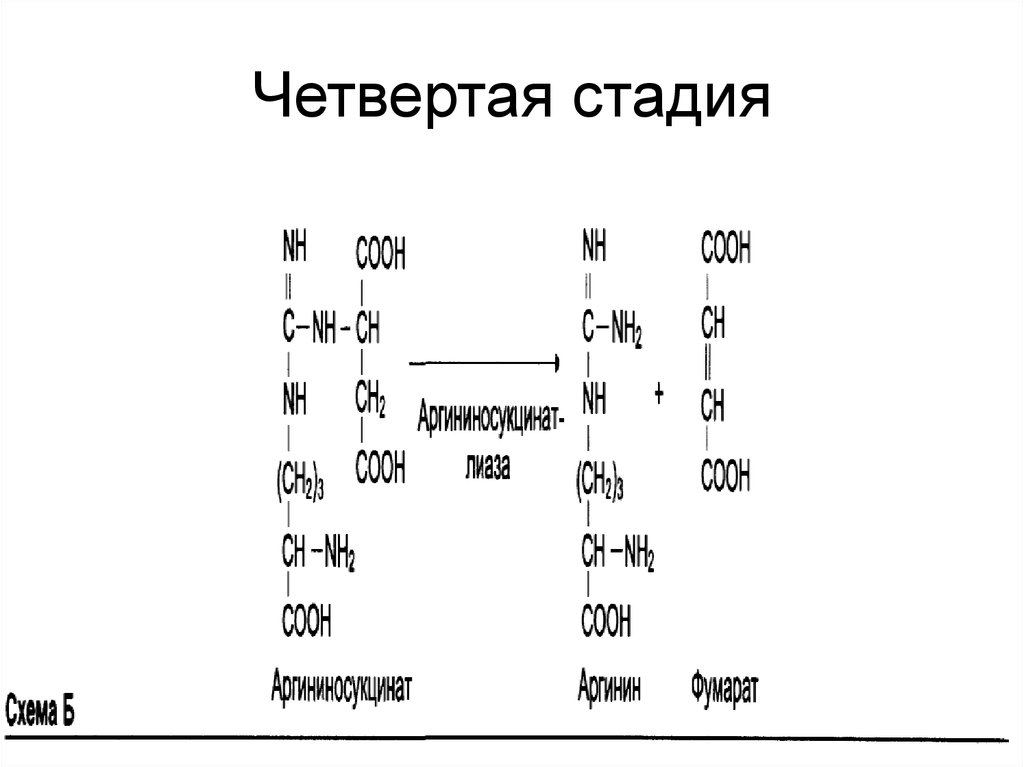
48. Четвертая стадия
Отщепление фумарата отаргининосукцината приводит к
аргинину.
49. Четвертая стадия
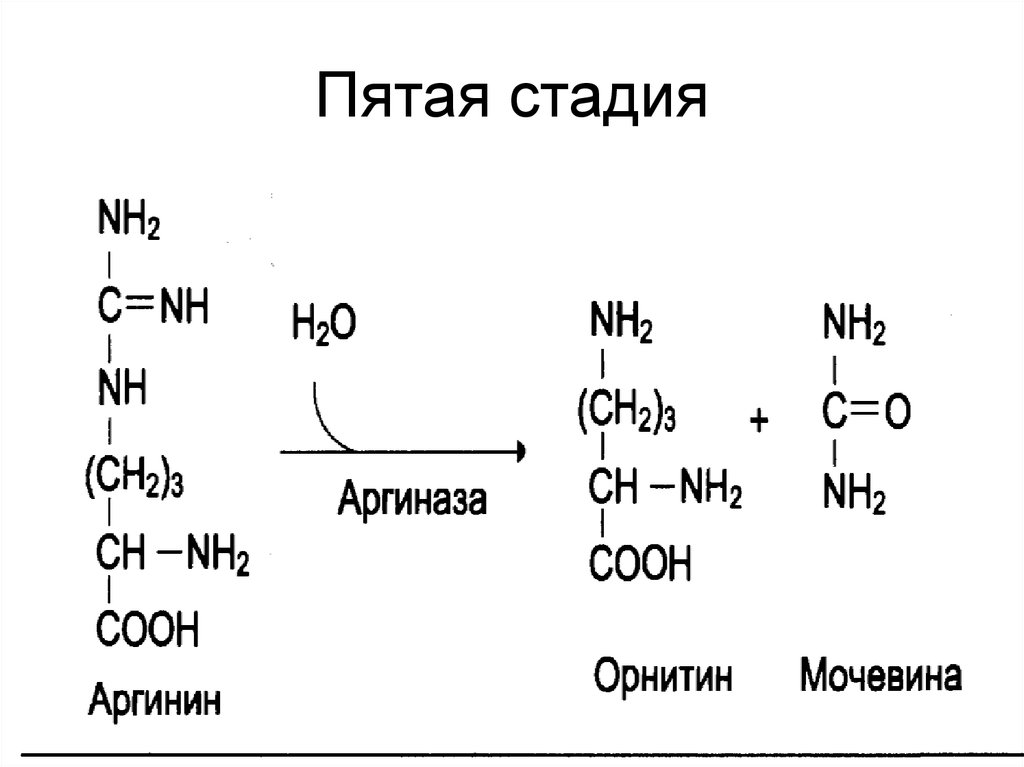
50. Пятая стадия
В результате гидролиза аргининаобразуется мочевина.
Остающийся орнитин вновь
включается в цикл мочевины.
51. Пятая стадия
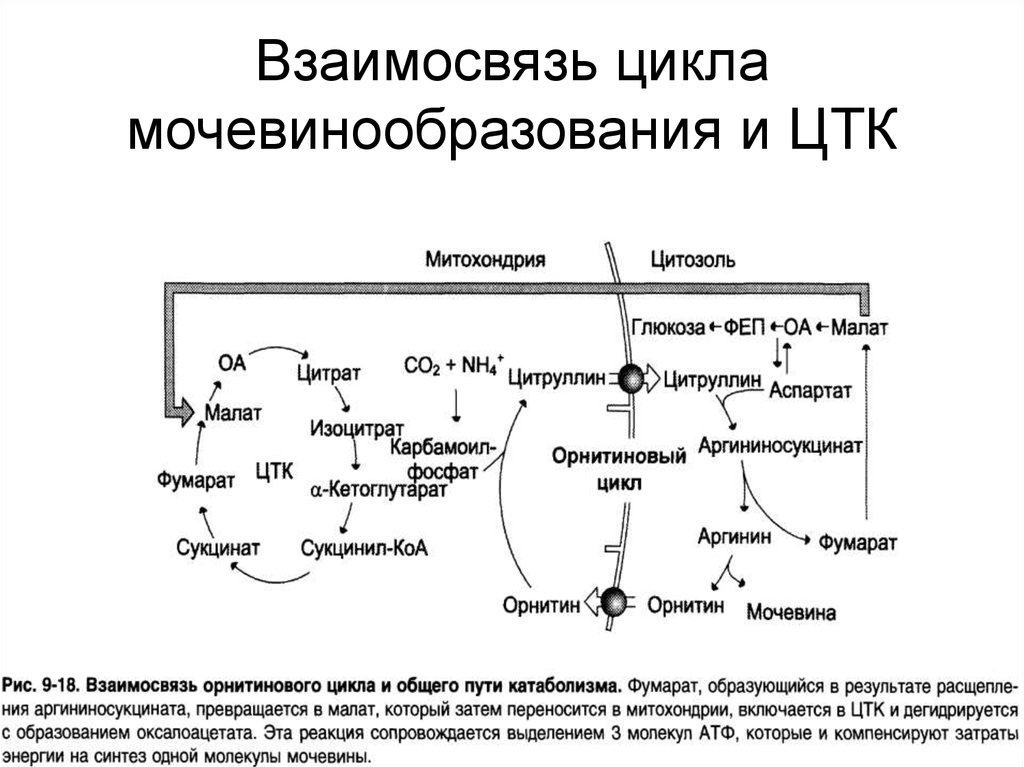
52. Взаимосвязь цикла мочевинообразования и ЦТК
53. ЭНЕРГОЗАВИСИМЫЙ ПРОЦЕСС
• Биосинтез мочевины требует затратэнергии за счет расщепления
четырех высокоэнергетических
связей: двух при синтезе
карбамоилфосфата и двух (!) при
образовании аргининосукцината
(АТФ → АМФ + PPi, РРi → 2Pi).








































 Биология
Биология








