Похожие презентации:
Средства выразительности речи. Семинар
1. Семинар
По теме: Типы химической связи.Степень окисления.
2. Химическая Связь
Понятие о химической связиВиды химических связей
3. Химическая Связь:
Это силы взаимодействия, которыесоединяют отдельные атомы в молекулы,
ионы, кристаллы.
4. Типы химической связи
КовалентнаяИонная
Типы химической связи
Водородная
Металлическая
5. Ковалентная связь
ОпределениеМеханизм образования
Виды ковалентной связи
6. Ковалентная связь:
Это химическая связь,возникающая в результате
образования общих
электронных пар между
взаимодействующими атомами.
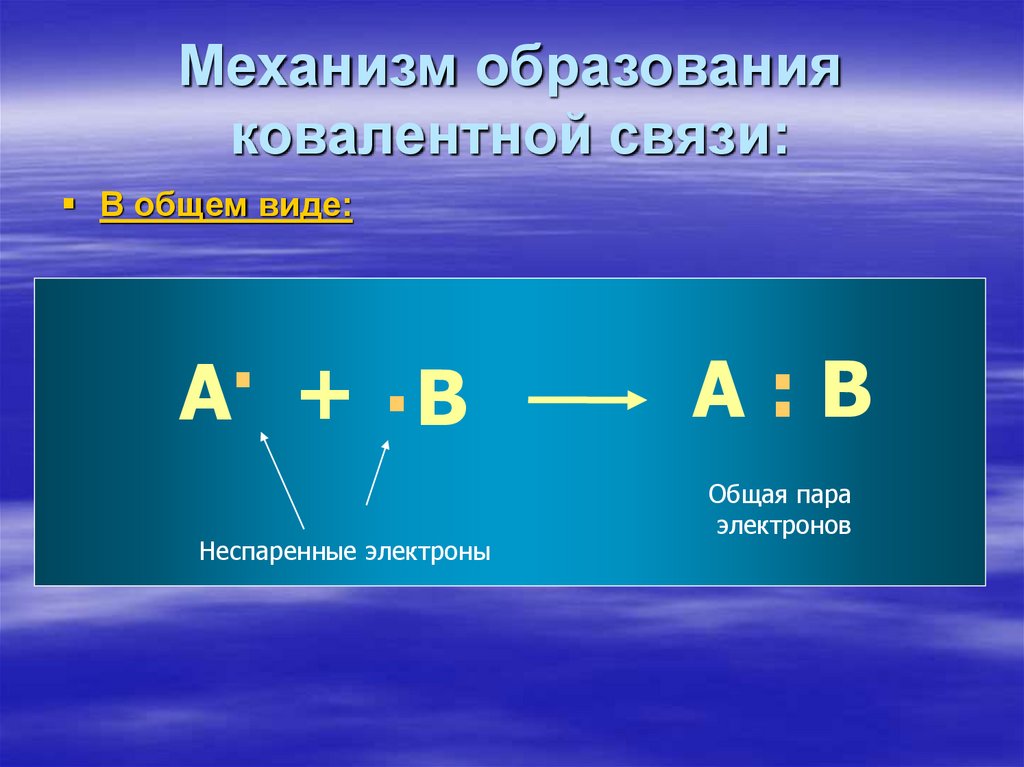
7. Механизм образования ковалентной связи:
В общем виде:.
А + .В
Неспаренные электроны
А:В
Общая пара
электронов
8. Основные выводы:
Ковалентная связь образуется двумянеспаренными электронами, которые
принадлежат двум атомам.
Механизм образования ковалентной связи
заключается в перекрывании электронных
облаков.
Связь тем прочнее, чем в большей степени
перекрываются облака.
При перекрывании электронных облаков в
пространстве между ядрами увеличивается
электронная плотность.
9. Виды ковалентной связи
НеполярнаяОбразуется между
атомами с одинаковой
электроотрицательность
ю
Например: H2 Cl2 O2 N2
Общая электронная пара,
образующая связь в
равной степени
принадлежит обоим
атомам
Полярная
Образуется между
атомами, которые
незначительно
отличаются по
электроотрицательности
Например: H2О НCl NН3
Общая электронная пара,
образующая связь,
смещается к атому более
электроотрицательного
элемента
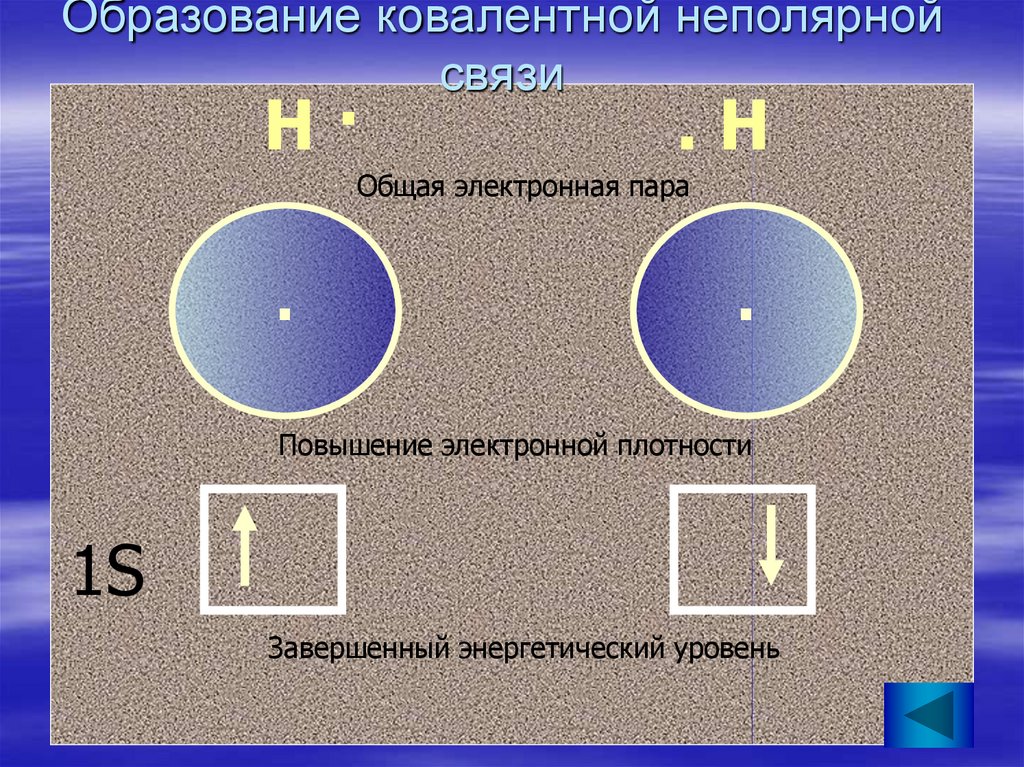
10. Образование ковалентной неполярной связи
Н·.Н
Общая электронная пара
.
.
Повышение электронной плотности
1S
Завершенный энергетический уровень
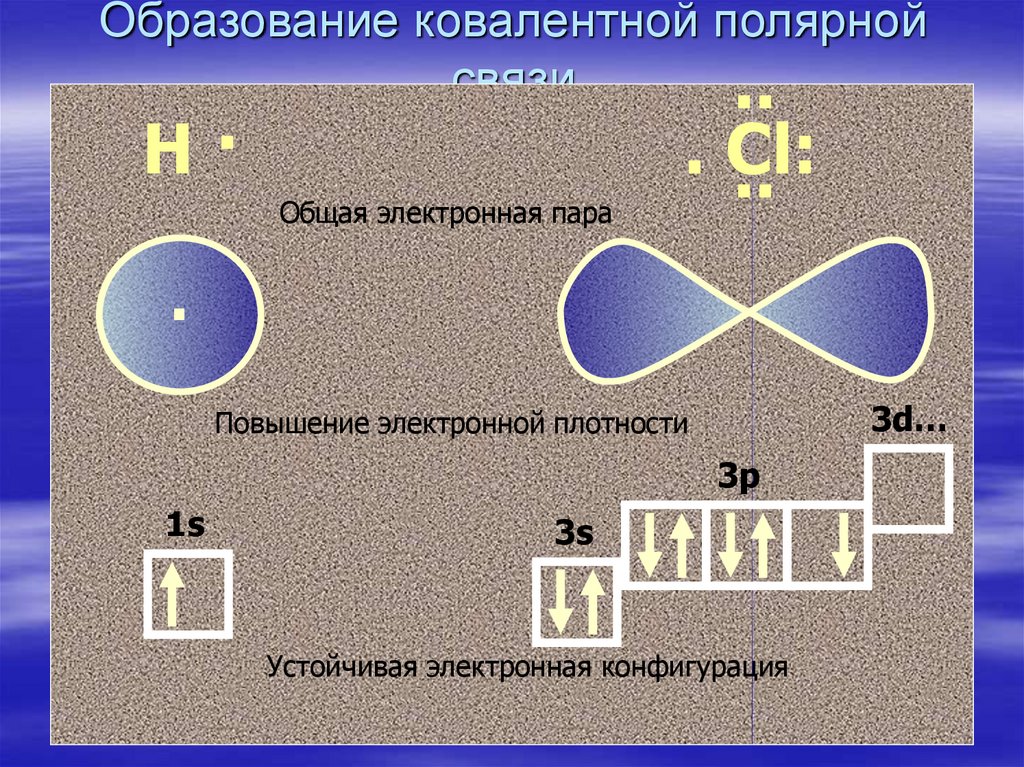
11. Образование ковалентной полярной связи
..Н·
Общая электронная пара
. Сl:
..
.
3d…
Повышение электронной плотности
3p
1s
3s
Устойчивая электронная конфигурация
12. Типы химической связи
H2OКовалентная
неполярная
Ковалентная
полярная
Ионная
KF
H2
NaI
LiBr
О3
NaCl
Al2О3
CO2
NH3
N2
Cl2
13. Ионная связь
Образуется между атомами типичныхметаллов и типичных неметаллов, т.е.
между элементами, атомы которых резко
отличаются по электроотрицательности
Например: NaCl BaO K3N
Связь образуется за счет
электростатического притяжения
разноименно заряженных ионов
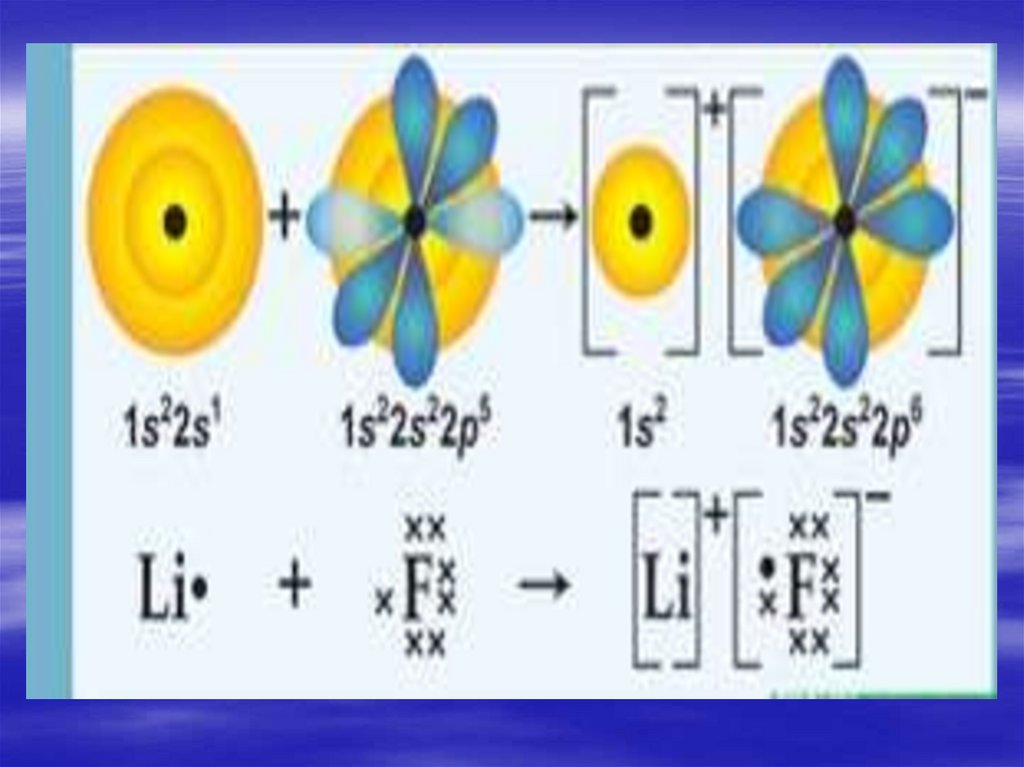
14. Механизм образования
LiF
15.
16. Степень окисления
ПонятиеЗначение степени окисления
Определение степени окисления атома
в соединении
17. Степень окисления:
Это формальный заряд атома всоединении, который приписывают ему
условно, исходя из предположения, что
молекула состоит только из ионов.
18. Значение степени окисления
ПоложительноеОтрицательное
Нулевое
19. Для определения степени окисления атома в соединении следует учитывать, что:
Степени окисления атомов в молекулах простых веществ, атакже металлов и неметаллов в элементарном состоянии равны
нулю, т.е. смещения общих электронных пар не происходит.
Степень окисления фтора во всех его соединениях равна -1.
Степень окисления кислорода в большинстве его соединений
равна -2 за исключением OF2, где степень окисления кислорода
равна +2, так как фтор – самый электроотрицательный элемент.
Водород в большинстве соединений имеет степень окисления
+1, кроме соединений с активными металлами, где его степень
окисления равна -1.
Степень окисления металлов главных подгрупп, I и II групп во
всех соединениях соответственно равна +1 и +2, а алюминия
+3.
Молекула любого вещества электронейтральна, поэтому
алгебраическая сумма положительных степеней окисления
должна быть равна сумме отрицательных.
20. Определите степени окисления элементов в веществах:
+6 -2SO3
+2 -2
FeS
+3 -1
+1 +5 -2
0
-3 +1
ClF3
O2
KNO3
PH3
+4 -2
SO2
+1 +6 -2
H2SO4
+1 -2
H 2S
21. Составьте формулы соединений:
Алюминия и СерыКальция и Хлора
Азота и Кислорода
+3
-2
Al2S3
+2
-1
CaCl2
+5
-2
N2O5
22. Степень окисления элемента Х в водородном соединении -2, а в высшем оксиде +6, расположен этот элемент в третьем периоде.
?Определите что это за элемент
Составить формулы соответствующих
соединений
S
H2S
SO3
23. Домашнее задание
Я.П.Гольдфарб, Ю.В.Ходаков, Ю.Б.ДодоновЗадачник «Химия 8-11» :
Упр. 8-53, 8-54, 8-59, 8-69
И.И. Новошинский, Л.Ф.Федосова,
Н.С.Новошинская Самостоятельные работы по
химии
Работа II вар.1(1,2); вар.2(1,2);
вар.3(1,2);вар.4(1,2)
Не менее двух по выбору из каждого сборника.



















 Химия
Химия








