Похожие презентации:
Валентность. Степень окисления. Составление электронных конфигураций. Типы химической связи
1. Валентность. Степень окисления. Составление электронных конфигураций Типы химической связи.
2.
Валентность – способность атомаобразовывать химические связи с
другими атомами
Валентность определяется по
формуле кислородного или
водородного соединения,
обозначается римскими цифрами, не
имеет знака.
3.
ВалентностьПо кислороду
Постоянная
Переменная
1. Все s-металлы (I и IIА
группы) – равна
номеру группы
2.Аl – III
3. H – I
4. F – I
5. O - II
1. Высшая - равна
номеру группы
2. Возможная равна № группы – 2
до 0
По водороду
IA
IIA
IIIA
IVA
VA
RH RH2 RH3
RH4
RH3
№ группы
VIA
VIIA
H2R
8 - № группы
HR
4. Правило валентности
В большинстве бинарных соединений типа AxByпроизведение валентности элемента А (m) на число его
атомов в молекуле (х) равно произведению валентности
элемента В (n) на число его атомов (y):
mx=ny
Пример:
Определить валентность фосфора в соединении Р2О5
m II
Р2О5
Валентность кислорода постоянна и равна II
m*2=2*5
m=5
Фосфор в соединении P2O5 пятивалентен
5.
Степень окисления – условныйзаряд, который приобретает атом в
молекуле при условии смещения
электронов к наиболее
электроотрицательному атому
Степень окисления обозначается
арабскими цифрами, имеет знак
6.
Степень окисленияПостоянная
Переменная
1. СО s-металлов (I и IIА группа) равна № 1. Максимальная СО равна номеру
группы (положительный знак)
группы
2. Al имеет степень окисления +3
2. Низшая СО равна номер группы -8
3. Водород имеет две степени
3. Возможные СО равны номер группы окисления: +1 и 0, за исключением
2, в том числе и 0
гидридов металлов, там равна -1
4. Фтор имеет две степени окисления: +1
и 0
5. Кислород имеет степень окисления -2,
за исключением двух соединений:
Н2+1О2-1 и O+2F2Запомнить:
1. СО кислотного остатка в кислоте равна числу атомов водорода
2. СО элемента в кислоте и ее соли одинакова
3. СО азота в аммиаке NH3 и в ионе аммония NH4 одинакова и равна +3
7. Правило определения степени окисления
Сумма зарядов всех атомов в молекуле равна нулю.Примеры:
H Cl O4
+8
H2 S O 4
+8
-8
1+x+(-2)*4=0
x=+7
Ca (Cl O3)2
+12 -12
+14
1*2+x*2+(-2)*7=0
x=+12/2=+6
1*2+x+(-2)*4=0
x=+6
H Cl O3
+6
2+x*2+(-2)*6=0
x=+10/2=+5
(NH4)2 Cr2 O7
-14
-8
-6
1+x+(-2)*3=0
x=+5
H2 P2 O7
+14
-14
1*2+x*2+(-2)*7=0
x=+12/2=+6
8. Квантовые числа
1. n – главное квантовое число. Характеризует энергиюэлектрона на энергетическом уровне.
Определяет:
• Число энергетических уровней (n= № периода)
• Максимальное число электронов на энергетическом уровне
по формуле 2n2
• Число энергетических подуровней на энергетическом уровне
9. Квантовые числа
2.l – побочное квантовое число.
Характеризует энергию электрона на
энергетическом подуровне и форму
электронного облака.
Численно равно n-1
10. Квантовые числа
3. ml – магнитное квантовое число. Определяеториентацию электронного облака и число
электронных орбиталей на подуровне
Численно равно –l; 0; l
11. Квантовые числа
4. ms - спиновое квантовое число.Определяет
направление
вращения
электрона вокруг собственной оси.
12. Правила для определения расположения электрона в атоме
1. Принцип Паули(принцип запрета)В атоме не может быть двух электронов с
одинаковым
набором
всех
четырех
квантовых чисел. Поэтому на одной орбитали
не может быть больше двух электронов.
Максимальное число электронов на подуровне:
s p d f
2 6 10 14
13. Правила для определения расположения электрона в атоме
2. Правило ГундаЭлектроны располагаются таким образом,
чтобы суммарный спин был максимальным
14. Правила для определения расположения электрона в атоме
3. Правило КлечковскогоЭлектроны
заполняю
подуровни в порядке
энергии
4s
3d
энергетические
увеличения их
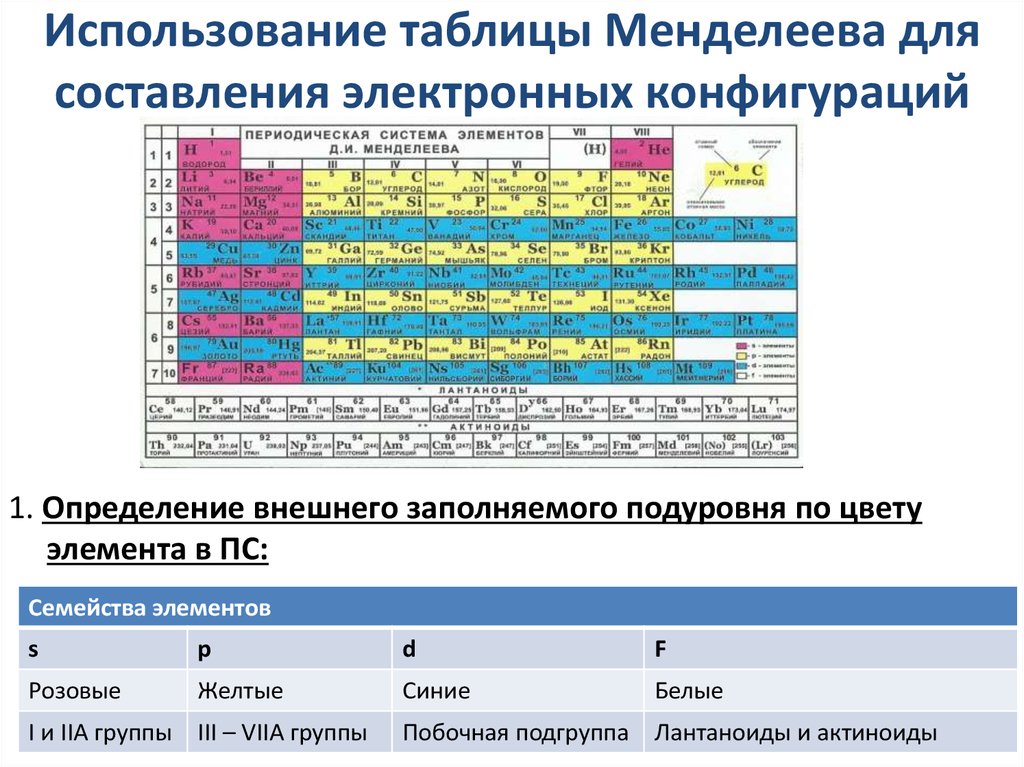
15. Использование таблицы Менделеева для составления электронных конфигураций
1. Определение внешнего заполняемого подуровня по цветуэлемента в ПС:
Семейства элементов
s
р
d
F
Розовые
Желтые
Синие
Белые
I и IIА группы
III – VIIА группы
Побочная подгруппа Лантаноиды и актиноиды
16. Использование таблицы Менделеева для составления электронных конфигураций
2. Определение номера внешнего заполняемогоподуровня
Для s-элементов и p-элементов равен номеру
периода
Для d –элементов равен номер периода - 1
Для f-элементов равен номер периода - 2
17. Использование таблицы Менделеева для составления электронных конфигураций
3.Определение числа
внешнем уровне.
Оно равно номеру группы.
электронов
на
18. Составление электронных конфигураций
Запомнить:У некоторых элементов происходит «провал» электрона с более
высокого энергетического уровня на более низкий для
уменьшения энергии. Характерно для d-элементов.
19. Химическая связь
Химическая связь – силы взаимодействия, которыесоединяют атомы в молекулы, ионы или кристаллы.
В образовании хим. связей участвуют валентные
электроны:
1. Неспаренные валентные электроны (s, p –внешнего
уровня, d – внешнего и предвнешнего уровня)
2. Неподеленная пара валентных электронов,
находящаяся на внешнем уровне
3. Вакантные орбитали
Типы химической связи:
1. Ионная
2. Ковалентная
3. Водородная
4. Металлическая
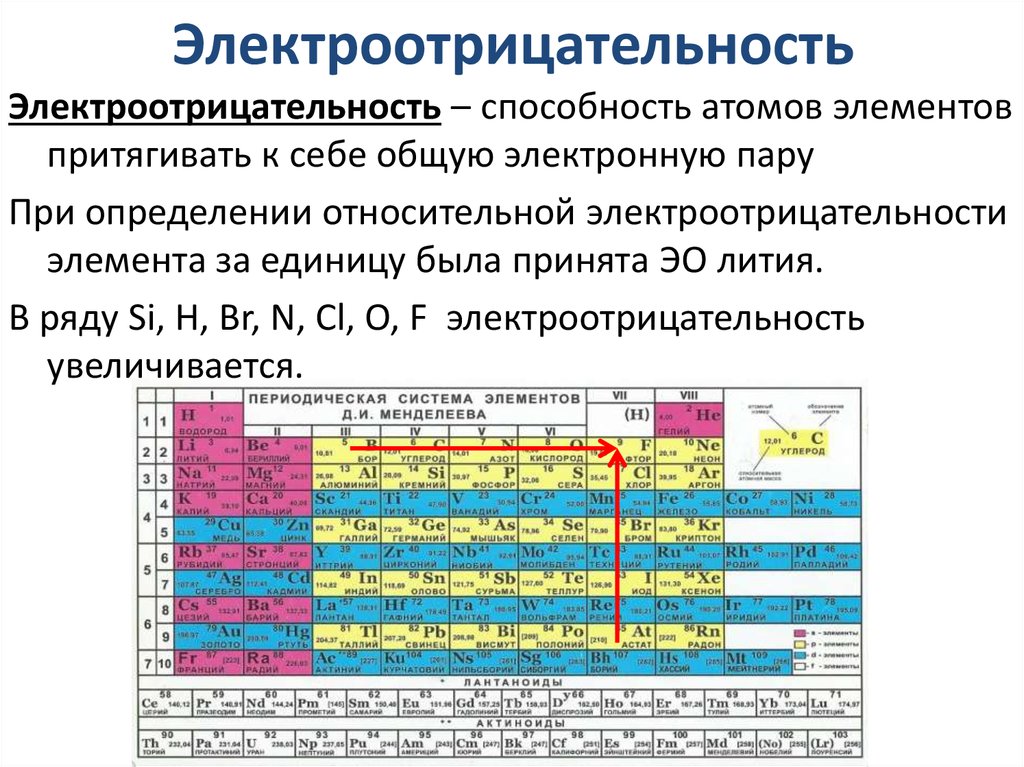
20. Электроотрицательность
Электроотрицательность – способность атомов элементовпритягивать к себе общую электронную пару
При определении относительной электроотрицательности
элемента за единицу была принята ЭО лития.
В ряду Si, H, Br, N, Cl, O, F электроотрицательность
увеличивается.
21. Ионная связь
Ионная связь – это связь между противоположно заряженными ионами.Механизм образования: электростатическое притяжение анионов и
катионов.
ΔЭО > 1,7 (2)
Случаи возникновения и.х.св.:
1. Между типичным металлом (I и II A-группы) и типичным неметаллом
(O,H,Cl,F,S,N)
2. В веществах сложного состава:
Катионы
Анионы
NH4+
OH-, анионы
кислородсодержащих
кислот
Механизм образования:
Ионы
приобретают
устойчивую
соответствующего инертного газа.
электронную
конфигурацию
22. Примеры образования ионной связи
23. Характеристика веществ с ионной связью
• Ионная кристаллическая решетка• Твердые, прочные, нелетучие
• В твердом состоянии не проводят
электрический ток
• Хорошо растворимы в полярных
растворителях, поэтому их растворы и
расплавы хорошо проводят электрический
ток
24. Ковалентная связь
Ковалентная связь – химическая связь,возникающая в результате образования общих
электронных пар при перекрывании
электронных облаков с антипараллельными
спинами.
ΔЭО >= 0
ΔЭО < 1,7 (2)
Ковалентная связь
Неполярная
Полярная
ΔЭО = 0
ΔЭО не равна0
НеМе+такой же НеМе
НеМе+другой НеМе
Cl2, O2,N3, H2
CO2, NH3, PH3, PCl3
25. Механизм образования
ОбменныйДонорно-акцепторный
В случае ковалентной неполярной
и полярной связи
В случае ковалентной полярной
связи
26. Характеристика веществ с ковалентной связью
1. Образуют молекулярную кристаллическуюрешетку
2. Обладают малой твердостью, низкой
температурой кипения и плавления,
проводят электрический ток,
нерастворимы или малорастворимы в
полярных растворителях
27. Водородная связь
Водородная связь – это химическая связь междуатомом водорода в одной молекуле и сильно
электроотрицательным атомом (F, O, S) в другой
или в той же самой молекуле.
Два вида: межмолекулярная (между молекулами
воды, спирта, HF, карбоновых кислот) и
внутримолекулярная.
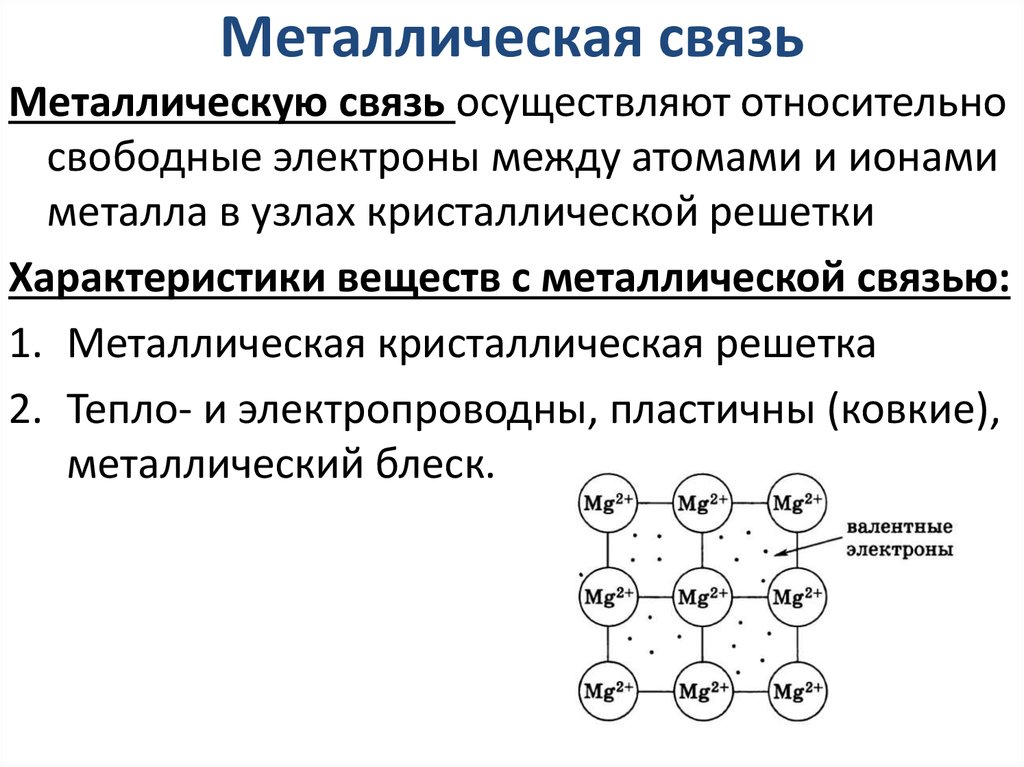
28. Металлическая связь
Металлическую связь осуществляют относительносвободные электроны между атомами и ионами
металла в узлах кристаллической решетки
Характеристики веществ с металлической связью:
1. Металлическая кристаллическая решетка
2. Тепло- и электропроводны, пластичны (ковкие),
металлический блеск.

























 Химия
Химия








