Похожие презентации:
Государственное регулирование
1.
ФГАОУ ВО Первый Московскийгосударственный медицинский университет
им.И.М.Сеченова МЗ России (Сеченовский
университет)
Институт трансляционной медицины и
биотехнологии НТПБ
Государственное
Доцент
кафедры
регулирование
Регуляторных отношений в области
обращения
обращения
лекарственных
средств и медицинских
изделий
2.
(англ.state
regulation)
целенаправленное
воздействие
государства
на
организацию сферы обращения
лекарственных средств путем
издания
законов
и
др.
нормативных правовых актов,
определяющих
предлагаемые
государством
правила
деятельности
в
соответствующей сфере.
вмешательство
государственных
органов
в
функционирование
фармацевтического
рынка
с
целью
перспективного
3.
п.49 Одним из главныхнаправлений
обеспечения
национальной
безопасности
в
среднесрочной
перспективе
определяется
продовольственная
безопасность
и
гарантированное снабжение населения
высококачественными
и
доступными
4.
Лекарственныепрепараты
это
товары
вынужденного
потребления;
информированност
ь
о
свойствах
лекарственного
препарата
снижается
на
протяжении
всей
цепочки
от
разработчика
до
потребителя;
у потребителя нет
возможности
5.
Государство не имеет права нелекарственного обеспечения, так как это
контролировать
вопрос жизни многих людей
вввв
В них сердца стук,
дыханье …. ЖИЗНЬ……..
вопрос
6.
ПравительствуРоссийской
Федерации
обеспечить
достижение
следующих
национальных
целей
развития
Российской
Федерации
на
период до 2024 года:
а)
обеспечение
устойчивого
естественного
роста
численности
населения Российской Федерации;
б)
повышение
ожидаемой
продолжительности жизни до 78 лет (к 2030
году — до 80 лет);
Указ Президента РФ №204 от 7 мая 2018 года
7.
Государство должно создатьусловия
при которых лекарственные препараты:
- для населения
будут
доступны
безопасны
эффективны
- для производителя и
реализации
выгодны
8.
Особенности предложений патентная защита, вывод на рынокЛПЭффективность
с регистрационным
лекарственного
удостоверением,
при этом ЛП
препарата должны
быть не только безопасны,
характеристика
Безопасность
степени
но и эффективны.
лекарственного
положительного
Особенности
спросасредства
- система,
влияния
характеристика
лекарственного
состоящая из врача,лекарственного
аптечной
препарата на
средства,
организации,
потребителя
и
течение,
основанная на
субъекта
оплаты.
продолжительнос
сравнительном
ть заболевания
анализе его
или его
эффективности и
предотвращение,
риска причинения
реабилитацию, на
вреда здоровью
сохранение,
9.
Государственноерегулирование
Наукоемкость
Система
государственн
ого
регулирования,
должна
базироваться
на научно
обоснованной
законодательн
ой и
нормативноправовой базе,
позволяющей
10.
ГосударственноеСтратегия лекарственного
регулирование
обеспечения
населения
Российской Федерации на
период до 2025
В
Российской
Федерации
в
соответствии
в
соответствии
с
Указом
Президента
РФ от 7 мая 2012 года № 598
«О
совершенствовании
государствен-ной
политики
в
сфере
здравоохранения»
Минздравом
России
разработана
и
утверждена Приказом
от
13.02.2013
№
66
«Стратегия
11.
ГосударственноеПриоритетные
социальнорегулирование
экономические задачи:
обеспечение
рационального
использования
лекарственных
препаратов для медицинского применения;
совершенствование
порядков
формирования
перечней
лекарственных
препаратов
для
медицинского
применения,
обеспечение которыми осуществляется в рамках программы
государственных
гарантий
бесплатного
оказания
гражданам
медицинской помощи, а также в рамках оказания государственной
социальной помощи в виде набора социальных услуг;
обеспечение
безопасности,
эффективности
и
качества
лекарственных препаратов для медицинского применения;
совершенствование государственного регулирования цен на
лекарственные
препараты
для
медицинского
применения,
обеспечение которыми осуществляется в рамках программы
государственных
гарантий
бесплатного
оказания
гражданам
медицинской помощи, а также в рамках оказания государственной
социальной помощи в виде набора социальных услуг;
повышение квалификации медицинских и фармацевтических
работников.
12.
Государственноерегулирование
Цель стратегии
повышение
доступности
качественных,
эффективных
и
безопасных
лекарственных
препаратов для медицинского
применения
для
удовлетворения потребностей
населения
и
системы
здравоохранения
на
основе
формирования рациональной и
сбалансирован-ной
с
имеющимися ресурсами системы
лекарственного
обеспечения
населения РФ.
13.
ФЕДЕРАЛЬНЫЙ ЗАКОН N 61-ФЗ«ОБ ОБРАЩЕНИИ
ЛЕКАРСТВЕННЫХ СРЕДСТВ»
от12 апреля 2010 года
Статья 4. Основные понятия, используемые в настоящем ФЗ
Обращение
лекарственных средств -
разработка,
доклинические
исследования,
клинические
исследования,
экспертиза,
государственная регистрация, стандартизация и
контроль качества, производство, изготовление,
хранение,
перевозка,
ввоз
в
Российскую
Федерацию, вывоз из Российской Федерации,
реклама,
отпуск,
реализация,
передача,
применение,
уничтожение
лекарственных
средств.
Разработка -------------- - - ---------------------- ------- Уничтожение
14.
Норма (от лат. norma – мера, правило,образец) права – это охраняемое
силой
государства
общеобразовательное правило,
которое
регулирует
общественные
отношения,
поведение людей, устанавливая
определенные
права
(возможности) и обязанности.
Когда государство принимает
ту или иную норму права, оно
закрепляет ее в официальном
письменном
документе,
называемом
нормативным
15.
Нормативно-правовой акт (НПА) –это основной источник права в современном государстве.
О
С
О
Б
Н
Н
О
С
Т
И
- Регулирование общественных
отношений;
- Правотворческий процесс создания с
строго регламентированной процедурой.
- Официальный документ, имеющий
специальные реквизиты:
-
наименование акта;
- наименование государственного
органа, принявшего данный документ;
- дата принятия акта, номер, место, где
он был принят.
- Определенная внутренняя структура:
разделы, главы, статьи.
16.
Законодательнаядеятельность
–
целенаправленный
процесс,
требующий
объективного,
подлинно
научного
подхода,
определения
перспектив развития конкретных сфер
общественной
жизни
и
предвидения
Стадии издания
законов:
последствий
реализации
законодательных установлений. Приняти
1. Законодательная инициатива (законопроект);
2. Обсуждение законопроекта
(заслушивание представителя ЗИ корректирование законопроекта ГД);
3. Принятие закона – главная стадия (3 этапа);
4. Опубликование (обнародование) закона.
е
закона
ГД
(ч.1,2,3 ст.105 К
Одобре
РФ)
ние
закона
СФ
(ч.4 ст.105,106 К
Подпис
РФ
ание
Закона
президентом
17.
Законодательная инициатива — стадиязаконодательного процесса, состоящая
в вынесении на рассмотрение органом
законодательной власти законопроекта
или законодательного предложения по
Субъекты права законодательной
принятию, изменению или отмене закона.
инициативы:
-
Президент России;
-
Совет Федерации;
-
Члены Совета Федерации;
-
Депутаты Государственной Думы;
-
Правительство;
- Законодательные (представительные)
органы государственной власти
субъектов Федерации;
18.
1.Принятие
Государственной Думе
(ФЗ принимается
депутатов , 3 чтения)
большинством голосов
в
от общего числа
5 дней
Закон
2.
Обсуждение
одобрен
Советом
1. Если заФедерации
него
проголосовало более
½ общего числа членов
СФ
и Закон
одобрение
отклонен
В этом случае он
подлежит повторному
14 дней рассмотрению ГД
2. Если в течение 14 дней
он не будет
рассмотрен СФ
5 дней
В
случае
несогласия
ГД
с
решением СФ закон
считается
принятым, если при
повторном
согласовании
за
него
проголосовало
не
менее 2/3 от общего
числа депутатов
Президенту Российской Федерации
19.
3.Президент
Российской
5 дней
Федерации
Подписывает
закон
и обнародует его
14 дней
Отклоняет закон
В
этом
случае
ГД
и
СФ
в
установленном порядке вновь
рассматривают
данный
закон.
Если
при
повторном
рассмотрении закон одобрен в
ранее
принятой
редакции
большинством не менее 2/3 от
7 дней
общего числа депутатов ГД и
членов
СФ,
он
подлежит
подписанию Президентом РФ в
течение 7 дней и обнародованию
Обнародование закона
10 дней
Закон вступает в
силу
20.
21.
по юридической силеПринимается законодательным органом
или референдумом
Законы:
- Конституция России;
- Федеральные
Конституционные законы;
- Федеральные законы;
- Конституция (устав) субъекта
Федерации;
- Законы субъекта РФ
Конституция – главный закон государства
Принимается полномочными органами
власти на основе законов для их
лучшего исполнения
Подзаконные акты:
- Указы Президента;
- Постановление Правительства РФ;
- Международные договора и
положения
-Ведомственные (приказы,
инструкции, положения);
- Акты исполнительных органов
субъекта Федерации;
- Местные;
- Внутриорганизационные.
Если нет соответствующего Закона.
Указ действует до принятия Закона.
22.
ЗАКОН - нормативно - правовойакт,
издаваемый
в
строго
регламентированном порядке органом
законодательной
власти
или
референдумом,
обладающий
наивысшей
юридической
силой,
и
распространяющийся
на
наиболее
значимые
области
общественных
отношений
Не должен
противоречить
Конституции и
ФКЗ
Обладает высшей юридической силой
по сравнению со всеми другими актами
Любой закон ограничивает произвол власти!!!
23.
ПР
И
З
Н
К
И
Принимается
только органом законодательной власти или
ппрпрпр
референдумом
Порядок его подготовки и издания определяется Конституцией РФ и
Регламентами палат Федерального Собрания РФ
Закон должен выражать волю и интересы народа
Обладает высшей юридической силой, и все подзаконные акты
должны соответствовать ему и ни в чем не противоречить
З
А
К
О
Регулируют наиболее важные, ключевые общественные отношения
Н
а
Данные признаки и выделяют закон в системе иных НПА и
придают ему качество верховенства. Изменить или отменить
закон вправе только тот орган, который его и принял в строго
оговоренном порядке.
24.
Виды законовПо юридической
силе
По принципу
федерализма
По
содержанию
По срокам
действия
конституция
Федеральные
органические(коди
фицированные)
Постоянные
конституционные
законы
Субъектов
федерации
обыкновенные
законы, вносящие
изменения и дополнения
в конституцию
законы,
конкретизирующие
конституцию
Текущие
По предмету
правового
регулирования
Конституционные
Временные
Административные
чрезвычайные
По субъекту
законодательства
Исключительные (чрезвычайные)
Принятые законодательным
органом
Принятые на референдуме
Гражданские
Уголовные
И другие
25.
ФКЗ- регулируют вопросы общественной
жизни особой важности;
- принятие которых предусмотрено в
самом тексте конституции.
Особенности:
обладает
более высокой юридической
силой по сравнению с
обыкновенными
законами;
принимается
в
особом
порядке,
квалифицированным
большинством, т.е.
заранее
установленным
повышенным
кворумом при голосовании:
за ФКЗ должны проголосовать не менее 2/3
26.
Подзаконные акты -нормативно правовые акты, принятые компетентными
органами
или
должностными
лицами
государства
на
основании
и
во
исполнение закона
Конкретизир
уют
и
детализируют
предписания
законов
Принимаются:
на основе закона;
во исполнение закона;
не могут противоречить закону
27.
Проложите оптимальный маршрут от станции метро«Савеловская» до станции «Измайловский парк»
Савеловская
Рязанский проспект
Румянцево
Ростокино
Римская
Рижская
ППП
Раменки
А
Авиамоторная 2018 год
Аминьевское шоссе 2018 год
Б
Бабушкинская
Багратионовская
Балтийская
В
Владыкино
28.
29.
30.
31.
РазработкаДоклинические исследования
Стандартизация, контроль качества
Клинические исследования
Экспертиза
Государственная регистрация
Лекарст
венные
средств
а
Производство
Изготовление
Хранение
Реклама
Перевозка ,ввоз
,вывоз из
Российской Федерации
Отпуск, реализация, передача
Применение
Уничтожение
32.
Конституция Российской Федерации (ст.7, ст.41);Федеральный закон от 21 ноября 2011 г. N 323-ФЗ "Об основах
охраны здоровья граждан в Российской Федерации";
Федеральный закон от 12 апреля 2010 г. N 61-ФЗ "Об обращении
лекарственных средств»
Федеральный закон от 30.03.1999 N 52-ФЗ "О санитарноэпидемиологическом благополучии населения";
Федеральный закон от 04.05.2011 N 99-ФЗ "О лицензировании
отдельных видов деятельности";
Федеральный закон от 27 июля 2006 г. N 152-ФЗ "О
персональных данных«;
Федеральный закон от 13.03.2006 N 38-ФЗ «О рекламе»
33.
Каждый имеет право на охрану здоровья и медицинскую помощь.Медицинская помощь в государственных и муниципальных
учреждениях здравоохранения оказывается гражданам бесплатно за
счет средств соответствующего бюджета, страховых взносов, других
поступлений.
34.
Федеральный закон от 21 ноября 2011 г.N 323-ФЗ "Об основах охраны здоровья граждан
в Российской Федерации"
Статья 5. Соблюдение прав граждан в сфере охраны здоровья и обеспечение
связанных с этими правами государственных гарантий (п.2)
Государство обеспечивает гражданам охрану здоровья независимо от
пола, расы, возраста, национальности, языка, наличия заболеваний,
состояний, происхождения, имущественного и должностного
положения, места жительства, отношения к религии, убеждений,
принадлежности к общественным объединениям и от других
обстоятельств.
35.
регистрация лекарственных средств;лицензирование отдельных видов деятельности в
сфере обращения лекарственных средств;
аттестация и сертификация специалистов;
осуществление государственного контроля
производства, изготовления, качества,
эффективности и безопасности лекарственных
средств;
государственное регулирование цен на
лекарственные средства.
36.
Федеральный закон от 12 апреля2010 г.
№ 61-ФЗ « Об обращении
лекарственных средств»
Принят Государственной Думой 24
марта 2010 года
Одобрен Советом Федерации 31 марта 2010
.
Президент Российской Федерации
Д.Медведев
Москва, Кремль 12 апреля 2010 г.
«Российская газета» N 78, 14 апреля 2010
г.
Вступил в силу 1 сентября 2010 г.
Действующая последняя редакция
от 02.08.2019
Утратил силу ФЗ от 22 июня 1998 года
37.
.Федеральны
й закон от 22
июня 1998 г.
№ 86-ФЗ
«О
лекарствен
ных
средствах»
Федеральный
закон от 12
апреля 2010 г.
№ 61-ФЗ « Об
обращении
лекарственн
ых средств»
12 глав
47 статей
16 глав
71 статей
38.
«Овнесении
изменений
в
отдельные
законодательные
акты Российской Федерации по
вопросам
применения
информационных технологий в
сфере охраны здоровья»
Вносит изменения в:
- ФЗ от 8 января 1998 года N 3-ФЗ "О наркотических
средствах и психотропных веществах«;
- ФЗ от 12 апреля 2010 года N 61-ФЗ "Об обращении
лекарственных средств«;
- ФЗ от 21 ноября 2011 года N 323-ФЗ "Об основах охраны
здоровья граждан в Российской Федерации"
39.
Глава 1.Ст. 1. Предмет регулирования настоящего Федерального закона-
Регулирует отношения, возникающие в связи с обращением:
- разработкой;
- доклиническими исследованиями;
- клиническими исследованиями;
- экспертизой;
- государственной регистрацией;
- со стандартизацией и с контролем качества;
- производством;
- изготовлением;
- хранением;
- перевозкой, ввозом, вывозом из Российской Федерации;
- рекламой;
- отпуском, реализацией, передачей, применением;
- уничтожением лекарственных средств.
(Часть в редакции, введенной в действие
с 7 января 2012 года Федеральным законом от 6 декабря 2011 года N 409-ФЗ.)
40.
Статья 1. Предмет регулирования настоящего Федерального законаУстанавливает приоритет государственного регулирования
безопасности, качества и эффективности лекарственных средств
при их обращении
(Часть в редакции, введенной в действие с 25 июня 2012 года Федеральным законом от 25 июня
2012 года N 93-ФЗ.).
41.
Статья 2. Сфера применения настоящего Федерального законаСфера применения настоящего Федерального закона
Настоящий Федеральный закон
применяется к отношениям,
возникающим при обращении
лекарственных средств на
территории Российской Федерации.
42.
Законодательство об обращениилекарственных
средств
состоит
из
Статья 3. Законодательство об обращении
лекарственных
средств
настоящего Федерального закона,
других федеральных законов и иных
нормативных правовых актов
Российской Федерации.
Законодательство об обращении
лекарственных средств в отношении
юридических лиц и индивидуальных
предпринимателей, осуществляющих
деятельность на территории
международного медицинского
кластера, применяется с учетом
особенностей, установленных ФЗ «О
международном медицинском
кластере и внесении изменений в
отдельные законодательные акты
Российской Федерации».
43.
Статья 3. Законодательство об обращении лекарственных средствЦель МММК – развитие деятельности
по
оказанию
медицинской
помощи,
повышения её качества, содействия
разработке
лекарственных
препаратов, медицинских технологий
и
медицинских
изделий,
развития
образовательной
деятельности
и
проведения научных исследований в
сфере охраны здоровья на основе
лучших мировых практик.
ОЭСР
44.
Статья 3. Законодательство об обращении лекарственных средствКла́стер (англ. cluster
скопление) — объединение
нескольких однородных
элементов, которое
может рассматриваться
как самостоятельная
45.
История созданияАЦЕТИЛСАЛИЦИЛОВАЯ КИСЛОТА впервые
была синтезирована Шарлем Фредериком
Жераром в 1853 году.
10 августа 1897 года Феликс Хоффман,
работавший в лабораториях фирмы Bayer,
первый
раз
получил
образцы
ацетилсалициловой
кислоты
в
форме,
возможной для медицинского применения.
Сырьем для получения аспирина служила
кора дерева ивы. Хоффман открыл лечебные
свойства
ацетилсалициловой кислоты,
пытаясь найти лекарство для своего отца,
страдавшего ревматизмом.
Уже в 1899 году первая партия этого
лекарства появилась в продаже.
В первые годы продавался как порошок, а с
1904 года в форме таблеток.
46.
Этапы разработки (создания)лекарственных средств
Синтез новых веществ - скрининг
Изучение новых веществ –селекция «кандидатов»
Доклинические исследования на животных , in vitro
Фаза 1 Первое применение у. людей (переносимость)
Фаза 2 Титрование дозы, переносимость, эффективность
Фаза 3 Переносимость, эффективность, сравнение
Регистрация ЛС. Производство. Отпуск и реализация.
Фаза 4 Действие лекарственных средств на практике
ЛПУ (больницы,
клиники)
47.
Термин (клиническиеисследования)
Определение
Стандартная терапия (или плацебо при
Фармакологические
отсутствии стандартов), с которой
Контрольная группа сравнивают эффективность нового
исследования
препарата
(фармакодинамические,
Пациенты, участвующие в исследовании,
фармакокинетические,
имеют одинаковую возможность быть
Токсикологические).
Рандомизированное
включенными в опытную или контрольную
Экспертиза
документов
группу, а факторы, которые могут
исследование
Двойное слепое
исследование
Одинарное слепое
исследование
Открытое
исследование
Параллельные
исследования
повлиять на результаты, одинаково
распределены между двумя группами
Ни врач, ни пациент не знают, получает ли
данный пациент опытное или контрольное
средство, что помогает избежать
субъективизма
Врач знает, какой препарат назначен
данному пациенту, но пациент не знает
Противоположно двойному слепому: и
врач, и пациент знают, какое средство
(опытное или контрольное)назначено и в
какой дозе
Одновременно оценивают как минимум две
схемы, но пациенту назначают только
один вид терапии
Пациенты получают каждый вид лечения
последовательно и таким образом
выступают в качестве контрольной
группы для самих себя. Например, если
48.
Статья 3. Законодательство об обращении лекарственных средствПроцесс создания
новых
лекарственных
средств
выполняется в
соответствии с
международными
стандартами:
GLP (Good Laboratory Pratice –
Качественная
лабораторная
практика);
GMP ( Good Manufakturing Praktik –
Качественная
производственная
49.
Статья 4. Основные понятия, используемые в настоящем ФЗЛекарственные средства
лекарственные
препараты
Лекарственные средства
фармацевтические
субстанции
- вещества или их комбинации,
вступающие в контакт с организмом человека или животного,
проникающие в органы, ткани организма человека или животного,
применяемые для профилактики, диагностики (за исключением веществ
или их комбинаций, не контактирующих с организмом человека или
животного), лечения заболевания, реабилитации, для сохранения,
предотвращения или прерывания беременности и полученные из крови,
плазмы крови, из органов, тканей организма человека или животного,
растений, минералов методами синтеза или с применением
биологических технологий.
50.
Статья 4. Основные понятия, используемые в настоящем ФЗлекарственные препараты лекарственные средства
в
виде
лекарственных
форм,
применяемые для профилактики,
диагностики,
лечения
заболевания, реабилитации, для
сохранения, предотвращения или
прерывания беременности.
лекарственная форма –
состояние лекарственного препарата,
соответствующее способам
его введения и применения
и обеспечивающее достижение
51.
Статья 4. Основные понятия, используемые в настоящем ФЗФармацевтическа
я субстанция
лекарственное средство
в виде одного или
нескольких обладающих
фармакологической
активностью
действующих веществ вне
зависимости от природы
происхождения,
Фармацевтические субстанции должны
поступать
в обращение, если на их первичной
которое предназначено
упаковке
хорошо читаемым шрифтом на русском
для производства,
языке указаны наименование фармацевтической
изготовления
субстанции (международное непатентованное,
лекарственных
или группировочное, или химическое и торговое
наименования),
препаратов наименование производителя
52.
Статья 4. Основные понятия, используемые в настоящем ФЗВспомогательные
вещества
-
вещества
неорганического
или
органического происхождения,
используемые
в
процессе
производства,
изготовления
лекарственных препаратов для
придания
им
необходимых
физико-химических свойств
53.
Статья 4. Основные понятия, используемые в настоящем ФЗДозировка
-
содержание
одного
или
нескольких
действующих
веществ
в
количественном выражении на
единицу
дозы,
или
единицу
объема, или единицу массы в
соответствии с лекарственной
формой
либо
для
некоторых
видов
лекарственных
форм
количество
высвобождаемого
из
лекарственной
формы
действующего
вещества
за
54.
Статья 4. Основные понятия, используемые в настоящем ФЗПеречень
жизненно
необходимых и важнейших
лекарственных препаратов
(ЖНВЛП) ежегодно
утверждаемый
Правительством
Российской
Федерации
перечень
лекарственных препаратов для
медицинского
применения,
обеспечивающих
приоритетные
потребности здравоохранения в
целях профилактики и лечения
заболеваний,
в
том
числе
преобладающих
в
структуре
заболеваемости в Российской
Федерации
55.
Статья 4. Основные понятия, используемые в настоящем ФЗОрфанные
лекарственные
препараты
лекарственные
препараты,
предназначенные
исключительно
для
диагностики
или
патогенетического
лечения
(лечения,
направленного
на
механизм
развития
заболевания) редких (орфанных)
заболеваний
56.
Статья 4. Основные понятия, используемые в настоящем ФЗБиологические
лекарственные
препараты -лекарственные
препараты,
действующее
вещество которых произведено
или
выделено
из
ЛП, полученные из крови, плазмы крови источника
человека и животных
биологического
и
(за исключением цельной крови)
для
определения
и
иммунобиологические ЛП свойств
качества которых необходима
биотехнологические ЛП
комбинация
биологических
и
генотерапевтические ЛП методов :
физико-химических
57.
Статья 4. Основные понятия, используемые в настоящем ФЗИммунобиологические лекарственные
препараты
лекарственные
препараты,
предназначенные
для
формирования
активного или пассивного иммунитета либо
диагностики
наличия
иммунитета
или
диагностики
специфического
приобретенного
изменения
иммунологического
ответа
на
аллергизирующие
вещества
(вакцины,
анатоксины,
токсины,
сыворотки,
иммуноглобулины
и аллергены)
Стаья
46. Маркировка
3.
Лекарственные
средства
в
качестве
сывороток
должны
поступать в обращение с указанием животного, из крови, плазмы
крови, органов и тканей которого они получены.
4.
На
вторичную
(потребительскую)
упаковку
лекарственных
средств, полученных из крови, плазмы крови, органов и тканей
человека, должна наноситься надпись: "Антитела к ВИЧ-1, ВИЧ-2, к
вирусу гепатита С и поверхностный антиген вируса гепатита В
отсутствуют".
58.
Статья 4. Основные понятия, используемые в настоящем ФЗБиотехнологические
лекарственные препараты лекарственные
препараты,
производство
которых
осуществляется
с
использованием
биотехнологических
процессов и методов (в том числе
ДНК-рекомбинантной
технологии,
технологии
контролируемой
экспрессии
генов,
кодирующих
биологически
активные
белки
в
прокариотах и эукариотах, включая
59.
Статья 4. Основные понятия, используемые в настоящем ФЗГенотерапевтические
лекарственные препараты лекарственные
препараты,
фармацевтическая субстанция
которых
является
рекомбинантной
нуклеиновой
кислотой или включает в себя
рекомбинантную
нуклеиновую
кислоту,
позволяющую
осуществлять
регулирование,
репарацию, замену, добавление
или
удаление
генетической
60.
Статья 4. Основные понятия, используемые в настоящем ФЗНаркотические
лекарственные
средства
лекарственные
препараты
и
фармацевтические
субстанции,
содержащие наркотические средства и
включенные в Перечень наркотических
средств, психотропных веществ и их
прекурсоров, подлежащих контролю в
Российской Федерации, в соответствии
с
законодательством
Российской
Федерации,
международными
договорами Российской Федерации, в
том
числе
Единой
конвенцией
о
наркотических средствах 1961 года
Основной перечень НПА
:
61.
Статья 4. Основные понятия, используемые в настоящем ФЗПсихотропные
средства
-
лекарственные
лекарственные
препараты
и
фармацевтические
субстанции, содержащие психотропные
вещества и включенные в Перечень
наркотических средств, психотропных
веществ и их прекурсоров, подлежащих
контролю в Российской Федерации, в
соответствии
с
законодательством
Российской
Федерации,
международными
договорами
Российской Федерации, в том числе
Конвенцией о психотропных веществах
1971 года
- ПП РФ №681 от 30.06 98. «Об утверждении перечня
НС и ПВ и их прекурсоров, подлежащих
62.
Статья 4. Основные понятия, используемые в настоящем ФЗРадиофармацевтические
лекарственные средства лекарственные средства,
которые содержат в готовой для
использования форме один
радионуклид или несколько
радионуклидов (радиоактивных
изотопов)
На
первичную
(потреби-
упаковку
и
вторичную
63.
Статья 4. Основные понятия, используемые в настоящем ФЗОригинальный
лекарственный
препарат с препарат
новым действующим
лекарственный
-
веществом, который первым зарегистрирован в
Российской Федерации или в иностранных государствах
на основании результатов доклинических исследований
лекарственных средств и клинических исследований
лекарственных препаратов, подтверждающих его
качество, эффективность и безопасность
(п. 10.1 введен Федеральным законом от 27.12.2019 N 475-ФЗ)
64.
Статья 4. Основные понятия, используемые в настоящем ФЗРеферентный
препарат
лекарственный
лекарственный
препарат,
который
используется
для
оценки
биоэквивалентности или терапевтической
эквивалентности,
качества,
эффективности
и
безопасности
воспроизведенного ЛП или биоаналогового
(биоподобного) ЛП (биоаналога). В качестве
референтного
ЛП
для
медицинского
применения используется оригинальный ЛП
либо,
если
оригинальный
ЛП
не
зарегистрирован
или
не
находится
в
обороте в Российской Федерации и не
находится
в
обороте
в
иностранных
государствах, воспроизведенный ЛП или
биоаналоговый
(биоподобный)
ЛП
(биоаналог),
который
первым
зарегистрирован из числа находящихся в
обороте
в
Российской
Федерации,
биоэквивалентность или терапевтическая
65.
Статья 4. Основные понятия, используемые в настоящем ФЗВоспроизведенны
й лекарственный
лекарственный
препарат - препарат
для
медицинского
применения,
который
имеет
эквивалентный
референтному
ЛП
качественный состав и
количественный состав
действующих веществ в
эквивалентной
лекарственной
форме,
либо
ЛП
для
ветеринарного
применения,
который
имеет такие же, что и
референтный
ЛП,
качественный состав и
количественный состав
действующих веществ в
такой же лекарственной
Одинаковые свойства:
Отличия:
66.
Референтныйлекарственный препарат
Воспроизведенный
лекарственный препарат
67.
Статья 4. Основные понятия, используемые в настоящем ФЗТерапевтическая
эквивалентность
терапевтическая
эквивалентность лекарственных
препаратов
- достижение клинически сопоставимых терапевтического
эффекта и показателей эффективности и безопасности при
применении лекарственных препаратов для медицинского
применения,
имеющих
одно
международное
непатентованное (или химическое, или группировочное)
наименование, в эквивалентных дозировках по одним и тем
же показаниям к применению и при одинаковом способе
введения у одной и той же группы больных
68.
Статья 4. Основные понятия, используемые в настоящем ФЗБиоаналоговый
(биоподобный)
лекарственный
препарат
(биоаналог) - биологический
лекарственный
препарат,
схожий
по
параметрам
качества,
эффективности
и
безопасности
с
референтным
биологическим лекарственным
препаратом
в
такой
же
лекарственной форме и имеющий
идентичный способ введения
69.
Статья 4. Основные понятия, используемые в настоящем ФЗБиоэквивалентность
лекарственных
препаратов
достижение
сопоставимых показателей скорости
всасывания, степени поступления к
месту действия и скорости выведения
одного или нескольких обладающих
фармакологической
активностью
действующих веществ при применении
лекарственных
препаратов
для
медицинского
применения,
имеющих
одно
международное
непатентованное (или химическое, или
группировочное)
наименование,
в
70.
Статья 4. Основные понятия, используемые в настоящем ФЗВзаимозаменяемый
лекарственный препарат –
лекарственный
препарат
с
доказанной
терапевтической
эквивалентностью
или
биоэквивалентностью в отношении
референтного
лекарственного
препарата, имеющий эквивалентные
ему
качественный
состав
и
количественный
состав
действующих
веществ,
состав
вспомогательных
веществ,
лекарственную
форму
и
способ
введения
71.
Статья 4. Основные понятия, используемые в настоящем ФЗЛекарственное
растительное сырье свежие
или
высушенные
растения
либо
их
части,
используемые
для
производства лекарственных
средств
организациями
производителями
лекарственных
средств
или
изготовления лекарственных
препаратов
аптечными
организациями,
ветеринарными
аптечными
организациями,
индивидуальными
предпринимателями, имеющими
72.
Статья 4. Основные понятия, используемые в настоящем ФЗГомеопатический
лекарственный препарат лекарственный
препарат,
произведенный
или
изготовленный
из
фармацевтической субстанции
или
фармацевтических
субстанций в соответствии с
требованиями
общих
фармакопейных
статей
к
гомеопатическим
лекарственным препаратам или
73.
Статья 4. Основные понятия, используемые в настоящем ФЗМеждународное
непатентованное
наименование
лекарственного средства наименование
действующего
вещества
фармацевтической
субстанции,
рекомендованное
Всемирной
организацией
здравоохранения; (в ред. Федерального
закона от 22.12.2014 N 429-ФЗ)
Торговое
наименование
лекарственного средства -
74.
Статья 4. Основные понятия, используемые в настоящем ФЗГруппировочное наименование
лекарственного
препарата
наименование лекарственного
препарата, не имеющего МНН, или
комбинации
лекарственных
препаратов,
используемое
в
целях объединения их в группу
под
единым
наименованием
исходя из одинакового состава
действующих веществ
Пример – Codeini 0,8 + paracetamoli 0,4
75.
Статья 4. Основные понятия, используемые в настоящем ФЗОбщая фармакопейная статья документ,
утвержденный
уполномоченным федеральным органом
исполнительной власти и содержащий
перечень показателей качества и (или)
методов
контроля
качества
конкретной
лекарственной
формы,
лекарственного растительного сырья,
описания
биологических,
биохимических,
микробиологических,
физико-химических,
физических,
химических и других методов анализа
лекарственного
средства,
а
также
требования к используемым в целях
проведения
данного
анализа
реактивам,
титрованным
растворам,
76.
Статья 4. Основные понятия, используемые в настоящем ФЗСтандартные образцы - вещества,
посредством сравнения с которыми
осуществляется
контроль
качества
исследуемых лекарственных средств с
помощью
физико-химических
и
биологических
методов
в
целях
подтверждения
соответствия
лекарственных средств требованиям
нормативной
документации,
установленным
при
осуществлении
государственной
регистрации,
и
которые применяются для калибровки
стандартных образцов производителя
лекарственных средств, используемых
для контроля качества и иных целей
77.
Статья 4. Основные понятия, используемые в настоящем ФЗНормативная
документация
документ,
содержащий перечень определяемых по результатам
соответствующих экспертиз показателей качества
лекарственного
средства
для
медицинского
применения, методов контроля его качества и
установленный его производителем;
Нормативный
документ
документ,
содержащий
перечень
определяемых
по
результатам
соответствующих
экспертиз
показателей качества и (или) методов контроля
качества
лекарственной
формы,
описания
биологических,
биохимических,
микробиологических,
физико-химических,
физических,
химических
и
других
методов
анализа
лекарственных
средств
для
ветеринарного
применения,
требования
к
используемым
в
целях
проведения
данного
анализа
реактивам,
титрованным
растворам,
индикаторам
и
установленный
его
производителем
78.
Статья 4. Основные понятия, используемые в настоящем ФЗПроизводство
лекарственных
средств
-
деятельность
по
производству
лекарственных
средств
организациями
производителями
лекарственных
средств
на
одной
стадии, нескольких или всех стадиях
технологического процесса, а также
по
хранению
и
реализации
произведенных
лекарственных
средств
Производственная
площадка
территориально
обособленный
комплекс
производителя
лекарственных
79.
Статья 4. Основные понятия, используемые в настоящем ФЗОбщий
технический
документ
комплект документов и материалов,
состоящий из нескольких разделов документации
административного
характера,
химической,
фармацевтической и биологической
документации,
фармакологической,
токсикологической
документации,
клинической
документации
и
представляемый
одновременно
с
заявлением
о
государственной
регистрации
лекарственного
препарата
для
медицинского
применения в формате, установленном
уполномоченным федеральным органом
исполнительной власти
80.
Статья 4. Основные понятия, используемые в настоящем ФЗСерия
средства
лекарственного
количество
лекарственного
средства,
произведенное
в
результате
одного
технологического
цикла его производителем
Разработчик
лекарственного средства организация,
правами
на
доклинических
обладающая
результаты
исследований
81.
Статья 4. Основные понятия, используемые в настоящем ФЗРегистрационное
удостоверение
лекарственного
препарата
документ,
подтверждающий
факт
государственной
регистрации
лекарственного препарата;
Держатель
или
владелец
регистрационного
удостоверения
лекарственного
препарата
разработчик
лекарственного
средства,
производитель
лекарственных
средств
или
иное
юридическое лицо, обладающее правом
владения
регистрационным
удостоверением,
которые
несут
ответственность
за
качество,
82.
Регистрационноеудостоверение
лекарственного
препарата
документ,
подтверждающий
факт
государственной
регистрации
лекарственного препарата;
Держатель
или
владелец
регистрационного
удостоверения
лекарственного
препарата
разработчик
лекарственного
средства,
производитель
лекарственных
средств
или
иное
юридическое лицо, обладающее правом
владения
регистрационным
удостоверением,
которые
несут
ответственность
за
качество,
83.
В Российской Федерации допускаютсяпроизводство, изготовление,
хранение, перевозка, ввоз в
Российскую Федерацию, вывоз из
Российской Федерации, реклама,
отпуск, реализация, передача,
применение, уничтожение
лекарственных препаратов, если они
зарегистрированы соответствующим
уполномоченным федеральным
органом исполнительной власти.
84.
Статья 4. Основные понятия, используемые в настоящем ФЗфальсифицированное
лекарственное
средство
лекарственное
средство,
сопровождаемое
ложной
информацией о его составе и (или) производителе;
недоброкачественное
лекарственное
средство
лекарственное средство, не соответствующее требованиям
фармакопейной статьи либо в случае ее отсутствия
требованиям нормативной документации или нормативного
документа;
контрафактное лекарственное средство - лекарственное
средство, находящееся в обороте с нарушением гражданского
законодательства
85.
Статья 4. Основные понятия, используемые в настоящем ФЗДоклиническое исследование лекарственного средства -
биологические,
микробиологические,
иммунологические,
токсикологические, фармакологические, физические, химические и
другие исследования лекарственного средства путем применения
научных методов оценок в целях получения доказательств
безопасности, качества и эффективности лекарственного средства;
Клиническое исследование лекарственного препарата -
изучение
диагностических,
лечебных,
профилактических,
фармакологических свойств лекарственного препарата в процессе его
применения у человека, животного, в том числе процессов всасывания,
распределения, изменения и выведения, путем применения научных
методов оценок в целях получения доказательств безопасности,
качества и эффективности лекарственного препарата, данных о
нежелательных реакциях организма человека, животного на
применение
лекарственного
препарата
и
об
эффекте
его
взаимодействия с другими лекарственными препаратами и (или)
пищевыми продуктами, кормами
86.
Статья 4. Основные понятия, используемые в настоящем ФЗМногоцентровое клиническое исследование
препарата для медицинского применения –
лекарственного
клиническое
исследование
лекарственного
препарата
для
медицинского
применения,
проводимое
разработчиком
лекарственного препарата в двух и более медицинских
организациях по единому протоколу клинического исследования
лекарственного препарата;
Международное многоцентровое клиническое исследование
лекарственного препарата для медицинского применения –
исследование лекарственного препарата для медицинского
применения, проводимое разработчиком лекарственного препарата
в различных странах по единому протоколу клинического
исследования лекарственного препарата
87.
Статья 4. Основные понятия, используемые в настоящем ФЗПострегистрационное
клиническое
исследование
лекарственного
препарата
для
медицинского
применения –
клиническое
исследование
лекарственного
препарата
для
медицинского применения, проводимое
производителем
лекарственного
препарата,
гражданский
оборот
которого
осуществляется
после
государственной регистрации, в целях
дополнительного сбора данных о его
безопасности
и
эффективности,
расширения показаний к применению
данного лекарственного препарата, а
также
выявления
нежелательных
реакций пациентов на его действие
88.
Статья 4. Основные понятия, используемые в настоящем ФЗИсследование биоэквивалентности лекарственного препарата вид клинического исследования лекарственного препарата, проведение
которого осуществляется для определения скорости всасывания и
выведения одного или нескольких обладающих фармакологической
активностью действующих веществ, количества лекарственного
препарата, достигающего системного кровотока, и результаты которого
позволяют сделать вывод о биоэквивалентности воспроизведенного
лекарственного препарата в определенных лекарственной форме и
дозировке, соответствующих форме и дозировке референтного
лекарственного препарата;
Исследование терапевтической эквивалентности лекарственных
препаратов - вид клинического исследования лекарственных
препаратов, проведение которого осуществляется для выявления
одинаковых
свойств
лекарственных
препаратов
определенной
лекарственной формы, а также наличия одинаковых показателей
безопасности и эффективности лекарственных препаратов, одинаковых
клинических эффектов при их применении
89.
Статья 4. Основные понятия, используемые в настоящем ФЗПротокол клинического исследования лекарственного препарата
- документ, в котором определяются цели, формы организации и
методология
проведения
клинического
исследования,
статистические методы обработки результатов такого исследования
и меры по обеспечению безопасности физических лиц, участвующих
в клиническом исследовании лекарственного препарата;
Брошюра исследователя - сводное изложение результатов
доклинического
исследования
лекарственного
средства
и
клинического исследования лекарственного препарата для
медицинского применения;
Информационный листок пациента - документ, в котором
содержатся в доступной форме сведения, касающиеся проводимого
клинического исследования лекарственного препарата, и в
письменной форме добровольное согласие пациента на участие в
клиническом исследовании лекарственного препарата после
ознакомления с особенностями клинического исследования,
имеющими значение для выражения такого согласия
90.
Статья 4. Основные понятия, используемые в настоящем ФЗКачество
средства
лекарственного
соответствие
лекарственного
средства
требованиям фармакопейной статьи
либо
в
случае Эффективность
ее
отсутствия
лекарственного препарата нормативной
документации
или
Безопасность
характеристика степени
нормативного
лекарственного средства - документа
характеристика
лекарственного средства,
основанная на
сравнительном анализе его
эффективности и риска
причинения вреда
здоровью
-
положительного влияния
лекарственного препарата на
течение, продолжительность
заболевания или его
предотвращение,
реабилитацию, на сохранение,
предотвращение или
прерывание беременности
91.
Статья 4. Основные понятия, используемые в настоящем ФЗПобочное
действие
реакция
организма, возникшая в связи с
применением
лекарственного
препарата в дозах, рекомендуемых
в инструкции по его применению,
для
профилактики,
диагностики,
лечения
заболевания
или
для
реабилитации
Нежелательная
реакция
непреднамеренная
неблагоприятная
реакция
организма,
которая
может
быть
связана
с
применением
лекарственного препарата
92.
Статья 4. Основные понятия, используемые в настоящем ФЗсерьезная
нежелательная
реакция
нежелательная реакция организма, связанная с
применением
лекарственного
препарата,
приведшая к смерти, врожденным аномалиям или
порокам развития либо представляющая собой
угрозу жизни, требующая госпитализации или
приведшая к стойкой утрате трудоспособности и
(или) инвалидности
непредвиденная нежелательная реакция
- нежелательная реакция организма, которая
связана
с
применением
лекарственного
препарата в дозах, рекомендуемых в протоколе
его
клинического
исследования,
брошюре
исследователя,
или
с
применением
лекарственного
препарата
в
дозах,
рекомендуемых в инструкции по его применению
для
профилактики,
диагностики,
лечения
заболевания
или
медицинской
реабилитации
пациента, и сущность, тяжесть или исход которой
не соответствует информации о лекарственном
препарате,
содержащейся
в
протоколе
его
клинического
исследования,
брошюре
исследователя или в инструкции по применению
лекарственного препарата
93.
Безопасностьлекарственного
препарата
должна изучаться на
протяжении
всего «жизненного цикла
товара» , так как
одно официальное разрешение
(регистрационное
свидетельство) не является
гарантией его
безопасности.
94.
Статья 4. Основные понятия, используемые в настоящем ФЗКомплексная оценка лекарственного препарата оценка
зарегистрированного
лекарственного
препарата,
включающая в себя анализ информации о сравнительной
клинической эффективности и безопасности лекарственного
препарата, оценку экономических последствий его применения,
изучение
дополнительных
последствий
применения
лекарственного препарата в целях принятия решений о
возможности включения лекарственного препарата в перечень
жизненно
необходимых
и
важнейших
лекарственных
препаратов, нормативные правовые акты и иные документы,
определяющие порядок оказания медицинской помощи, или
исключения его из указанных перечня, актов и документов.
95.
Статья 4. Основные понятия, используемые в настоящем ФЗСистема мониторинга движения лекарственных
препаратов для медицинского применения федеральная
государственная
информационная
система
мониторинга движения лекарственных препаратов для
медицинского применения от производителя до конечного
потребителя с использованием в отношении лекарственных
препаратов
для
медицинского
применения
средств
идентификации.
(п. 56 введен Федеральным законом от 28.12.2017 N 425-ФЗ)
96.
Статья 4. Основные понятия, используемые в настоящем ФЗФармаконадзор - вид деятельности
по
мониторингу
эффективности
и
безопасности
лекарственных
препаратов,
направленный
на
выявление, оценку и предотвращение
нежелательных
последствий
применения
лекарственных
препаратов
План
управления
рисками
подробное описание мероприятий по
фармаконадзору,
направленных
на
выявление, оценку и предотвращение
или минимизацию рисков, связанных с
лекарственными препаратами, включая
97.
Статья 4. Основные понятия, используемые в настоящем ФЗРецепт
препарат
на
лекарственный
- медицинский документ установленной
формы, содержащий назначение лекарственного препарата для
медицинского применения, выданный медицинским работником в
целях отпуска лекарственного препарата или его изготовления и
отпуска на бумажном носителе или с согласия пациента или его
законного представителя в форме электронного документа,
подписанного с использованием усиленной квалифицированной
электронной подписи медицинского работника, либо документ
установленной формы, содержащий назначение лекарственного
препарата для ветеринарного применения, выданный ветеринарным
работником в целях отпуска лекарственного препарата или его
изготовления и отпуска на бумажном носителе;«
–
(письменное
назначение
лекарственного
препарата по установленной форме, выданное
медицинским
или
ветеринарным
работником,
имеющим
на
это
право,
в
целях
отпуска
лекарственного
препарата
или
его
изготовления и отпуска)
98.
Статья 4. Основные понятия, используемые в настоящем ФЗТребование
медицинской
организации,
ветеринарной организации –
требование медицинской организации,
ветеринарной организации - документ
установленной формы, который выписан
медицинским
работником
или
специалистом в области ветеринарии,
имеющими на это право, и содержит в
письменной форме указание аптечной
организации
или
ветеринарной
аптечной
организации
об
отпуске
лекарственного препарата или о его
изготовлении
и
об
отпуске
для
обеспечения лечебного процесса в
медицинской
организации,
ветеринарной организации;
(в ред. Федерального закона от 02.08.2019 N 297-ФЗ)
99.
Статья 4. Основные понятия, используемые в настоящем ФЗСубъекты обращения
лекарственных
средств –
физические лица, в том
числе индивидуальные
предприниматели, и
юридические лица,
осуществляющие
деятельность при
обращении лекарственных
средств
100.
Статья 4. Основные понятия, используемые в настоящем ФЗФармацевтическая
деятельность
деятельность,
включающая
в
себя
оптовую
торговлю
лекарственными средствами, их
хранение,
перевозку
и
(или)
розничную
торговлю
лекарственными
препаратами,
их отпуск, хранение, перевозку,
изготовление
лекарственных
препаратов
101.
Субъекты фармацевтической деятельностиОрганизация оптовой торговли
лекарственными средствами организация, осуществляющая оптовую торговлю
лекарственными средствами, их хранение, перевозку
в соответствии с требованиями настоящего
Федерального закона
102.
Субъекты фармацевтической деятельностиАптечная организация –
организация, структурное подразделение
медицинской организации, осуществляющие
розничную торговлю лекарственными препаратами,
хранение, перевозку, изготовление и отпуск
лекарственных препаратов для медицинского
применения в соответствии с требованиями
настоящего Федерального закона
103.
Субъекты фармацевтической деятельностиВетеринарная аптечная
организация - организация, структурное
подразделение ветеринарной организации,
осуществляющие розничную торговлю
лекарственными препаратами, хранение,
изготовление и отпуск лекарственных препаратов для
ветеринарного применения в соответствии с
требованиями настоящего
Федерального закона
104.
Субъекты фармацевтической деятельности – сельские поселения, вкоторых отсутствуют аптечные организации
Индивидуальные предприниматели
Медицинские организации
Амбулатории, фельдшерские,
фельдшерско-акушерские пункты
Центры(отделения) общей
врачебной (семейной) практики
Ветеринарные организации
105.
Статья 45. Производство лекарственных средствПроизводство лекарственных средств
должно соответствовать
требованиям
правил надлежащей
производственной практики.
Выдача заключений о соответствии
производителя лекарственных
средств требованиям правил
надлежащей производственной
практики осуществляется
по результатам
инспектирования
производителей лекарственных
средств.
106.
Статья 45. Производство лекарственных средствПроизводство лекарственных средств
в Российской Федерации
осуществляется производителями
лекарственных средств, имеющими
лицензию на производство
лекарственных средств.
107.
Статья 45. Производство лекарственных средствПроизводство лекарственных средств осуществляется с
соблюдением требований промышленного регламента,
который утверждается руководителем производителя
лекарственных средств и включает в себя перечень:
используемых фармацевтических субстанций и
вспомогательных веществ с указанием количества каждого
из них;
данные об используемом оборудовании;
описание технологического процесса;
методов контроля на всех этапах производства
лекарственных средств.
108.
Статья 45. Производство лекарственных средствПри производстве лекарственных средств используются
фармацевтические субстанции, включенные в
государственный реестр лекарственных средств, исключение фармацевтические субстанции, производимые для проведения
клинических исследований и для экспорта.
К процессу производства фармацевтической субстанции относятся любые
стадии технологического процесса, позволяющие получить готовый
продукт, соответствующий требованиям фармакопейной статьи, в том
числе:
ферментация;
экстракция;
очистка;
выделение;
перекристаллизация;
высушивание;
измельчение.
109.
Статья 45. Производство лекарственных средствОрганизации,
осуществляющие
производство
фармацевтической
субстанции
спирта
этилового
(этанола)
для
производства
спиртосодержащих
лекарственных
препаратов, обязаны осуществлять
учет и декларирование в порядке,
установленном статьями 8 и 14
Федерального закона от 22 ноября
1995
года
N
171-ФЗ
"О
государственном
регулировании
производства и оборота этилового
спирта,
алкогольной
и
спиртосодержащей продукции и об
ограничении потребления (распития)
алкогольной продукции".
110.
Статья 45. Производство лекарственных средствЗапрещается производство:
1) лекарственных средств, не включенных в государственный реестр лекарственных
средств, за исключением лекарственных средств, производимых для проведения
клинических исследований и для экспорта;
2) фальсифицированных лекарственных средств;
3) лекарственных средств без лицензии на производство лекарственных средств;
4) лекарственных средств с нарушением правил организации производства и
контроля качества лекарственных средств.
6. При вводе лекарственных средств в гражданский оборот уполномоченное лицо
производителя лекарственных средств осуществляет подтверждение соответствия
лекарственных средств требованиям, установленным при их государственной
регистрации, и гарантирует, что лекарственные средства произведены в соответствии с
требованиями правил надлежащей производственной практики.
7.Уполномоченным лицом производителя лекарственных средств является его
работник, аттестованный в установленном уполномоченным федеральным органом
исполнительной власти порядке и имеющий стаж работы не менее чем пять лет в
области производства и (или) контроля качества лекарственных средств, высшее
образование соответственно по одной из специальностей и (или) одному из направлений
подготовки:
биология,
биотехнология,
ветеринария,
клиническая
медицина,
радиационная, химическая и биологическая защита, фармация, фундаментальная
медицина, химическая технология, химия.
111.
Статья 45. Производство лекарственных средствПроизводители лекарственных средств могут осуществлять
продажу лекарственных средств или передавать их в
установленном законодательством Российской Федерации
порядке:
другим производителям лекарственных средств для производства
лекарственных средств;
организациям оптовой торговли лекарственными средствами;
аптечным организациям, ветеринарным аптечным организациям,
индивидуальным предпринимателям, имеющим лицензию на
фармацевтическую деятельность или лицензию на медицинскую
деятельность;
научно-исследовательским организациям для научноисследовательской работы;
медицинским организациям и ветеринарным организациям;
организациям, осуществляющим разведение, выращивание и
содержание животных.
112.
Статья 46. МаркировкаНа первичной упаковке (за
исключением
первичной
упаковки
ЛРС)
хорошо
читаемым
шрифтом
на
русском языке указаны:
наименование
лекарственного
препарата
(международное
непатентованное,
или
группировочное,
или
химическое,
или
торговое наименование),
номер
серии,
дата
выпуска
(для
113.
Статья 46. МаркировкаНа
вторичной
(потребительской)
упаковке хорошо читаемым шрифтом на
русском языке указаны:
наименование
лекарственного
препарата
(международное
непатентованное,
или
группировочное, или химическое и
торговое наименования),
наименование
производителя
лекарственного препарата,
номер
серии,
дата
выпуска
(для
иммунобиологических
лекарственных препаратов),
номер
регистрационного
На вторичную
удостоверения,
(потребительскую)
срок годности,
упаковку
способ применения,
114.
Статья 46. МаркировкаНа первичную упаковку (если для
этого
существует
техническая
возможность)
и
вторичную
(потребительскую)
упаковку
лекарственных
препаратов,
предназначенных для клинических
исследований,
должна
наноситься
надпись:
"Для
клинических
исследований".
Упаковка
лекарственных
средств,
предназначенных
исключительно
для
экспорта,
маркируется
в
115.
Статья 46. МаркировкаНа транспортную тару, которая не
предназначена для потребителей и в
которую
помещено
лекарственное
средство,
должна
наноситься
следующая информация:
наименование
лекарственного
средства;
сериия лекарственного средства;
дата выпуска;
количество
вторичных
(потребительских)
упаковок
лекарственного средства;
производитель
лекарственного
средства с указанием наименования
и местонахождения производителя
лекарственного средства (адрес, в
том
числе
страна
и
(или)
место
116.
Особенности предложений патентная защита, вывод на рынокЛП с регистрационным
удостоверением, при этом ЛП
должны быть не только безопасны,
но и эффективны.
Особенности спроса - система,
состоящая из врача, аптеки,
потребителя и субъекта оплаты.
117.
Министерство здравоохраненияРоссийской Федерации
Департамент
государственного
регулирования
обращения
лекарственных
средств
Отдел
клинических
исследований
лекарственных
препаратов
Отдел
регистрации
лекарственных
препаратов
Отдел
регулирования
обращения
зарегистрирован
ных
лекарственных
препаратов
Отдел
регистрации
цен на
жизненно
необходимые
и важнейшие
лекарственные
препараты
118.
Министерство здравоохраненияРоссийской
Федерации
Департамент
Отдел
норматив
ноправовог
о
регулиро
вания
вопросов
ЛО
и
контроля
качества
лекарств
енных
средств
лекарственного
обеспечения и
регулирования
обращения
Отдел
медицинских
норматив
изделий
ноОтдел
нормати
вноправово
го
регулир
ования
обращен
ия
медицин
ских
изделий
правовог
о
регулиро
вания
фармацев
тической
деятельн
ости,
оборота
наркотич
еских
средств
и
психотро
Отдел
лекарств
енного
обеспече
ния
граждан
Отдел
обеспече
ния
вакциноп
рофилактики
населени
я
119.
Статья 9. Государственный контроль (надзор) в сфере обращения лекарственных средств1. Государственный контроль (надзор) в сфере обращения
лекарственных средств включает в себя:
1) лицензионный контроль в сфере производства лекарственных
средств и в сфере фармацевтической деятельности;
2) федеральный государственный надзор в сфере обращения
лекарственных средств;
3) выборочный контроль качества лекарственных средств.
Федеральный закон от 4 мая 2011 года
N 99-ФЗ "О лицензировании отдельных видов деятельности»
Постановление Правительства РФ от 22 декабря 2011 г.
N 1081 "О лицензировании фармацевтической деятельности"
120.
Этаппредоставления
лицензии
Проверка полноты и
достоверности сведений
о соискателе лицензии,
содержащихся
в заявлении и документах
Возможность выполнения
.
лицензионных
требований и условий
Этап
осуществлениия
лицензируемого
вида деятельности
проверка сведений
о лицензиате
соблюдение
лицензионных
требований и условий
121.
-Роздравнадзор;
- территориальные управления
Росздравнадзора;
- испытательные лаборатории;
- единая информационная система;
- система качества в
организациях-производителях ЛП,
розничных и оптовых
фармацевтических организациях
122.
Оценка эффективностибезопасности и качества
на ЛП при регистрации
(на опытнопромышленных или
промышленных
образцах)
Мониторинг качества,
эффективности и
безопасности ЛП,
находящихся в
обращении
Экспертиза качества ЛП,
находящихся в
гражданском обороте
(проводится выборочно)
Инспекционный
контроль
123.
-решение о приобретении ЛП зачастую не зависитот самого потребителя;
- потребитель, выбирающий ЛП самостоятельно, как
правило, не располагает необходимой
информацией терапевтической эффективности и
соответствия этих свойств к цене;
- желание скорее выздороветь побуждает
потребителя приобретать дорогостоящие ЛП;
- социально значимый товар, в связи с этим
малоэластичный
и
даже
в
условиях
кризиса
экономики производство ЛП подвержено меньшим
спадом;
существенная
часть
расходов
на
ЛП
оплачивается
за
счет
гос.средств.
Их
рациональное
использование
диктует
необходимость
обеспечения
адекватного
потребления ЛП и сдерживает рост цен на них;
- сильная монополизация производства и сбыта;
- наличие на рынке новых патентованных ЛП по
монопольно высоким ценам;
- значительное влияние законодательной базы,
больших
расходов
на
НИР,
конкуренция
со
стороны дженериков.
124.
Элементы государственногорегулирования
Государственная
регистрация цен
на ЖНВЛП
осуществляется на
основании
обязательного
обращения
производителей
Установление
субъектами РФ
предельных
торговых
надбавок к ценам
на ЖВНЛП по
единой методике
к ценам
производителей
Создание информационной
базы
данных по уровню цен
производителей
Уровень цен на ЛП,
закупаемые за счет
бюджетных средств
определяется в
ходе аукционов и
электронных
торгов (котировок)
125.
Приложениек постановлению Правительства Москвы
от 24 февраля 2010 г. N 163-ПП
__________________________________________________________________
Надбавки
Фактическая отпускная цена
Предельная
производителя
надбавка, %
__________________________________________________________________
Предельная оптовая
до 50 руб. включительно
20
надбавка к фактической свыше 50 руб. до 500 руб.
отпускной цене
включительно
15
производителя
свыше 500 руб.
10
Предельная розничная
надбавка к фактической
отпускной цене
производителя
до 50 руб. включительно
свыше 50 руб. до 500 руб.
включительно
свыше 500 руб.
32
28
15
126.
127.
Статья 24. Реклама лекарственных средств, медицинских изделий имедицинских услуг, методов профилактики, диагностики, лечения и
медицинской реабилитации, методов народной медицины
128.
Статья 24. Реклама лекарственных средств, медицинских изделий имедицинских услуг, методов профилактики, диагностики, лечения и
медицинской реабилитации, методов народной медицины
Лекарственные препараты
–
это средства:
предназначенные для профилактики,
диагностики и лечения заболеваний
человека, а также предотвращение
беременности
(обеспечивают физическое,
психическое, социальное благополучие
личности, т.е. высшие человеческие
ценности);
потребителю предлагается товар,
обладающий вредоносными свойствами
(возможность причинения вреда
здоровью или жизни как при
129.
Первичнаяаккредита
ция
-
Специализиро
ванная
аккредитация
Периодич
еская
аккредит
ация
- после
- все
окончания
специали
ординатуры (2
сты
года):
с
• управление и
периодичн
экономика
остью
фармации;
1 раз в 5 лет
• фармацевтическ
ая технология;
• фармацевтическ
аяот
химия
Приказ Минздрава России
02.06.2016и№334н(ред. от 19.05.2017)
фармакогнозия
«Об утверждении Положения
об аккредитации специалистов»
после окончания
ВУЗА;
после переподготовки
130.
Приказ Минздрава России от 06.06.2016 N 352н «Форма:Свидетельство об аккредитации специалиста в
сфере медицинской или фармацевтической
деятельности»
Приказ Минтруда России от 09.03.2016 N 91н "Об
утверждении профессионального стандарта
«Провизор»
Приказ Министерства труда и социальной
защиты РФ от 22 мая 2017 г. N 427н «Об утверждении
профессионального стандарта "Провизораналитик»
Приказ Минздрава России от 08.10.2015 N 707н (ред. от
15.06.2017) «Об утверждении Квалификационных
требований к медицинским и фармацевтическим
работникам с высшим образованием по
направлению подготовки "Здравоохранение и
медицинские науки"...
Федеральный закон от 21.11.2011 №323-ФЗ "Об основах
охраны здоровья граждан в Российской
Федерации" с изменениями, внесенными ФЗ от
29.12.2015 № 389-ФЗ
131.
Сведения о лекарственных средствах,которые содержит
Единая информационная система
Росздравнадзора
132.
Глава 15. Ответственность за нарушение законодательства Российской Федерациипри обращении лекарственных средств и возмещение вреда, причиненного
здоровья граждан вследствие применения лекарственных средств
Статья 68. Ответственность за нарушение законодательства Российской Федерации при
обращении лекарственных средств
1. Нарушение законодательства Российской Федерации при обращении лекарственных
средств влечет за собой ответственность в соответствии с законодательством
Российской Федерации.
2. За непредставление информации и (или) данных, предусмотренных настоящим
Федеральным законом, субъекты обращения лекарственных средств несут
ответственность в соответствии с законодательством Российской Федерации.
«Кто имея возможность предупредить преступление не делает этого
.
тот ему способствует»
.
Сенека
133.
.134.
.135.
.136.
Статья 59. Основания и порядок уничтожения лекарственных средствНедоброкачественные
лекарственные
средства,
фальсифицированные
лекарственные
средства
подлежат
изъятию из обращения и уничтожению в
порядке,
установленном
Правительством
Российской
Федерации.
Основанием
для
уничтожения
лекарственных
средств
является
решение
владельца
лекарственных
средств,
решение
соответствующего
уполномоченного
федерального
органа исполнительной власти или
решение суда.
Контрафактные
лекарственные
средства
подлежат
изъятию
из
обращения
и уничтожению по решению
.
суда.
Порядок
уничтожения
контрафактных
лекарственных
средств
устанавливается
137.
Статья 59. Основания и порядок уничтожения лекарственных средствРасходы,
связанные с уничтожением
контрафактных
лекарственных
средств,
недоброкачественных
лекарственных
средств,
фальсифицированных
лекарственных
средств, возмещаются их владельцем.
Владелец
лекарственных
средств
должен представить в уполномоченный
федеральный
орган
исполнительной
власти документ или заверенную в
установленном
порядке
его
копию,
подтверждающие
факт
уничтожения
лекарственных средств.
Соответствующий
уполномоченный
.
федеральный
орган
исполнительной
власти,
принявший
решение
об
уничтожении лекарственных средств,
осуществляет
контроль
за
их
138.
Статья 59. Основания и порядок уничтожения лекарственных средствУничтожение лекарственных средств
производится
организациями,
имеющими
соответствующую
лицензию,
на
специально
оборудованных
площадках,
полигонах
и
в
специально
оборудованных
помещениях
с
соблюдением требований в области
охраны
окружающей
среды
в
соответствии с законодательством
Российской Федерации.
Наркотические
лекарственные
средства,
психотропные
лекарственные
средства,
.
радиофармацевтические
лекарственные
средства
уничтожаются
в
соответствии
с
139.
Cтатья67.
Информация
о
лекарственных
препаратах. Система мониторинга
движения лекарственных препаратов для
медицинского применения
Глава 14. ИНФОРМАЦИЯ О ЛЕКАРСТВЕННЫХ ПРЕПАРАТАХ. СИСТЕМА
МОНИТОРИНГА ДВИЖЕНИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
1. Информация о ЛП, отпускаемых по рецепту на ЛП, должна
содержаться только в специализированных изданиях,
предназначенных для медицинских, фармацевтических
работников, специалистов в области ветеринарии.
Информация о ЛП для специалистов в области обращения
лекарственных
средств
может
содержаться
в
монографиях,
справочниках,
научных
статьях,
в
докладах на конгрессах, конференциях, симпозиумах,
научных советах, а также в инструкциях по применению
ЛП.
2. Информация о ЛП, отпускаемых без рецепта на ЛП, может
содержаться в публикациях и объявлениях средств
массовой информации, специализированных и общих
печатных изданиях, инструкциях по применению ЛП,
иных изданиях субъектов обращения лекарственных
средств. Рекламные материалы о ЛП, отпускаемом без
рецепта на ЛП, должны соответствовать инструкции по
применению ЛП.
3. Допускается использование любых материальных
носителей,
позволяющих
хранить,
передавать
и
использовать информацию о ЛП без ее искажения.
.
140.
Cтатья 67. Информация о лекарственныхпрепаратах. Система мониторинга
движения лекарственных препаратов для
4.
Для
целей
идентификации
медицинского
применения упаковок
лекарственных
препаратов
для
медицинского
применения производители лекарственных средств
в
порядке,
установленном
Правительством
Российской
Федерации,
наносят
на
первичную
упаковку (в отношении лекарственных препаратов
для медицинского применения, для которых не
предусмотрена вторичная упаковка) и вторичную
(потребительскую)
упаковку
лекарственных
препаратов
для
медицинского
применения
средства
идентификации,
за
исключением
лекарственных
препаратов
для
медицинского
применения,
производимых
для
проведения
клинических
исследований,
экспорта,
лекарственных
препаратов
для
медицинского
применения, указанных в частях 5 и 8 статьи 13
настоящего
Федерального
закона,
радиофармацевтических
лекарственных
препаратов и пиявок медицинских.
5.
Характеристики
средства
идентификации,
порядок его нанесения и требования к структуре и
формату информации, которую содержит средство
.
идентификации,
определяются
Правительством
Российской Федерации.
141.
Cтатья67.
Информация
о
лекарственных
препаратах. Система мониторинга
движения лекарственных препаратов для
6.
Порядок
создания,
развития,
ввода
в
медицинского
применения
эксплуатацию,
эксплуатации
и
вывода
из
эксплуатации
системы
МДЛП
для
МП,
порядок
предоставления
информации,
содержащейся
в
системе МДЛП для МП, и порядок взаимодействия
указанной
системы
с
иными
государственными
информационными системами и информационными
системами
юридических
лиц
и
индивидуальных
предпринимателей,
указанных
в
частях
7
и
10
настоящей
статьи,
устанавливаются
Правительством
Российской
Федерации.
Операторами
системы
МДЛП
для
МП
являются
федеральный орган исполнительной власти и (или)
организация,
уполномоченные
Правительством
Российской Федерации.
7.
Юридические
лица
и
индивидуальные
предприниматели, осуществляющие производство,
хранение, ввоз в Российскую Федерацию, отпуск,
реализацию, передачу, применение и уничтожение
лекарственных препаратов для МП, обеспечивают в
порядке
и
в
составе,
которые
установлены
.
Правительством Российской Федерации с учетом
вида осуществляемой ими деятельности, внесение
информации
о
лекарственных
препаратах
для
медицинского применения в систему МДЛП для МП.
142.
Cтатья 67. Информация о лекарственныхпрепаратах. Система мониторинга
движения лекарственных препаратов для
медицинского применения
8.
Организация
информационного
взаимодействия системы МДЛП для МП с иными
государственными
информационными
системами
обеспечивается
в
том
числе
посредством
инфраструктуры,
обеспечивающей
информационнотехнологическое
взаимодействие
информационных систем, используемых для
предоставления
государственных
и
муниципальных
услуг
и
исполнения
государственных и муниципальных функций в
электронной форме.
9. Общедоступная информация, содержащаяся в
системе
МДЛП
для
МП,
размещается
в
информационно-телекоммуникационной сети
"Интернет" (в том числе в форме открытых
данных)
в
порядке,
установленном
Правительством Российской Федерации.
10.
Производители
лекарственных
средств
.
получают содержащуюся в системе МДЛП для МП
информацию
о
сериях
и
партиях
лекарственных
препаратов,
производимых
ими и находящихся в гражданском обороте в
143.
Cтатья67.
Информация
о
лекарственных
препаратах. Система мониторинга
движения лекарственных препаратов для
медицинского применения
11. За производство или продажу лекарственных
препаратов для медицинского применения без
нанесения
средств
идентификации,
с
нарушением
установленного
порядка
их
нанесения,
а
также
за
несвоевременное
внесение данных в систему МДЛП для МП или
внесение
в
нее
недостоверных
данных
юридические
лица
и
индивидуальные
предприниматели, указанные в частях 4 и 7
настоящей статьи, несут ответственность в
соответствии с законодательством Российской
Федерации.
12. Правительство Российской Федерации вправе
установить особенности внедрения системы
МДЛП для МП, включая сроки ее внедрения, в
отношении
лекарственных
препаратов
для
медицинского
применения,
включенных
в
перечень
ЖНВЛП,
лекарственных
препаратов,
предназначенных для обеспечения лиц, больных
гемофилией,
муковисцидозом,
гипофизарным
нанизмом, . болезнью
Гоше,
злокачественными
новообразованиями лимфоидной, кроветворной и
родственных им тканей, рассеянным склерозом,
лиц
после
трансплантации
органов
и
(или)
тканей, иных лекарственных препаратов для
144.
развитие фармацевтической науки и производства;- инновации в клинической медицине и
здравоохранении;
- изменяющиеся условия функционирования внутреннего и
мирового фармацевтического рынка;
- развитие цифровых технологий
145.
146.
— технология последовательной цепи блоков, содержащихданные в качестве реестров, контрактов, кредитов, прав
собственности и любых других форм.
147.
"Блокчейн потенциально имеет далеко идущие последствия для нашихрынков. И нашими действиями в качестве регуляторов и политиков мы
должны гарантировать, что мы делаем все для использования
возможностей и получения более широких экономических выгод.
Нельзя стоять на пути инноваций и развития.
В то же время, мы должны снизить риски. В конце концов, мы работаем
для гарантии того, что инвесторы и эмитенты могут продолжать
доверять рынку". Грег Meдкрафт
.
«Технология
блокчейн —
это новый
интернет»
Герман Греф
148.
149.
150.
151.
152.
153.
«Аптекарь,яко
добрый
гражданин,
верно
хранящий
присяжную
должность,
повинен
быть искусен, истен, совестен,
благоразумен, трезв, прилежен, во
всякое
время
присутствен,
исполняющий звание свое всеобщему
благу соответственно"
«Аптекарский устав», принятый в 1789 году.
154.
155.
Желаю Вам успехов во всех добрыхначинаниях и делах















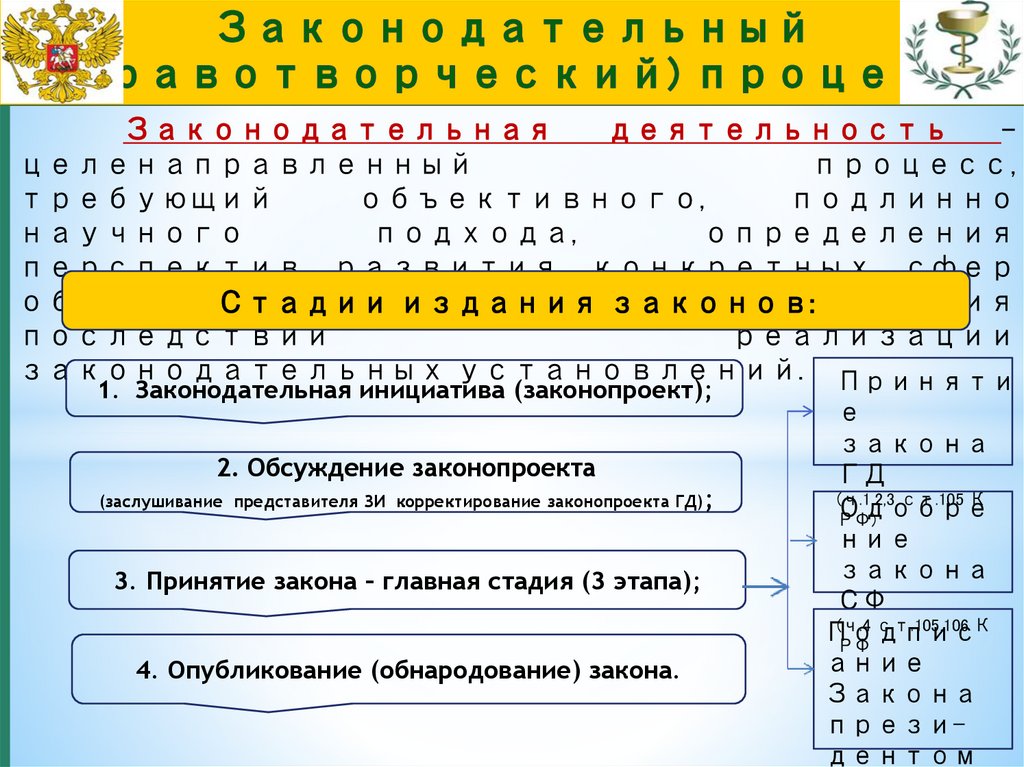


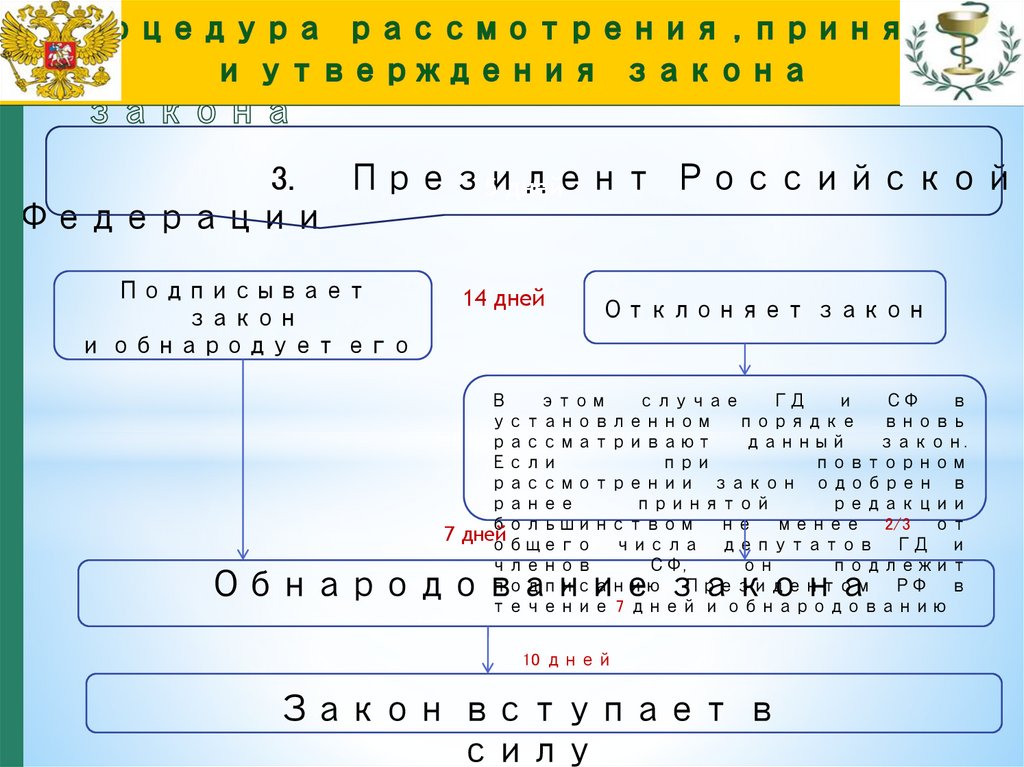

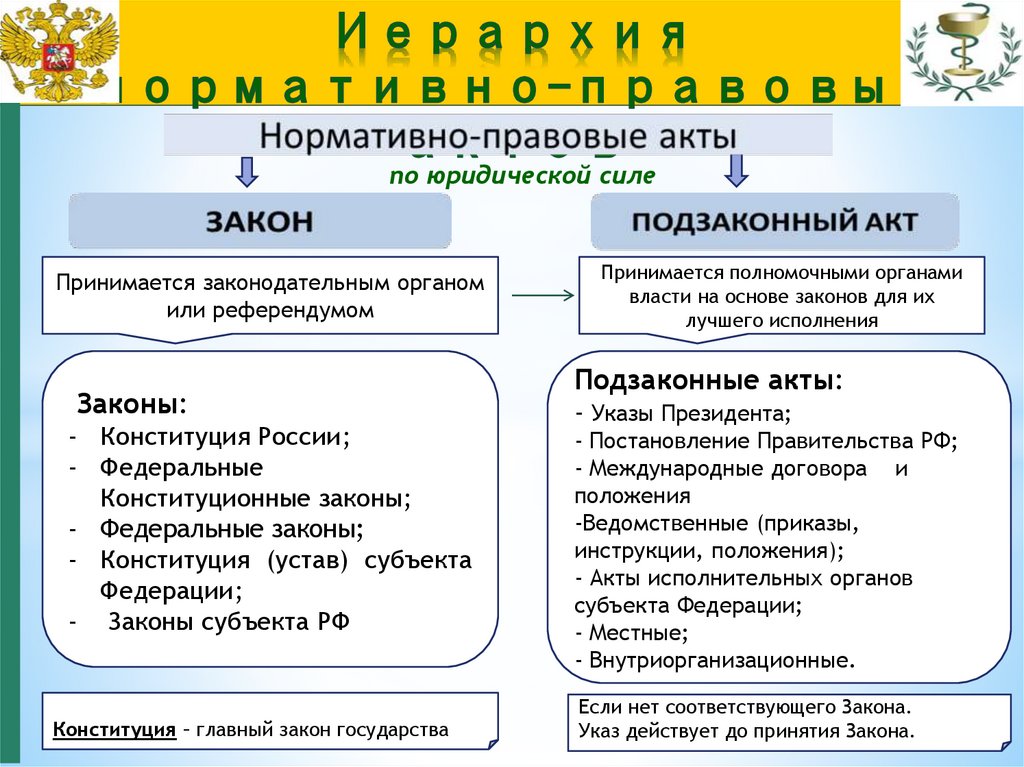
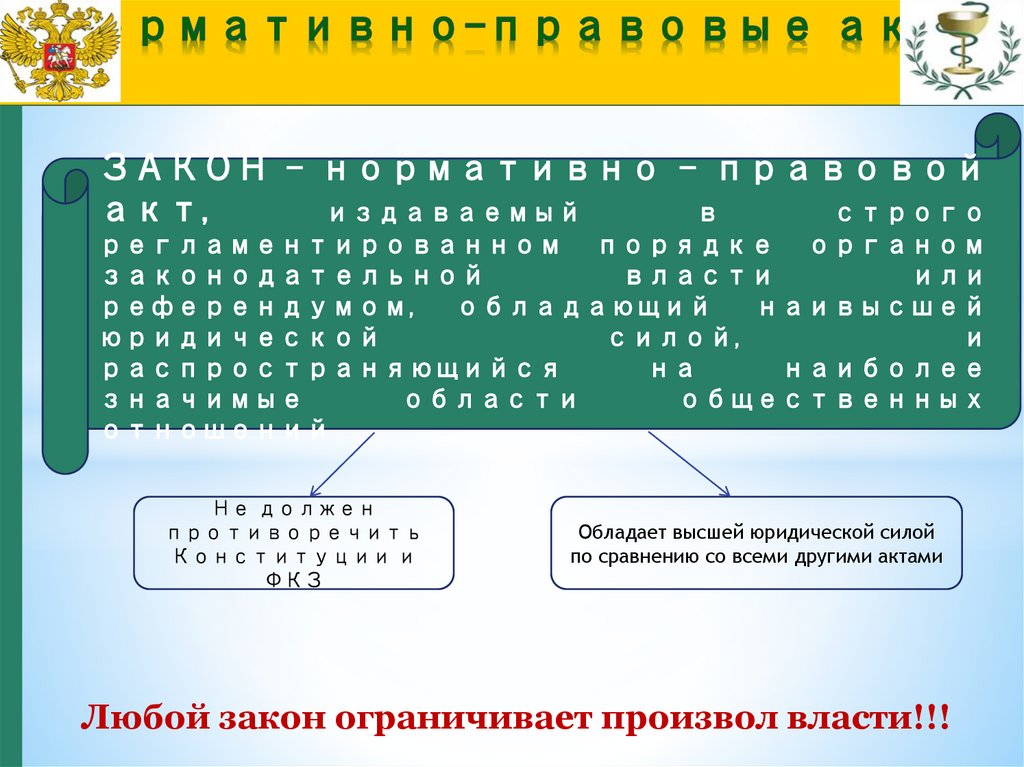

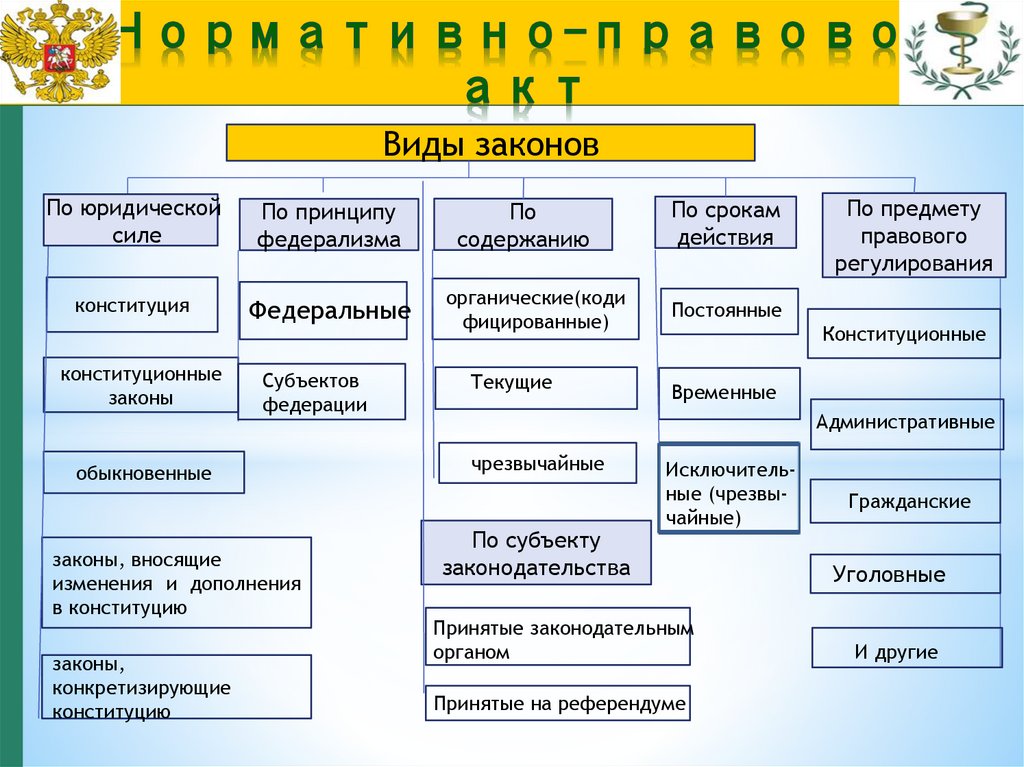

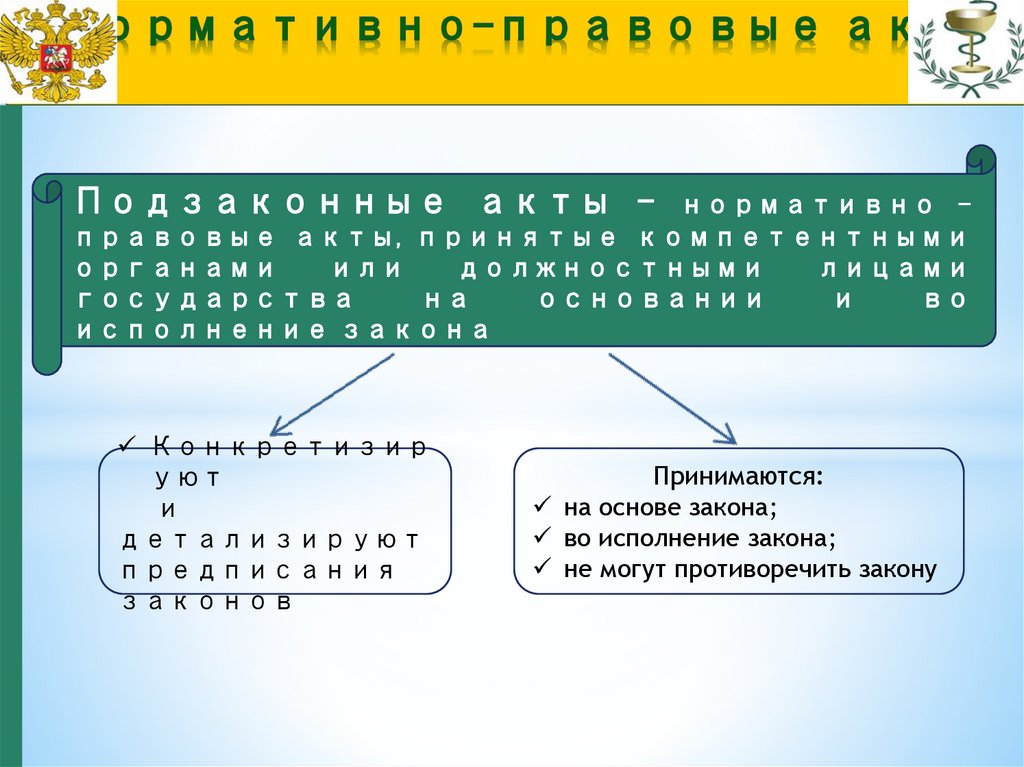








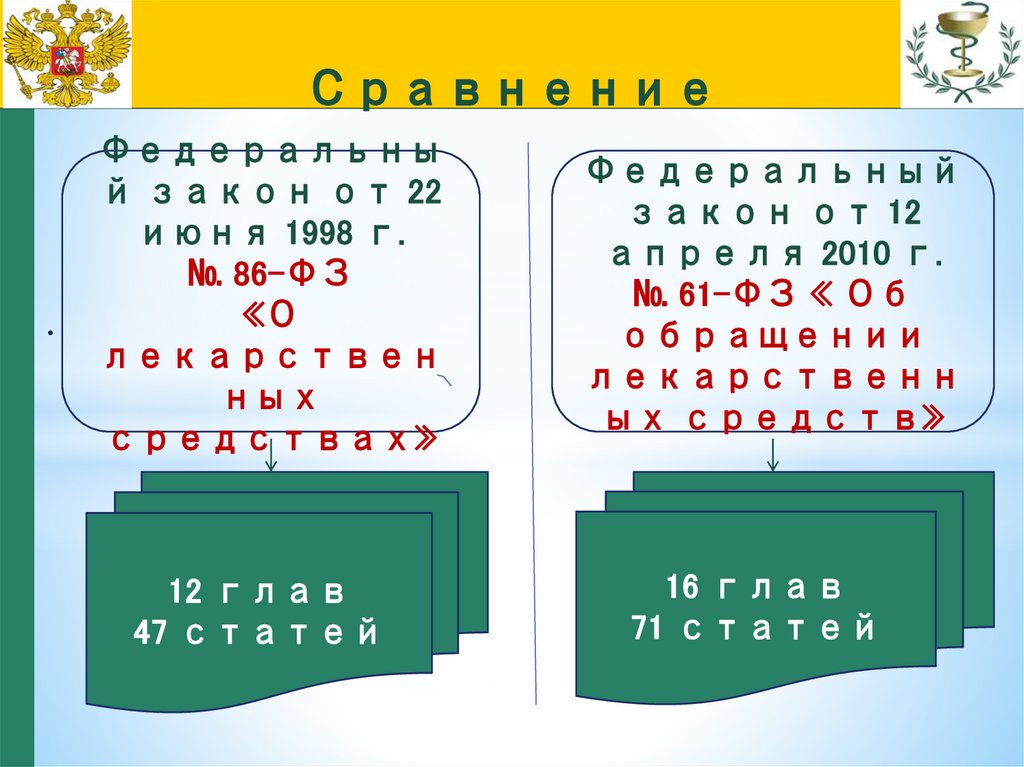








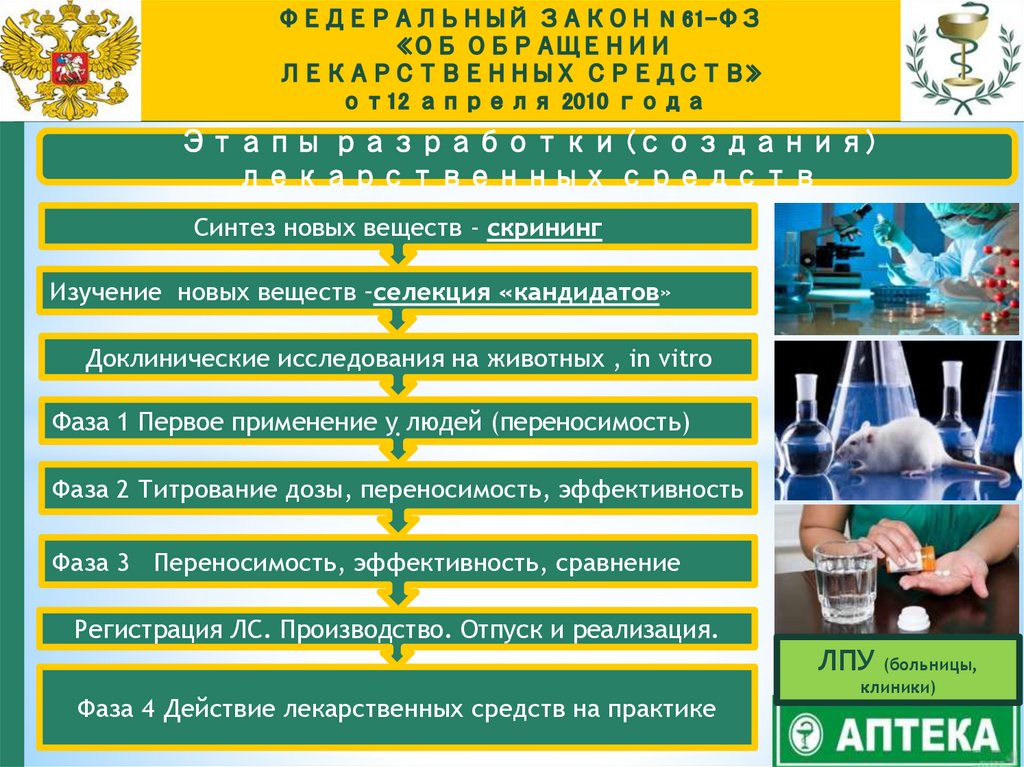



















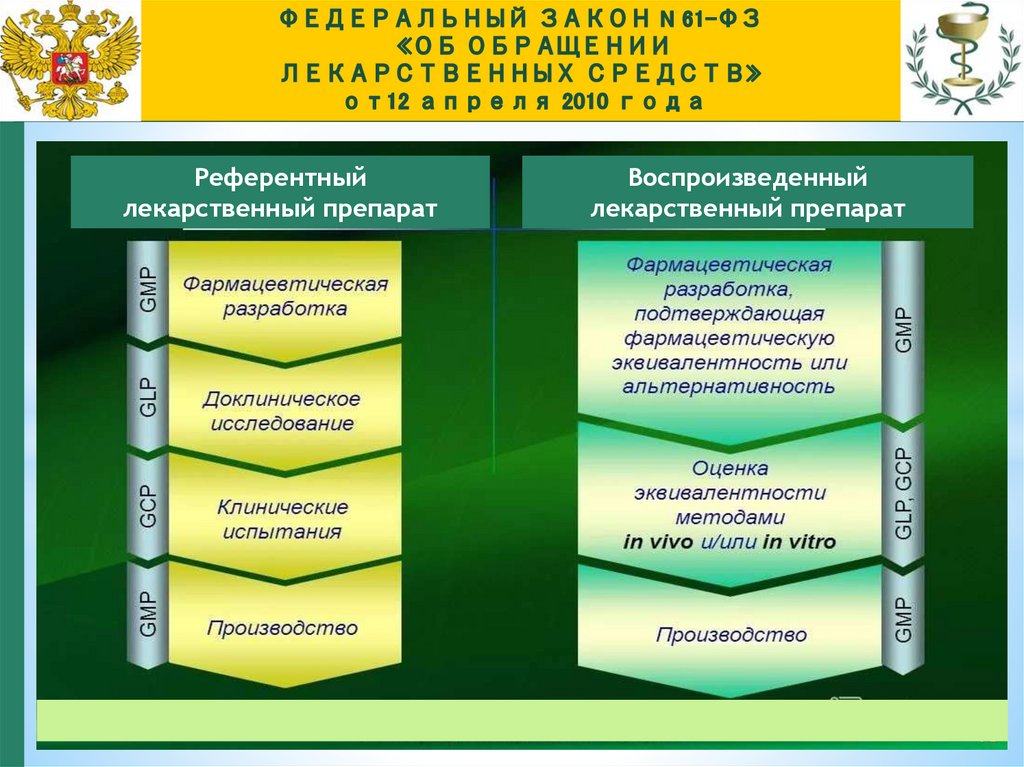





































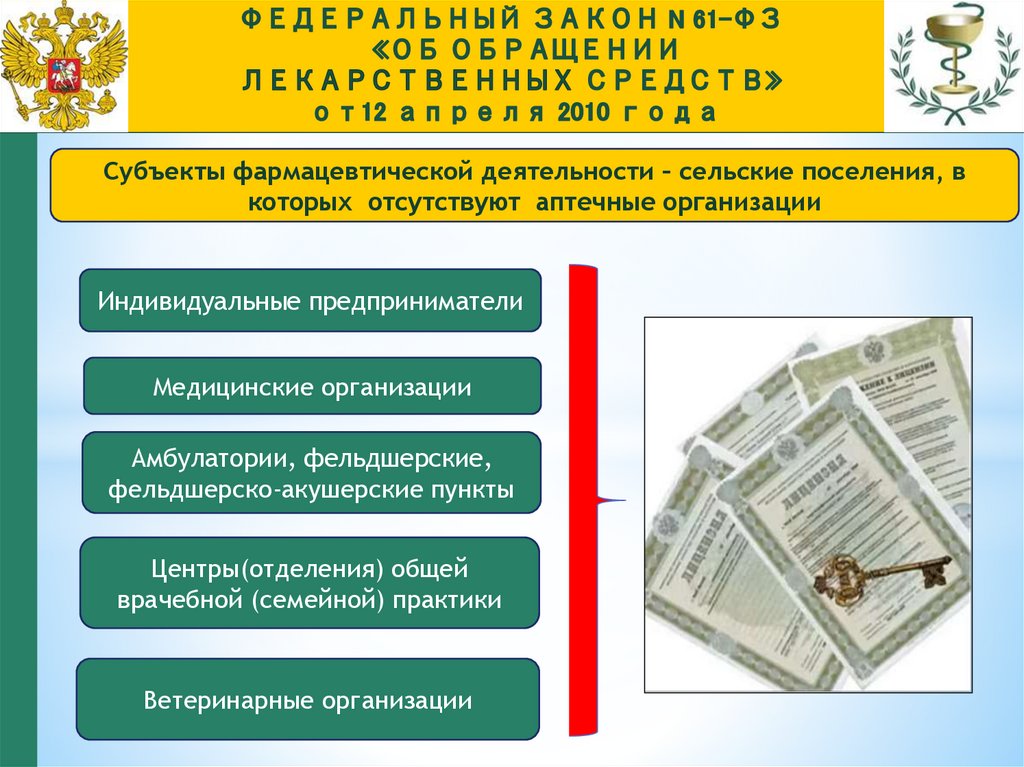











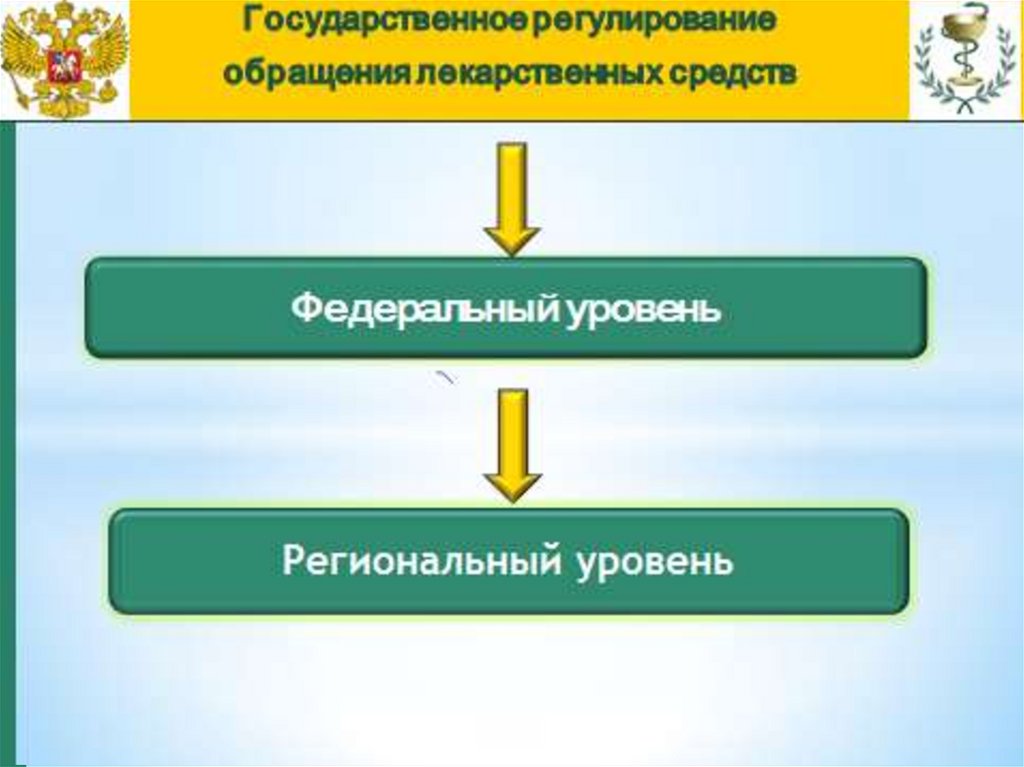
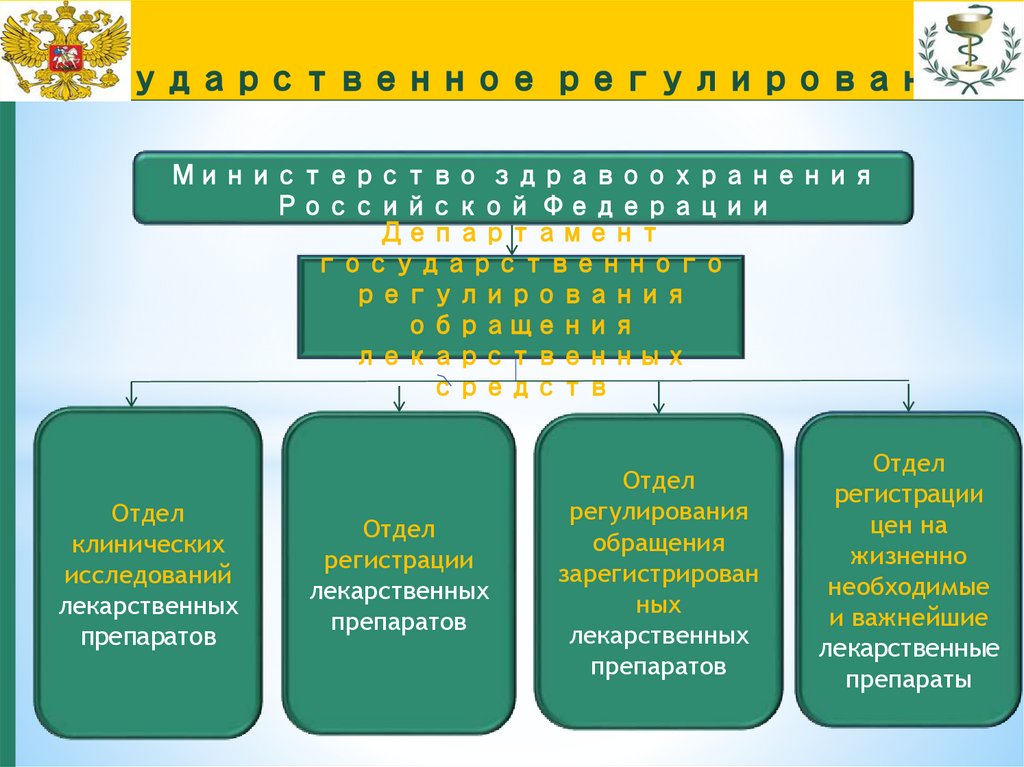
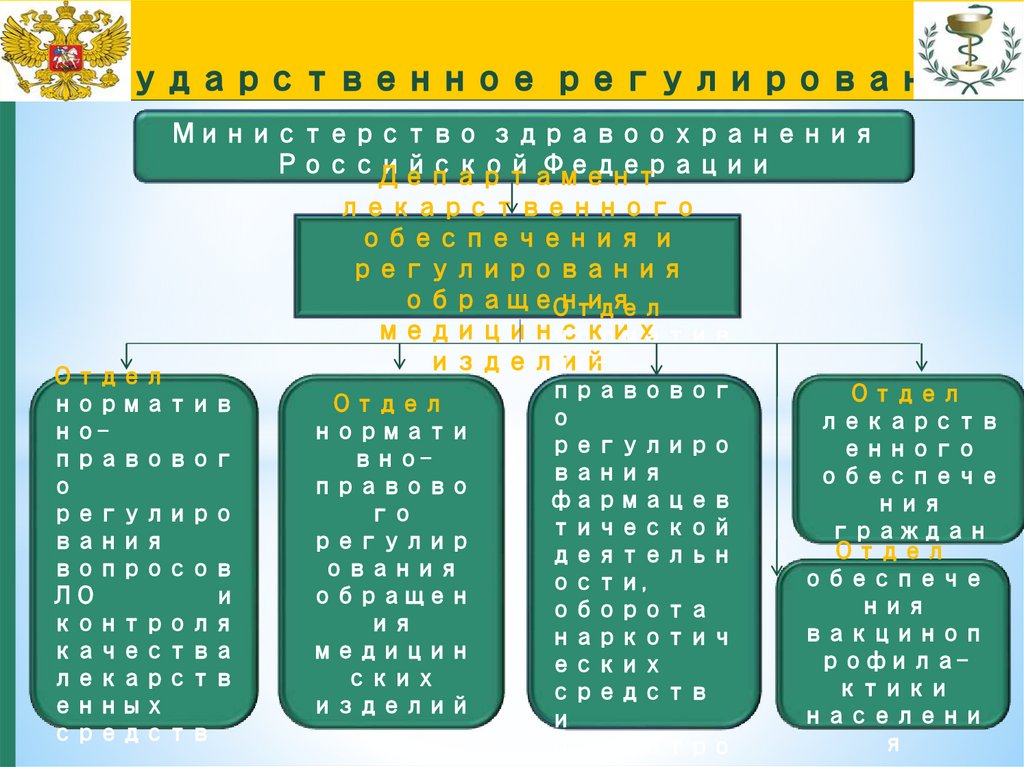



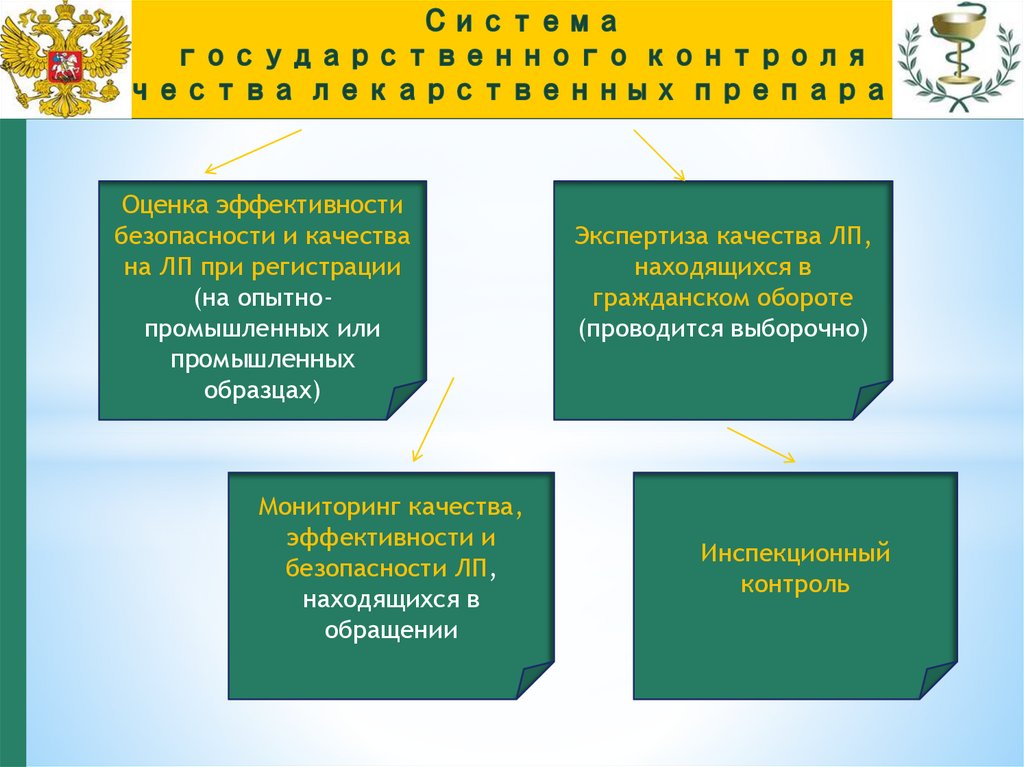

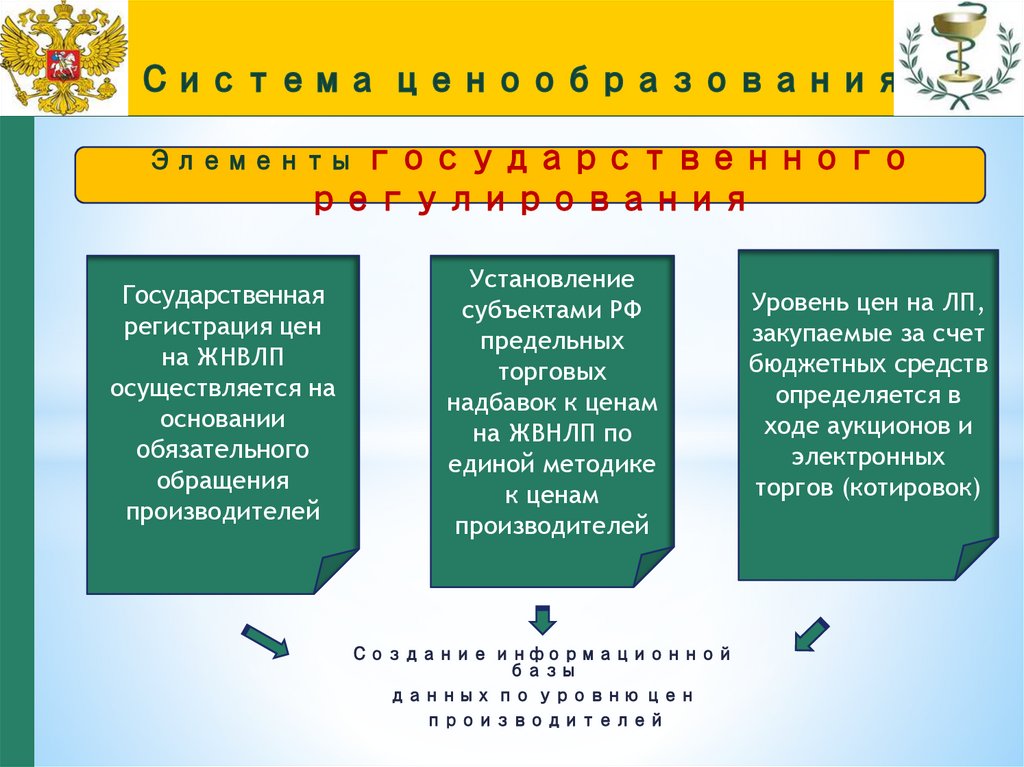

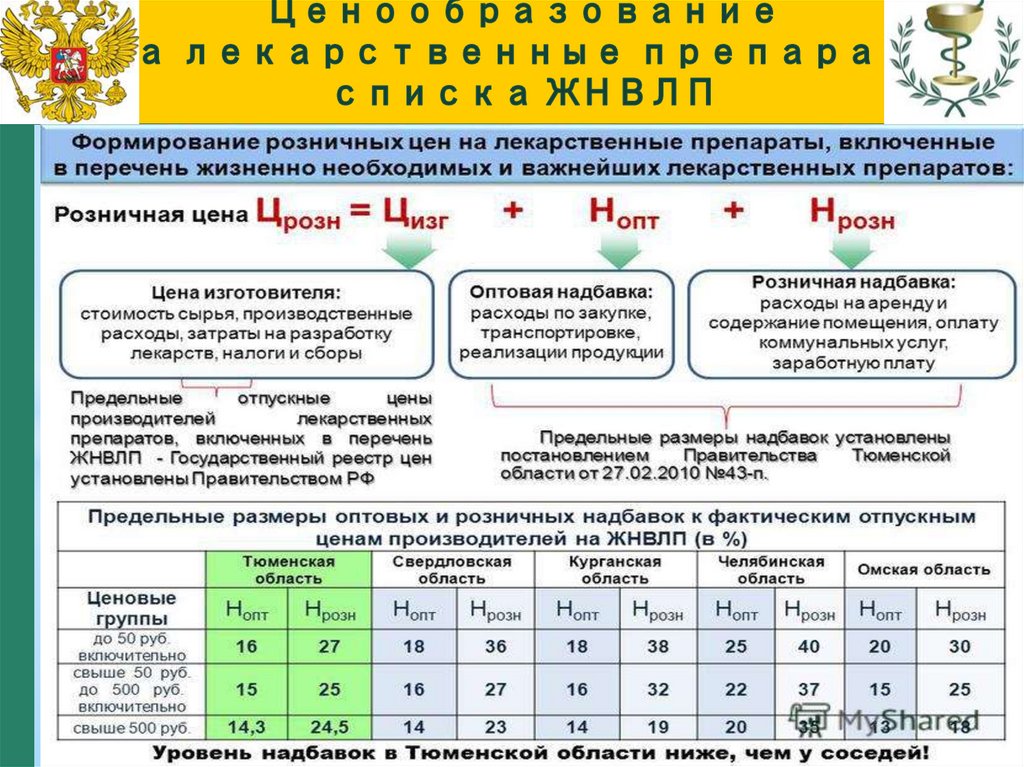
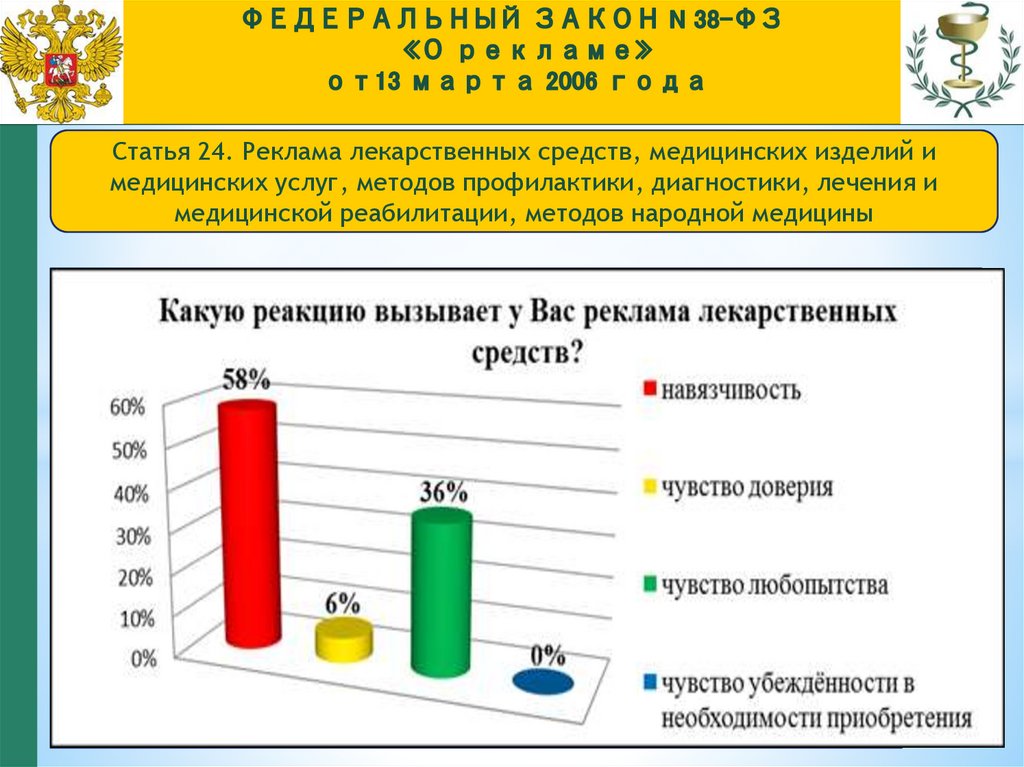

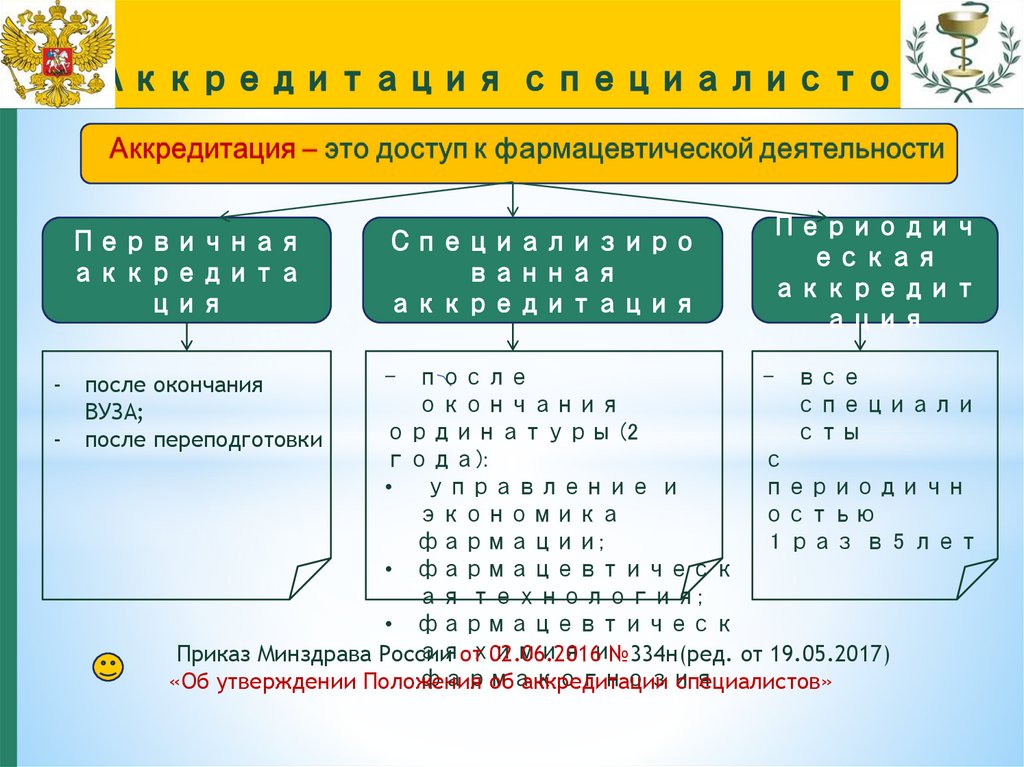

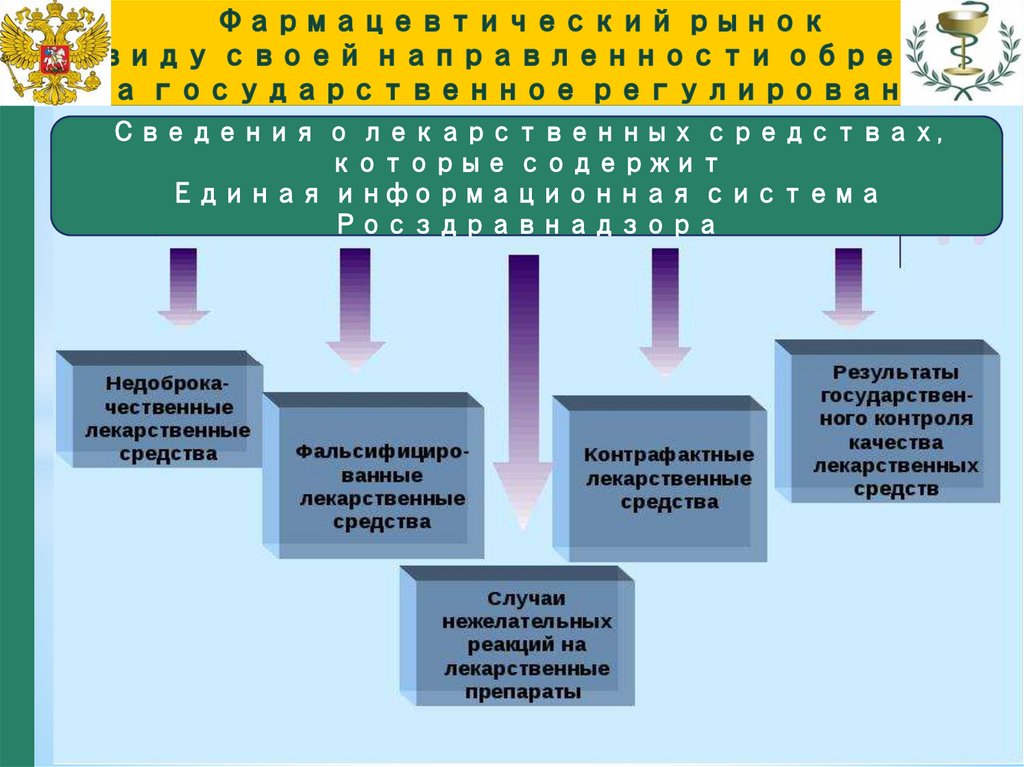























 Медицина
Медицина Право
Право








