Похожие презентации:
Назначение и отпуск лекарственных средств и другого медицинского имущества из аптеки
1. Л Е К Ц И Я по учебной дисциплине: «Управление и экономика фармации» ТЕМА : «Назначение и отпуск лекарственных средств и
ЛЕКЦИЯпо учебной дисциплине:
«Управление и экономика фармации»
ТЕМА : «Назначение и отпуск лекарственных средств и другого
медицинского имущества из аптеки»
Учебные вопросы:
1. Правила назначения и отпуска лекарственных средств.
2. Правила назначения и отпуска медицинских изделий.
3. Правила оформления лекарственных препаратов.
2.
Литература:1. Федеральный закон РФ от 12.04.2010 № 61-ФЗ «Об обращении лекарственных
средств».
2. Федеральный закон от 08.01.1998 № 3-ФЗ «О наркотических средствах и
психотропных веществах».
3. Приказ МЗ РФ от 24 ноября 2021 г. N1094н (действует с 01.03.2022 до 01.03.2028 г.)
«Порядок назначения лекарственных препаратов, форм рецептурных бланков на ЛП,
порядка оформления указанных бланков, их учета и хранения, форм бланков
рецептов, содержащих назначение наркотических средств или психотропных веществ,
порядка их изготовления, распределения, регистрации, учета и хранения, а также
правил оформления бланков рецептов, в том числе в форме электронных
документов». приказ вступает в силу
4. Приказ от 24 ноября 2021 г. N 1093н (действует с 01.03.2022 до 01.03.2028 г.)
«Правила отпуска ЛП для мед. применения аптечными организациями, ИП,
имеющими лицензию на осуществление фармацевтической деятельности, мед.
организациями, имеющими лицензию на осуществление фармацевтической
деятельности, и их обособленными подразделениями (амбулаториями,
фельдшерскими и ФАП, центрами (отделениями) общей врачебной (семейной)
практики), расположенными в сельских поселениях, в которых отсутствуют аптечные
организации, а также правил отпуска НС и ПВ , зарегистрированных в качестве ЛП для
мед. применения, ЛП для мед. применения, содержащих наркотические средства и
психотропные вещества в том числе порядка отпуска аптечными организациями ИЛП».
3.
5. Приказ МЗ РФ 2016 №681н «Перечень должностей фармацевтических и мед.работников в организациях, которым предоставлено право отпуска НЛП и ПЛП ФЛ».
6. Постановление Правительства РФ от 27.12.2012 №1416 «Правила государственной
регистрации медицинских изделий».
7. Постановление Правительства РФ 2011 г. N373 «Административный регламент
предоставления государственной услуги по государственной регистрации МИ».
8. Приказ Минздрава РФ от 16 ноября 2017 г. N 913 «Методические рекомендации по
определению потребности в наркотических средствах и психотропных веществах,
предназначенных для медицинского применения».
9. Методические рекомендации Минздрава РФ от 27.02.18 №25-4/10/1-1221 по
организации оборота НиПЛП для медицинского применения в медицинских и
аптечных организациях.
10. Приказ МЗ РФ 2012 №1181 «Порядок назначения и выписывания медицинских
изделий, а также форм рецептурных бланков на МИ…».
11. Инструкция по содержанию и использованию аптечек первой помощи, шкафов
экстренной и неотложной медицинской помощи в воинских частях и организациях ВС
РФ. ГВМУ МО РФ. 2014.
12. Стандарты операционных процедур (СОПы) «Правила назначения и отпуска
наркотических средств, психотропных веществ и их прекурсоров».
4.
5.
Назначение лекарственных препаратов (ЛП) осуществляется лечащим врачом,фельдшером, акушеркой в случае возложения на них полномочий лечащего врача в
порядке, установленном приказом Минздрава 2012 г. № 252н “Порядок возложения
на фельдшера, акушерку руководителем медицинской организации при
организации оказания первичной медико-санитарной помощи и скорой
медицинской помощи отдельных функций лечащего врача по непосредственному
оказанию медицинской помощи пациенту в период наблюдения за ним и его
лечения, в том числе по назначению и применению лекарственных препаратов,
включая наркотические и психотропные ЛП”, ИП, осуществляющими медицинскую
деятельность.
Сведения о назначенном ЛП (наименование ЛП, дозировка, способ введения и
применения, режим дозирования, продолжительность лечения и обоснование
назначения ЛП) вносятся медицинским работником в мед. документацию пациента.
В случаях, указанных в пунктах 8-11 настоящего Порядка (на рецептурных бланках
ф.ф. N107/у-НП, N107-1/у, N148-1/у-88, N 148-1/у-04(л), медицинский работник
оформляет назначение ЛП, в т.ч. подлежащих изготовлению и отпуску аптечными
организациями, на рецептурном бланке, оформленном на бумажном носителе за
своей подписью, и (или) с согласия пациента или его законного представителя на
рецептурном бланке в форме электронного документа с использованием
усиленной квалифицированной электронной подписи медицинского работника.
Назначение ЛП в рецепте на бумажном носителе или рецепте в форме
электронного документа оформляется на имя пациента, для которого предназначен
лекарственный препарат.
6.
Рецепт в форме электронного документа, содержащий назначение наркотическихсредств или психотропных веществ, подписывается с использованием усиленной
квалифицированной электронной подписи лечащего врача или фельдшера,
акушерки, на которых возложены функции лечащего врача, и соответствующей
медицинской организации.
Оформление рецептов в форме электронных документов осуществляется в случае
принятия уполномоченным органом исполнительной власти субъекта РФ в
соответствии с пунктом 4 статьи 6 ФЗ 2010 г. № 61-ФЗ “Об обращении
лекарственных средств” решения об использовании на территории субъекта РФ
наряду с рецептами на лекарственные препараты, оформленными на бумажном
носителе, рецептов на лекарственные препараты, сформированных в форме
электронных документов.
При выписке пациента из мед. организации, в которой ему оказывалась
медицинская помощь в стационарных условиях, ему по решению руководителя
мед. организации назначаются с оформлением рецепта в форме электронного
документа и (или) на бумажном носителе (за исключением оформления рецептов
на лекарственные препараты, подлежащие отпуску бесплатно или со скидкой) либо
выдаются одновременно с выпиской из истории болезни ЛП, в т.ч. НС, ПВ, списки II
и III перечня НС, ПВ и их прекурсоров, сильнодействующие лекарственные
препараты, на срок приема пациентом до 5 дней.
7.
Назначение ЛП в стационарных условиях в требованиях-накладных,направляемых в аптечные организации, являющиеся структурными
подразделениями медицинской организации, осуществляется в соответствии с
Инструкцией о порядке выписывания лекарственных препаратов и оформления
рецептов и требований-накладных, утвержденной приказом Министерства
здравоохранения и социального развития Российской Федерации от 12 февраля
2007 г. № 110 “О порядке назначения и выписывания лекарственных препаратов,
изделий медицинского назначения и специализированных продуктов лечебного
питания” и приказа Минфина РФ 2015 №52н «Перечень унифицированных форм
первичных учетных документов, применяемых органами государственной власти
(государственными органами), … государственными учреждениями».
Назначение ЛП осуществляется медицинским работником по международному
непатентованному наименованию, а при его отсутствии - группировочному или
химическому (торговому) наименованию.
При наличии медицинских показаний (индивидуальная непереносимость, по
жизненным показаниям) по решению врачебной комиссии медицинской
организации осуществляется назначение и оформление назначения ЛП, не
входящих в стандарты медицинской помощи, разработанных в соответствии с
пунктом 4 статьи 10 Федерального закона от 21.11.2011 № 323-ФЗ “Об основах
охраны здоровья граждан в Российской Федерации”, либо по торговым
наименованиям. Решение врачебной комиссии медицинской организации
фиксируется в мед. документации пациента и в журнале врачебной комиссии.
8.
1. Правила назначения и отпуска лекарственных средств.
Отпуск лекарственных препаратов, в т.ч. наркотических и психотропных
физическим лицам производится только в аптечных организациях либо в
медицинских организациях или обособленных подразделениях
медицинских организаций, расположенных в сельских населенных
пунктах и удаленных от населенных пунктов местностях, в которых
отсутствуют аптечные организации, при наличии у аптечных организаций,
медицинских организаций, их обособленных подразделений лицензии на
указанный вид деятельности. Наркотические средства и психотропные
вещества (НС, ПВ), внесенные в списки II и III, отпускаются в медицинских
целях по рецепту (Ст. 25 Закона о НС, ПВ).
В медицинских целях могут использоваться НС, ПВ, внесенные в списки II
и III и зарегистрированные на территории РФ в порядке, установленном
законодательством об обращении ЛС (Ст. 31 Закона о НС, ПВ).
Не допускается использование НС, ПВ, внесенных в списки II и III,
индивид. предпринимателями, осуществляющими мед. деятельность.
В РФ запрещается лечение наркомании НС, ПВ, внесенными в Список II.
9.
• Использование наркотических средств и психотропныхвеществ воинскими частями и подразделениями
федеральных органов исполнительной власти, в которых
законодательством РФ предусмотрена военная или
правоохранительная служба, при участии в вооруженных
конфликтах, оперативно-боевых мероприятиях,
выполнении боевых и учебно-боевых задач
осуществляется без лицензии в порядке, установленном
соответствующим федеральным органом исполнительной
власти по согласованию с федеральным органом
исполнительной власти по контролю за оборотом
наркотических средств и психотропных веществ (Ст. 36.1.
Закона о НС, ПВ).
• В Российской Федерации запрещается потребление
наркотических средств или психотропных веществ без
назначения врача (Ст. 40 Закона о НС,ПВ).
10.
Отпуск препаратов, содержащих НС, ПВФизическим
лицам
По рецептам
В медицинском
учреждении
По требованиямнакладным
11. Нормативные акты, регламентирующие отпуск НЛС и ПЛС
Ст. 25. Отпуск НС и ПВ физическим лицамСт. 26. Рецепты, содержащие назначение НС или ПВ
Перечень должностей фармацевтических и медицинских
работников в организациях, которым предоставлено право отпуска
НЛП и ПЛП физическим лицам (приказ МЗ РФ 2016 № 681н)
Порядок отпуска и оформление рецептов на НС и ПВ (Приказ МЗ
РФ 2021 № 1093н и N 1094)
12.
Приказ МЗ РФ от 24 ноября 2021 №1094н«ПОРЯДОК НАЗНАЧЕНИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ФОРМ
РЕЦЕПТУРНЫХ БЛАНКОВ НА ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ,
ПОРЯДКА ОФОРМЛЕНИЯ УКАЗАННЫХ БЛАНКОВ, ИХ УЧЕТА И
ХРАНЕНИЯ, ФОРМ БЛАНКОВ РЕЦЕПТОВ, СОДЕРЖАЩИХ
НАЗНАЧЕНИЕ НАРКОТИЧЕСКИХ СРЕДСТВ ИЛИ ПСИХОТРОПНЫХ
ВЕЩЕСТВ, ПОРЯДКА ИХ ИЗГОТОВЛЕНИЯ, РАСПРЕДЕЛЕНИЯ,
РЕГИСТРАЦИИ, УЧЕТА И ХРАНЕНИЯ, А ТАКЖЕ ПРАВИЛ
ОФОРМЛЕНИЯ БЛАНКОВ РЕЦЕПТОВ, В ТОМ ЧИСЛЕ В ФОРМЕ
ЭЛЕКТРОННЫХ ДОКУМЕНТОВ» определяет:
- порядок назначения и выписывания лекарственных
препаратов;
- формы рецептурных бланков;
- порядок оформления рецептурных бланков, их учета и
хранения.
13.
ЛП назначают и выписывают лечащие врачи, фельдшеры,акушерки по международному непатентованному
наименованию. По решению врачебной комиссии ЛП м.б.
выписан по торговому наименованию.
Мед. работникам запрещается выписывать рецепты на ЛП:
- при отсутствии медицинских показаний;
- на ЛП, не зарегистрированные на территории РФ;
- на ЛП, которые в соответствии с инструкцией по мед.
применению используются только в мед. организациях;
- на НС, ПВ, зарегистрированные в качестве ЛП для лечения
наркомании;
- индивидуальными предпринимателями, осуществляющие
медицинскую деятельность, на ЛП, содержащие НС, ПВ,
внесенные в списки II и III Перечня.
14.
НС, ПВ списка II Перечня, кроме ЛП в виде трансдермальныхтерапевтических систем и ЛП, содержащих наркотическое средство в
сочетании с антагонистом опиоидных рецепторов, рецепты на бумажном
носителе выписываются на специальном рецептурном бланке по форме
N107/у-НП «Специальный рецептурный бланк на наркотическое средство
или психотропное вещество». Рецептурные бланки формы N 107/у-НП,
изготовленные до дня вступления в силу настоящего приказа, могут быть
использованы до 1 марта 2023 года.
Рецептурный бланк формы N 148-1/у-88 предназначен для выписывания:
1) НиПЛП списка II Перечня в виде трансдермальных терапевтических систем, НЛП
списка II Перечня, содержащих НС в сочетании с антагонистом опиоидных
рецепторов, психотропных лекарственных препаратов списка III Перечня;
2) лекарственных препаратов, обладающих анаболической активностью;
3) лекарственных препаратов, указанных в пункте 5 Порядка отпуска
физическим лицам ЛП, содержащих кроме малых количеств НС, ПВ и их
прекурсоров другие фармакологические активные вещества.
4) ЛП индивидуального изготовления, содержащих НС, ПВ списка II
Перечня, и другие фармакологические активные вещества в дозе, не
превышающей высшую разовую дозу, и при условии, что этот
комбинированный ЛП не является НС, ПВ списка II Перечня.
5) ЛП, подлежащих предметно-количественному учету, не перечисленных в
подпунктах 1-4 настоящего пункта (за исключением ЛП, отпускаемых без рецепта).
15.
Рецептурный бланк формы N 148-1/у-04 (л) предназначен для выписывания ЛПгражданам, имеющим право на бесплатное получение ЛП или со скидкой.
• Рецептурный бланк формы № 107-1/у оформляется при назначении:
1) лекарственных препаратов, не указанных в пунктах 8,9 настоящего Приказа;
2) комбинированных лекарственных препаратов, содержащих:
а) эрготамина гидротартрат в количестве до 5 мг включительно (на 1 дозу твердой
лекарственной формы);
б) эфедрина гидрохлорид в количестве до 100 мг включительно (на 100 мл или 100 г
жидкой лекарственной формы для внутреннего применения);
в) псевдоэфедрина гидрохлорид в количестве, не превышающем 30 мг (на 1 дозу
твердой лекарственной формы);
г) псевдоэфедрина гидрохлорид в количестве, не превышающем 30 мг, в сочетании с
декстрометорфаном гидробромидом в количестве, превышающем 10 мг, и до 30 мг
включительно (на 1 дозу твердой лекарственной формы);
д) декстрометорфана гидробромид в количестве, превышающем 10 мг, и до 30 мг
включительно (на 1 дозу твердой лекарственной формы);
е) фенобарбитал в количестве, превышающем 20 мг, и до 50 мг включительно (на 1
дозу твердой лекарственной формы);
ж) фенобарбитал в количестве до 20 мг включительно в сочетании с эрготамином
гидротартратом независимо от количества (на 1 дозу твердой лекарственной формы);
з) хлордиазепоксид в количестве до 10 мг включительно (на 1 дозу твердой
лекарственной формы).
16.
При выписывании рецепта на ЛП индивидуального изготовлениянаименования НПЛП списков II и III Перечня, иных ЛП, подлежащих ПКУ,
пишутся в начале рецепта, затем - все остальные ингредиенты.
•При выписывании рецепта запрещается превышать предельно допустимое
количество ЛП для выписывания на один рецепт, установленное
приложением N 1 к настоящему Порядку, за исключением случая,
указанного в п. 15 настоящего Порядка.
•Не рекомендуется превышать рекомендованное количество ЛП для
выписывания на один рецепт, установленное приложением N2 к
настоящему Порядку, за исключением случаев (п.п. 15 и 22 Порядка).
•При выписывании НПЛП списков II и III Перечня, иных ЛП, подлежащих ПКУ,
доза которых превышает высший однократный прием, мед. работник пишет
дозу этого препарата прописью и ставит восклицательный знак.
•Количество выписываемых НПЛП списков II и III Перечня, иных ЛП,
подлежащих ПКУ, при оказании пациентам паллиативной медицинской
помощи может быть увеличено не более чем в 2 раза по сравнению с
предельно допустимым количеством ЛП для выписывания на один рецепт.
17.
• При оказании пациенту медицинской помощи в стационарных условияхназначение ЛП производится медицинским работником единолично, без
выписывания рецепта.
• Согласование назначения ЛП с заведующим отделением или
ответственным дежурным врачом либо другим лицом, уполномоченным
приказом главного врача медицинской организации, а также с врачом клиническим фармакологом необходимо в случаях:
• 1) одновременного назначения пяти и более ЛП одному пациенту;
• 2) назначения лекарственных препаратов, не входящих в перечень
жизненно необходимых и важнейших лекарственных препаратов, <15> при
нетипичном течении заболевания, наличии осложнений основного
заболевания и (или) сопутствующих заболеваний, при назначении ЛП,
особенности взаимодействия и совместимости которых согласно инструкциям
по их применению приводят к снижению эффективности и безопасности
фармакотерапии и (или) создают потенциальную опасность для пациентов.
• <15> Части 1 статьи 60 Федерального закона N 61-ФЗ.
• В указанных случаях назначение ЛП фиксируется в медицинских
документах пациента и заверяется подписью мед. работника и зав. отд.
(ответственного дежурного врача или другого уполномоченного лица).
18.
28. Согласование назначения ЛП с заведующим отделением или ответственным дежурнымврачом либо другим лицом, уполномоченным приказом главного врача медицинской
организации, а также, при наличии, с врачом - клиническим фармакологом необходимо в
случаях:
1) одновременного назначения пяти и более ЛП одному пациенту;
2) назначения лекарственных препаратов, не входящих в перечень ЖНВЛП, при нетипичном
течении заболевания, наличии осложнений основного заболевания и (или) сопутствующих
заболеваний, при назначении ЛП, особенности взаимодействия и совместимости которых
согласно инструкциям по их применению приводят к снижению эффективности и безопасности
фармакотерапии и (или) создают потенциальную опасность для жизни и здоровья пациента.
29. Мед. работник мед. организации, расположенной в сельском населенном пункте или
населенном пункте, расположенном в удаленных и труднодоступных местностях, осуществляет
назначение ЛП в случаях, указанных в пунктах 28 и 30 настоящего Порядка, единолично.
30. По решению врачебной комиссии пациентам при оказании им мед. помощи в
стационарных условиях назначаются ЛП, не включенные в перечень ЖНВП, в случае их замены
из-за индивидуальной непереносимости, по жизненным показаниям.
Решение врачебной комиссии фиксируется в мед. документах пациента и журнале врачебной
комиссии. ФЗ от 08.01.98 г. № 3-ФЗ, статья 26:
1. Рецепты, содержащие назначение НС или ПВ, выписываются на спец. бланках.
2. Форма бланков указанных рецептов, порядок их регистрации, учета и хранения, а также
правила оформления устанавливаются Минздравом РФ по согласованию с ГУНК МВД РФ.
3. Выдача рецептов, содержащих назначение НС или ПВ, без соответствующих медицинских
показаний или с нарушением установленных правил оформления запрещается и влечет
уголовную ответственность в соответствии с законодательством РФ
19. СПЕЦИАЛЬНЫЙ РЕЦЕПТУРНЫЙ БЛАНК НА НАРКОТИЧЕСКОЕ СРЕДСТВО ИЛИ ПСИХОТРОПНОЕ ВЕЩЕСТВО
Форма №107/у-НП,РЕЦЕПТ
Серия__________№________
"__" _______ 20__ г. (дата выписки рецепта)
(взрослый, детский - нужное подчеркнуть)
Ф.И.О. пациента_______________________
Возраст______________________________
Серия и номер полиса обязательного медицинского страхования ___________
Номер медицинской карты амбулаторного больного (истории развития ребенка)
Ф.И.О. врача (фельдшера, акушерки) _____________
Rp: __________________
Подпись и личная печать врача
(подпись фельдшера, акушерки)
М.П.
Ф.И.О. и подпись руководителя (зам руководителя или руководителя структурного
подразделения) медицинской организации ___________________
М.П.
Отметка аптечной организации об отпуске Ф.И.О. и подпись работника аптечной
организации ___________________________
М.П.
Срок действия рецепта 15 дней
20.
Порядок обращения с рецептурными бланками на НС, ПВ:- ЛПУ представляют заявки на рецептурные бланки до 1.10.
- После их получения организуется регистрация, учет и
хранение (отдельно ф. 107/у-НП и формы N 148-1/у-88 ).
- Назначается должностное лицо, отв. за этот участок работы.
- Все операции по движению бланков отражаются в журнале
регистрации и учета рецептурных бланков.
- Запас бланков в ЛПУ не должен превышать 3-х мес.
потребности.
- Комиссия не реже 1 раза в месяц проверяет состояния учета,
хранения и регистрации рецептурных бланков.
21. НС, ПВ, отпускаемых по рецептам врача (Приказы МЗ РФ № 54н от 01.08.12 и № 4н от 19.01.19)
Форма рецептурногобланка
Предназначен для выписывания
Срок действия,
дней
Спецбланк
№107/у-НП
Наркотических или психотропных
веществ, внесенных в список II
Перечня
15
Приказ МЗ РФ
2021 №1094н
Рецептурный бланк
№148-1/у-88
Психотропных веществ, внесенных в
список III Перечня;
Иных ЛП, подлежащих ПКУ;
ЛП, обладающих анаболической
активностью;
ЛП, указанные в п. 5 приказа МЗ РФ
от 17.05.12 №562н;
ЛП индивид. изготовления, содерж.
НС или ПВ Списка II Перечня
15
Приказ МЗ РФ
2021 №1094н
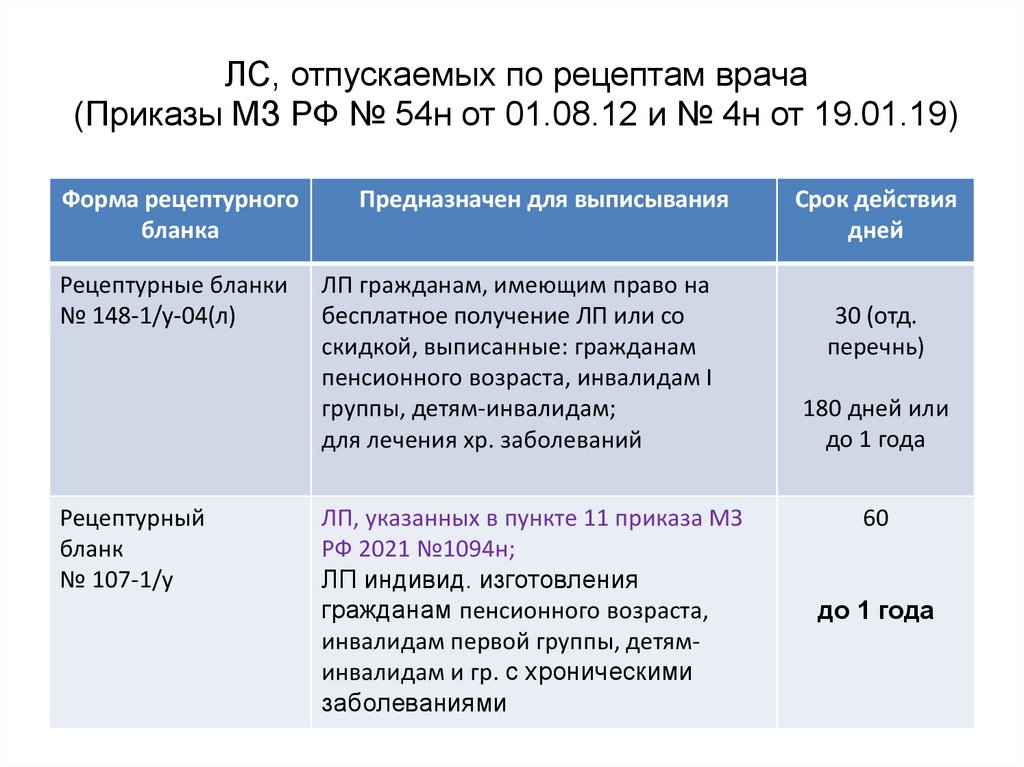
22. ЛС, отпускаемых по рецептам врача (Приказы МЗ РФ № 54н от 01.08.12 и № 4н от 19.01.19)
Форма рецептурногобланка
Предназначен для выписывания
Рецептурные бланки
№ 148-1/у-04(л)
ЛП гражданам, имеющим право на
бесплатное получение ЛП или со
скидкой, выписанные: гражданам
пенсионного возраста, инвалидам I
группы, детям-инвалидам;
для лечения хр. заболеваний
Рецептурный
бланк
№ 107-1/у
ЛП, указанных в пункте 11 приказа МЗ
РФ 2021 №1094н;
ЛП индивид. изготовления
гражданам пенсионного возраста,
инвалидам первой группы, детяминвалидам и гр. с хроническими
заболеваниями
Срок действия
дней
30 (отд.
перечнь)
180 дней или
до 1 года
60
до 1 года
23.
При выписывании медицинским работником рецептов на готовыелекарственные препараты и ЛП индивидуального изготовления пациентам с
хроническими заболеваниями на рецептурных бланках формы N 107-1/у
разрешается устанавливать срок действия рецепта в пределах до одного
года и превышать рекомендуемое количество ЛП для выписывания на один
рецепт, установленное приложением N 2 к настоящему Порядку.
При выписывании таких рецептов медицинский работник делает пометку
"Пациенту с хроническим заболеванием", указывает срок действия рецепта и
периодичность отпуска ЛП из аптечной организации или индивидуальным
предпринимателем, имеющим лицензию на фармацевтическую деятельность
(еженедельно, ежемесячно и иные периоды), заверяет это указание своей
подписью и личной печатью, а также печатью медицинской организации "Для
рецептов".
Рецепты на производные барбитуровой кислоты, эфедрин,
псевдоэфедрин в чистом виде и в смеси с другими лекарственными
средствами, лекарственные препараты, обладающие анаболической
активностью, комбинированные лекарственные препараты,
содержащие кодеин (его соли), для лечения пациентов с хроническими
заболеваниями могут выписываться на курс лечения до двух месяцев.
В этих случаях на рецептах производится надпись "По специальному
назначению", отдельно скрепленная подписью медицинского работника и
печатью медицинской организации "Для рецептов".
24.
Назначение и выписывание ЛП по решению врачебной комиссии приоказании первичной медико-санитарной помощи, паллиативной мед.
помощи в амбулаторных условиях производится в случаях:
1) одновременного назначения одному пациенту пяти и более
лекарственных препаратов в течение одних суток или свыше десяти
наименований в течение одного месяца;
2) назначения ЛП при нетипичном течении заболевания, наличии
осложнений основного заболевания и (или) сопутствующих заболеваний,
при назначении ЛП, особенности взаимодействия и совместимости
которых согласно инструкциям по их применению приводят к снижению
эффективности и безопасности фармакотерапии и (или) создают
потенциальную опасность для жизни и здоровья пациента;
3) первичного назначения пациенту наркотических и психотропных
лекарственных препаратов списков II и III Перечня (в случае принятия
руководителем медицинской организации решения о необходимости
согласования назначения таких ЛП с врачебной комиссией).
(пп. 3 в ред. Приказа Минздрава России от 30.06.2015 N 386н)
25.
Назначение и выписывание наркотических и психотропныхлекарственных препаратов списков II и III Перечня производится
пациентам с выраженным болевым синдромом любого генеза, а также
пациентам с нарушением сна, судорожными состояниями, тревожными
расстройствами, фобиями, психомоторным возбуждением
самостоятельно медицинским работником либо медицинским
работником по решению врачебной комиссии (в случае принятия
руководителем медицинской организации решения о необходимости
согласования первичного назначения таких лекарственных препаратов
с врачебной комиссией).
(п. 32 в ред. Приказа Минздрава России от 30.06.2015 N 386н)
При оказании скорой медицинской помощи лекарственные препараты
назначаются медицинским работником выездной бригады скорой
помощи, медицинским работником медицинской организации при
оказании медицинской помощи гражданам при заболеваниях,
несчастных случаях, травмах, отравлениях и других состояниях,
требующих срочного медицинского вмешательства.
26.
Назначение и выписывание ЛП гражданам, имеющим право на бесплатноеполучение ЛП или получение ЛП со скидкой, при оказании им первичной
медико-санитарной помощи осуществляется мед. работником в случаях
типичного течения заболевания пациента исходя из тяжести и характера
заболевания согласно утвержденным в установленном порядке
стандартам мед. помощи, в т.ч.:
1) отдельным категориям граждан, имеющим право на получение
государственной социальной помощи в виде набора социальных услуг, в
соответствии с перечнем ЛП для медицинского применения, в том числе
назначаемых по решению врачебных комиссий мед. организаций <6>;
гражданам, страдающим злокачественными новообразованиями
лимфоидной, кроветворной и родственных им тканей, гемофилией,
муковисцидозом, гипофизарным нанизмом, болезнью Гоше, рассеянным
склерозом (7 нозоологий), а также гражданам после трансплантации
органов и (или) тканей, в соответствии с перечнем централизованно
закупаемых за счет средств федерального бюджета лекарственных
препаратов, утверждаемым Правительством РФ:
27.
гражданам, имеющим право на получение лекарственных препаратовбесплатно или получение лекарственных препаратов со скидкой за счет
средств бюджетов субъектов Российской Федерации, в соответствии с
Перечнем групп населения и категорий заболеваний, при амбулаторном
лечении которых лекарственные средства и изделия медицинского
назначения отпускаются по рецептам врачей бесплатно, и Перечнем групп
населения, при амбулаторном лечении которых лекарственные средства
отпускаются по рецептам врачей с 50-процентной скидкой, утвержденными
постановлением Правительства РФ от 30 июля 1994 г. N 890;
гражданам, страдающим жизнеугрожающими и хроническими
прогрессирующими редкими (орфанными) заболеваниями, приводящими к
сокращению продолжительности жизни граждан и их инвалидности;
Постановление Правительства Российской Федерации от 26 апреля 2012 г.
N 403 "О порядке ведения Федерального регистра лиц, страдающих
жизнеугрожающими и хроническими прогрессирующими редкими
(орфанными) заболеваниями, приводящими к сокращению
продолжительности жизни граждан и их инвалидности, и его регионального
сегмента"
28.
Право выписывать рецепты на ЛП гражданам, имеющим право набесплатное получение ЛП или получение ЛП со скидкой, также имеют:
1) медицинские работники, работающие в медицинской организации по
совместительству (в пределах своей компетенции);
2) медицинские работники стационарных учреждений социального
обслуживания и исправительных учреждений (независимо от ведомственной
принадлежности);
3) медицинские работники медицинских организаций, оказывающих
медицинскую помощь в стационарных условиях, в случае, предусмотренном
п. 29 настоящего Порядка;
4) медицинские работники медицинских организаций, оказывающих
первичную медико-санитарную помощь, подведомственных ФОИВ или
органам исполнительной власти субъектов Российской Федерации:
а) гражданам, расходы на бесплатное лекарственное обеспечение которых в
соответствии с законодательством РФ покрываются за счет средств
федерального бюджета;
б) иным категориям граждан, расходы на бесплатное лекарственное
обеспечение которых в соответствии с законодательством Российской
Федерации покрываются за счет средств бюджетов различных уровней и
обязательного медицинского страхования;
5) индивидуальные предприниматели, занимающиеся частной медицинской
практикой и включенные в реестр медицинских организаций,
осуществляющих деятельность в сфере обязательного мед. страхования.
29.
Не допускается выписывание рецептов на лекарственные препараты длялечения граждан, имеющих право на бесплатное получение лекарственных
препаратов или получение лекарственных препаратов со скидкой,
медицинскими работниками санаторно-курортных организаций,
медицинскими работниками медицинских организаций, оказывающих
медицинскую помощь стационарно или в условиях дневного стационара, за
исключением случая, предусмотренного пунктом 29 настоящего Порядка.
При выписывании рецептов на лекарственные препараты для лечения
граждан, имеющих право на бесплатное получение лекарственных
препаратов или получение лекарственных препаратов со скидкой,
указывается номер телефона, по которому работник аптечной организации
при необходимости может согласовать с медицинским работником
синонимическую замену лекарственного препарата.
На рецептурном бланке формы N 148-1/у-04(л) рецепт выписывается
медицинским работником в двух экземплярах, с одним экземпляром которого
пациент обращается в аптечную организацию. Второй экземпляр рецепта
приобщается к медицинской карте пациента.
30.
Наркотические и психотропные лекарственные препараты списка II Перечнядля лечения граждан, имеющих право на бесплатное получение
лекарственных препаратов или получения лекарственных препаратов со
скидкой, выписываются на специальном рецептурном бланке на
наркотическое средство и психотропное вещество, к которому
дополнительно выписываются рецепты в двух экземплярах на рецептурном
бланке формы N 148-1/у-04 (л). (в ред. Приказа Минздрава России от
30.06.2015 N 386н)
Психотропные лекарственные препараты списка III Перечня, иные
лекарственные средства, подлежащие предметно-количественному учету,
лекарственные препараты, обладающие анаболической активностью,
комбинированные лекарственные препараты, указанные в подпункте 4
пункта 9 настоящего порядка, предназначенные для лечения граждан,
имеющих право на бесплатное получение лекарственных препаратов или
получение лекарственных препаратов со скидкой, выписываются на
рецептурном бланке N 148-1/у-88, к которому дополнительно выписываются
рецепты в двух экземплярах на рецептурном бланке формы N 148-1/у-04 л).
31. Запрещается выписывать рецепты:
на лекарственные препараты, не разрешенные вустановленном порядке к медицинскому применению;
при отсутствии медицинских показаний;
на лекарственные препараты, используемые только в
медицинских организациях (эфир наркозный, хлорэтил,
фентанил (кроме трансдермальной лекарственной
формы), сомбревин, калипсол, фторотан, кетамин и др.);
на наркотические средства и психотропные вещества,
внесенные в Список II - для лечения наркомании;
на наркотические средства и психотропные вещества
списков II и III - частнопрактикующим врачам.
32. Статья 5 ФЗ от 08.01.98 г. № 3-ФЗ
5. В отношении препаратов, которые содержат малые количестванаркотических средств, психотропных веществ и их прекурсоров,
внесенных в списки II, III или IV, и поэтому не представляют
опасности в случае злоупотребления ими или представляют
незначительную опасность и из которых указанные средства или
вещества не извлекаются легкодоступными способами, могут
исключаться некоторые меры контроля, установленные настоящим
Федеральным законом.
Порядок применения мер контроля в отношении указанных
препаратов устанавливается Правительством Российской
Федерации.
6. Федеральный орган исполнительной власти в области
здравоохранения устанавливает предельно допустимое количество
наркотических средств, психотропных веществ и их прекурсоров,
содержащихся в препаратах, указанных в пункте 5 настоящей
статьи.
33.
• Отпуску подлежат комбинированные лекарственныепрепараты, содержащие наркотические средства,
психотропные вещества и их прекурсоры в количестве, не
превышающем предельно допустимое количество
наркотического средства, психотропного вещества и их
прекурсора, содержащегося в препаратах, которые
содержат малые количества наркотических средств,
психотропных веществ и их прекурсоров, внесенных в
списки II, III и IV Перечня наркотических средств,
психотропных веществ и их прекурсоров, подлежащих
контролю в РФ.
• Комбинированные лекарственные препараты, указанные
в пунктах 4 и 5 настоящего Порядка, отпускаются из аптек
и аптечных пунктов по рецептам, выписанным на
рецептурных бланках формы N 107-1/у и формы N 1481/у-88
34.
Приказом Минздрава РФ 2016 №681н определен Перечень должностейфармацевтических и медицинских работников в организациях, которым
предоставлено право отпуска наркотических лекарственных препаратов и
психотропных лекарственных препаратов физическим лицам.
1. Должности фармацевтических работников:
директор (заведующий, начальник) аптечной организации;
заместитель директора (заведующего, начальника) аптечной организации;
заведующий (начальник) структурного подразделения (отдела) аптечной
организации;
провизор;
провизор-технолог; старший провизор; старший фармацевт; фармацевт.
2. Должности медицинских работников:
врач-специалист;
главная медицинская сестра (главная акушерка, главный фельдшер);
акушер;
заведующий здравпунктом - фельдшер (медицинская сестра); заведующий
фельдшерско-акушерским пунктом - фельдшер (акушер, медицинская
сестра); медицинская сестра;
медицинская сестра врача общей практики (семейного врача); старшая
медицинская сестра (акушер, фельдшер); фельдшер.
35.
Регистрация операций с НС и ПВПри осуществлении деятельности, связанной с оборотом НС и ПВ, любые
операции, в результате которых изменяются их количество и состояние, подлежат
регистрации в специальных журналах лицами, на которых эта обязанность
возложена приказом руководителя ЮЛ.
Порядок ведения и хранения указанных журналов устанавливается
Правительством РФ (ФЗ № 3-ФЗ 1998, статья 39).
Лицензионное требование:
с) соблюдение лицензиатом, осуществляющим деятельность по обороту
НС и ПВ, внесенных в списки I - III перечня, требований статьи 37 ФЗ "О
наркотических средствах и психотропных веществах" и порядка
представления отчетов о деятельности, связанной с их оборотом,
установленного ПП РФ от 4 ноября 2006 г. N 644;
т) соблюдение лицензиатом, осуществляющим деятельность по обороту
НС и ПВ, внесенных в списки I - III перечня, требований статьи 39 ФЗ № 3ФЗ 1998 и порядка ведения и хранения специальных журналов
регистрации операций, связанных с их оборотом, установленного ПП РФ
от 4 ноября 2006 г. N644.
36.
Что запрещено в деятельности, связанной с НС и ПВ (ФЗ № 3-ФЗ 1998).Хранение НС и ПВ в любых количествах в целях, не предусмотренных
законом «О НС и ПВ», Ст.20, п.2
Аптечным орг-циям и учр. здравоохранения отпускать НС и ПВ, внесенные в
Список II, по рецепту, выписанному более 15-ти дней назад, Ст.25, п.6
Выдача рецептов, содержащих назначение НС или ПВ, без соотв. мед.
показаний или с нарушением установленных правил оформления, Ст.26, п. 3
Лечение наркомании НС и ПВ, Ст.31, п.6
Приватизация и передача в доверительное управление учреждений
государственной и муниципальной систем здравоохранения,
оказывающих наркологическую помощь, Ст. 55, п.3
Пропаганда преимуществ использования отдельных НС, ПВ, их аналогов и
прекурсоров, а равно пропаганда использования в медицинских целях НС, ПВ,
подавляющих волю человека либо отрицательно влияющих на состояние его
психического или Физического здоровья, Ст. 46, п.2
Распространение образцов лекарственных средств, содержащих НС
или ПВ, Ст. 46, п. 3.
Лечебно-профилактические учреждения (ЛПУ), не имеющие своих аптек,
должны получать НС и ПВ только в виде готовых лекарственных форм,
изготовленных промышленным предприятием или аптекой.
Ответственными за хранение и выдачу больным НС являются руководитель
ЛПУ или его заместители, а также лица, уполномоченные на это приказом по
учреждению.
37.
2. Правила назначения и отпуска медицинских изделий.Правила (Приказ МЗ РФ 2012 №1181) устанавливают порядок государственной
регистрации медицинских изделий (МИ), подлежащих обращению в РФ.
Государственной регистрации подлежат любые инструменты, аппараты, приборы,
оборудование, материалы и прочие изделия, применяемые в медицинских целях
отдельно или в сочетании между собой, а также вместе с другими
принадлежностями, необходимыми для применения указанных изделий по
назначению, включая специальное программное обеспечение, и предназначенные
производителем для профилактики, диагностики, лечения и медицинской
реабилитации заболеваний, мониторинга состояния организма человека,
проведения медицинских исследований, восстановления, замещения, изменения
анатомической структуры или физиологических функций организма,
предотвращения или прерывания беременности, функциональное назначение
которых не реализуется путем фармакологического, иммунологического,
генетического или метаболического воздействия на организм человека.
Медицинские изделия, изготовленные по индивидуальным заказам пациентов, к
которым предъявляются специальные требования по назначению медицинских
работников и которые предназначены исключительно для личного использования
конкретным пациентом, государственной регистрации не подлежат.
Государственная регистрация МИ осуществляется Федеральной службой по надзору
в сфере здравоохранения (Росздравнадзором).
38.
Государственная регистрация медицинских изделий проводится на основаниирезультатов технических испытаний, токсикологических исследований, клинических
испытаний, представляющих собой формы оценки соответствия медицинских
изделий с учетом классификации в зависимости от потенциального риска их
применения, и экспертизы качества, эффективности и безопасности медицинских
изделий, а также испытаний в целях утверждения типа средств измерений (в
отношении медицинских изделий, относящихся к средствам измерений в сфере
государственного регулирования обеспечения единства измерений, перечень
которых утверждается Министерством здравоохранения Российской Федерации).
Документом, подтверждающим факт государственной регистрации медицинского
изделия, является регистрационное удостоверение на МИ. Форма
регистрационного удостоверения утверждается регистрирующим органом.
Регистрационное удостоверение выдается бессрочно. Государственная пошлина
уплачивается в соответствии с законодательством РФ о налогах и сборах.
Для государственной регистрации МИ разработчик, производитель МИ или
представитель производителя (далее - заявитель) представляет либо направляет в
регистрирующий орган заявление о государственной регистрации медицинского
изделия, а также документы, указанные в пункте 10 настоящих Правил.
39.
В заявлении о государственной регистрации медицинского изделияуказываются следующие сведения:
а) наименование МИ (с указанием принадлежностей, необходимых для
применения МИ по назначению);
б) в отношении разработчика, производителя МИ, ЮЛ, на имя которого
может быть выдано регистрационное удостоверение - полное и
сокращенное наименование, в т.ч. фирменное наименование,
организационно-правовая форма юридического лица, адрес, а также
номера телефонов и адрес электронной почты;
в) место производства медицинского изделия;
г) назначение медицинского изделия, установленное производителем;
з) вид медицинского изделия в соответствии с номенклатурной
классификацией медицинских изделий;
д) класс потенциального риска применения медицинского изделия в
соответствии с номенклатурной классификацией медицинских изделий;
е) код Общероссийского классификатора продукции для медицинского
изделия;
ж) сведения о способе получения регистрационного удостоверения, а также
информации, связанной с процедурой государственной регистрации МИ.
40.
Для государственной регистрации медицинского изделия представляютсяследующие документы:
а) копия документа, подтверждающего полномочия уполномоченного
представителя производителя;
б) сведения о нормативной документации на медицинское изделие;
в) техническая документация на медицинское изделие;
г) эксплуатационная документация на МИ, в т.ч. инструкция по применению
или руководство по эксплуатации МИ;
д) фотографическое изображение общего вида МИ вместе с
принадлежностями, необходимыми для применения МИ по назначению
(размером не менее 18 x 24 сантиметра);
е) документы технических испытаний медицинского изделия;
ж) документы токсикологических исследований МИ, использование
которого предполагает наличие контакта с организмом человека;
з) документы испытаний медицинского изделия в целях утверждения типа
средств измерений (в отношении МИ, относящихся к средствам измерений в
сфере государственного регулирования обеспечения единства измерений,
перечень которых утверждается Минздрава РФ);
и) опись документов.
Если оригиналы документов составлены на иностранном языке, они
представляются с заверенным переводом на русский язык.
41.
Сроки и последовательность административных процедур регистрирующего органаустанавливаются постановлением Правительства РФ от 16 мая 2011 г. N373
«Административным регламентом предоставления государственной услуги по
государственной регистрации медицинских изделий».
В течение 3 рабочих дней со дня принятия решения о начале государственной
регистрации МИ регистрирующий орган оформляет и выдает задание на
проведение экспертизы качества, эффективности и безопасности МИ федеральному
государственному бюджетному учреждению, находящемуся в ведении
регистрирующего органа (далее - экспертное учреждение).
Экспертиза качества, эффективности и безопасности МИ проводится экспертным
учреждением поэтапно в соответствии с порядком, утверждаемым Минздравом РФ:
а) на I этапе осуществляется экспертиза заявления о регистрации и документов,
указанных в пункте 10 Правил, для определения возможности (невозможности)
проведения клинических испытаний медицинского изделия;
б) на II этапе осуществляется экспертиза полноты и результатов проведенных
технических испытаний, токсикологических исследований, клинических испытаний,
а также испытаний в целях утверждения типа средств измерений (в отношении
медицинских изделий, относящихся к средствам измерений в сфере
государственного регулирования обеспечения единства измерений, перечень
которых утверждается Министерством здравоохранения Российской Федерации)
(далее - экспертиза полноты и результатов испытаний и исследований).
которого утверждается Министерством здравоохранения Российской Федерации.
42.
На I этапе экспертизы качества, эффективности и безопасности медицинскогоизделия экспертное учреждение в срок, не превышающий 20 рабочих дней со дня
получения задания, осуществляет следующие мероприятия:
а) проведение экспертизы заявления о регистрации и документов,
предусмотренных пунктом 10 Правил, для определения возможности
(невозможности) проведения клинических испытаний медицинского изделия;
б) оформление и направление в регистрирующий орган заключения о возможности
(невозможности) проведения клинических испытаний медицинского изделия (с
указанием причин и обоснованием невозможности их проведения), форма
которого утверждается Минздравом РФ.
Основанием для вынесения экспертным учреждением заключения о
невозможности проведения клинических испытаний МИ является:
а) несоответствие медицинского изделия требованиям нормативной, технической и
(или) эксплуатационной документации;
б) отсутствие доказательств биологической безопасности медицинского изделия.
Регистрирующий орган в течение 5 рабочих дней со дня получения от экспертного
учреждения заключения о возможности (невозможности) проведения клинических
испытаний медицинского изделия осуществляет следующие мероприятия:
а) оценка заключения для определения соответствия заданию на проведение
экспертизы качества, эффективности и безопасности медицинского изделия;
б) принятие решения о выдаче разрешения на проведение клинических испытаний
медицинского изделия или об отказе в гос. регистрации МИ, которое оформляется
приказом регистрирующего органа, и уведомление заявителя о принятом решении;
43.
в) выдача (направление заказным почтовым отправлением с уведомлением овручении или в форме электронного документа, подписанного электронной
подписью) заявителю разрешения на проведение клинических испытаний
медицинского изделия, форма которого утверждается регистрирующим органом, и
внесение соответствующих сведений в реестр выданных разрешений на
проведение клинических испытаний медицинского изделия, порядок ведения
которого утверждается регистрирующим органом, либо уведомление об отказе в
государственной регистрации медицинского изделия с указанием причин отказа.
Основанием для принятия решения об отказе в гос. регистрации является
получение регистрирующим органом от экспертного учреждения заключения о
невозможности проведения клинических испытаний медицинского изделия.
Клинические испытания МИ осуществляются в рамках оценки соответствия,
порядок проведения которой утверждается Минздравом РФ.
Клинические испытания МИ проводятся на основании разрешения на проведение
клинических испытаний, выданного регистрирующим органом, а также
заключения об этической обоснованности проведения клинических испытаний,
выданного советом по этике МЗ РФ, в случаях, установленных Правилами.
Состав указанного совета по этике и положение о нем утверждаются МЗ РФ.
Клинические испытания МИ проводятся в медицинских организациях, отвечающих
требованиям, утвержденным МЗ РФ. Установление соответствия медицинских
организаций этим требованиям осуществляется регистрирующим органом в
порядке, установленном МЗ РФ.
44.
О клинических испытаниях МИ заявитель уведомляет регистрирующий орган втечение 5 рабочих дней с начала их проведения, а по их окончании - о
возобновлении гос. регистрации МИ и результаты клинических испытаний МИ.
На II этапе экспертизы качества, эффективности и безопасности МИ
регистрирующий орган в течение 2 рабочих дней со дня принятия решения о
возобновлении государственной регистрации медицинского изделия на основании
задания на проведение экспертизы качества, эффективности и безопасности МИ,
выданного в соответствии с пунктом 20 Правил, направляет в экспертное
учреждение представленные заявителем результаты клинических испытаний МИ.
Экспертное учреждение в срок, в течении 10 рабочих дней проводит экспертизу
полноты и результатов проведенных испытаний и исследований, а также оформляет
и направляет в регистрирующий орган заключение по результатам экспертизы
качества, эффективности и безопасности МИ, форма которого утв. МЗ РФ.
Регистрирующий орган осуществляет следующие мероприятия:
а) оценка заключения для определения соответствия заданию на проведение
экспертизы качества, эффективности и безопасности медицинского изделия;
б) принятие решения о государственной регистрации медицинского изделия или об
отказе в государственной регистрации медицинского изделия, которое
оформляется приказом регистрирующего органа, и уведомление заявителя о
принятом решении;
в) оформление и выдача (направление заказным почтовым отправлением с
уведомлением о вручении или в форме электронного документа, подписанного
электронной подписью) заявителю регистрационного удостоверения либо
уведомления об отказе в государственной регистрации МИ с указанием причин
отказа.
45.
В течение 1 рабочего дня после принятия решения о государственной регистрациимедицинского изделия регистрирующий орган вносит данные о зарегистрированном
МИ в государственный реестр медицинских изделий и организаций,
осуществляющих производство и изготовление медицинских изделий, в порядке,
предусмотренном постановлением Правительства РФ от 19 июня 2012 г. N 615.
Внесение изменений в регистрационное удостоверение осуществляется в
следующих случаях:
а) изменение сведений о заявителе, включая сведения:
о реорганизации юридического лица;
об изменении его наименования (полного и сокращенного, в т.ч. фирменного
наименования), адреса (места нахождения);
б) изменение адреса (места производства) медицинского изделия;
в) изменение наименования медицинского изделия (в случае, если не изменились
свойства и характеристики, влияющие на качество, эффективность и безопасность
медицинского изделия).
Для внесения изменений в регистрационное удостоверение заявитель не позднее
чем через 30 рабочих дней со дня внесения соответствующих изменений представляет
в регистрирующий орган заявление о внесении изменений в регистрационное
удостоверение с приложением таких изменений и с указанием, что внесение
изменений в регистрационное удостоверение не влечет изменения свойств и
характеристик, влияющих на качество, эффективность и безопасность МИ, а также
следующие документы:
а) копия документа, подтверждающего полномочия представителя производителя;
б) номер регистрационного досье;
в) опись документов.
46.
В регистрационном удостоверении указываются следующие сведения:а) наименование медицинского изделия (с указанием принадлежностей,
необходимых для применения медицинского изделия по назначению);
б) дата государственной регистрации медицинского изделия и его регистрационный
номер;
в) в отношении юридического лица, на имя которого выдано регистрационное
удостоверение, - полное и (в случае, если имеется) сокращенное наименование, в
том числе фирменное наименование, организационно-правовая форма и адрес
(место нахождения);
г) в отношении производителя - полное и (в случае, если имеется) сокращенное
наименование, в том числе фирменное наименование, организационно-правовая
форма и адрес (место нахождения);
д) место производства медицинского изделия;
е) номер регистрационного досье;
ж) вид медицинского изделия в соответствии с номенклатурной классификацией
медицинских изделий, утверждаемой Министерством здравоохранения Российской
Федерации;
з) класс потенциального риска применения медицинского изделия в соответствии с
номенклатурной классификацией медицинских изделий, утверждаемой МЗ РФ;
и) код Общероссийского классификатора продукции для медицинского изделия.
47.
Назначение и выписывание медицинских изделий осуществляется:лечащим врачом медицинской организации;
фельдшером, акушеркой в случае возложения на них полномочий лечащего врача в
установленном порядке (приказ МЗ РФ 2012 №252).
3. Сведения о назначенном и выписанном медицинском изделии (наименование,
количество единиц МИ, ориентировочная длительность курса, обоснование
назначения МИ) указываются в медицинской карте пациента.
4. Запрещается выписывать рецепты медицинским работникам:
при отсутствии медицинских показаний;
на медицинские изделия, не зарегистрированные на территории РФ.
5. Рецепты на медицинские изделия выписываются на рецептурных бланках форм
N 1-МИ, N 2-МИ, 3-МИ в соответствии с требованиями, предусмотренными
порядком оформления рецептурных бланков на медицинские изделия, их учета и
хранения, утвержденным приказом Минздрава РФ 2012 г. N 1181н.
Не допускается сокращение наименования медицинского изделия, не позволяющее
установить, какое конкретно медицинское изделие выписано.
6. При необходимости немедленного или срочного отпуска медицинского изделия
пациенту в верхней части рецепта проставляются обозначения "cito" (срочно) или
"statim" (немедленно).
7. Срок действия рецепта на медицинское изделие составляет один месяц со дня
выписки. В случае выписывания рецептов гражданам, достигшим пенсионного
возраста, инвалидам первой группы и детям - инвалидам срок действия рецепта
составляет три месяца со дня выписки.
48.
Для диагностики и лечения хронических заболеваний рецепты на медицинскиеизделия выписываются на курс лечения и диагностики до трех месяцев.
При выписывании рецептов на медицинские изделия на курс лечения и
диагностики до трех месяцев медицинский работник в рецептурном бланке делает
пометку "Пациенту с хроническим заболеванием", указывает срок действия рецепта
и периодичность отпуска медицинского изделия из аптечной организации
(еженедельно, ежемесячно и т.п.), заверяет это указание своей подписью и личной
печатью, а также печатью медицинской организации "Для рецептов".
При выписывании рецептов на медицинские изделия лицам, страдающим
хроническими заболеваниями, медицинскими работниками устанавливается срок
действия рецепта в пределах до одного года.
При выписывании медицинских изделий отдельным категориям граждан,
предусмотренным законодательством РФ и имеющим право на бесплатное
получение медицинских изделий, медицинский работник делает в рецептурном
бланке пометку "Бесплатно".
Рецепт на медицинское изделие, выписанный с нарушением требований приказа
МЗ РФ 2012 №1181, а также форм рецептурных бланков на МИ и порядка
оформления указанных бланков, их учета и хранения", или содержащий неверное
наименование МИ, считается недействительным.
Рецепт на медицинское изделие выписывается на имя пациента, для которого
предназначено медицинское изделие.
Рецепт на МИ м.б. получен пациентом или его законным представителем (ч. 2 ст. 20
ФЗ 2011 г. N 323-ФЗ). Факт выдачи рецепта на МИ законному представителю
фиксируется записью в медицинской карте пациента.
49.
Порядок оформления рецептурных бланков на МИ, их учета и храненияНа рецептурных бланках формы N 1-МИ "Рецептурный бланк на медицинские
изделия", формы N 2-МИ "Рецептурный бланк на очки корригирующие", формы N 3МИ "Рецептурный бланк на линзы контактные" (далее соответственно - формы N 1МИ, N 2-МИ, N 3-МИ, рецептурные бланки) в левом верхнем углу проставляется
штамп медицинской организации с указанием ее наименования, адреса и телефона.
На рецептурных бланках, оформляемых индивидуальными предпринимателями,
имеющими лицензию на медицинскую деятельность, в верхнем левом углу
типографским способом или путем проставления штампа указывается адрес места
осуществления деятельности, номер и дата лицензии, наименование органа
государственной власти, выдавшего лицензию.
Рецептурные бланки заполняются медицинским работником разборчиво, четко,
чернилами или шариковой ручкой синего, фиолетового или черного цвета.
Допускается оформление всех реквизитов рецептурных бланков с использованием
компьютерных технологий.
Оформление рецептурных бланков включает в себя цифровое кодирование:
а) код медицинской организации в соответствии с ОГРН, проставляемый при
изготовлении рецептурных бланков;
б) отметка об источнике финансирования (федеральный бюджет[1], бюджет
субъекта РФ[2], и процент оплаты рецепта пациентом (100%[1], бесплатно[2]).
50.
51.
Приложение N 3УТВЕРЖДЕНА
Приказом Министерства здравоохранения РФ от 20 декабря 2012 г. N 1181н
Форма N 2-МИ
Рецептурный бланк (очки корригирующие)
Наименование медицинской организации: Штамп ОГРН
Источник финансирования при льготном обеспечении
(нужное подчеркнуть):
1) федеральный бюджет 2) бюджет субъекта Российской Федерации
Процент оплаты пациентом: 1) 100% 2) бесплатно
Рецепт действителен в течение (указать срок действия):
РЕЦЕПТ Серия ___________ N ___________ Дата выдачи от "__" __________ 20__ г.
Ф.И.О. пациента
_________________________________________________________________________
Дата рождения от "__" ____ 20__ г.
Номер страхового медицинского полиса
_________________________________________________________________________
Номер медицинской карты пациента
_________________________________________________________________________
Ф.И.О. медицинского работника
_________________________________________________________________________
Номер телефона медицинского работника
_________________________________________________________________________
Наименование медицинского изделия
_________________________________________________________________________
Количество единиц
Сфера Цилиндр Ось
Призма Основание Правый Верх
52.
В рецептурных бланках:в графах "Ф.И.О. пациента" указываются полностью фамилия, имя и отчество пациента;
в графе "Дата рождения" указывается дата рождения пациента (число, месяц, год);
в графе "Номер полиса ОМС" указываются СНИЛС гражданина в ПФР и номер полиса ОМС; в
графе "Номер медицинской карты пациента (истории развития ребенка)" указывается номер
медицинской карты пациента (истории развития ребенка);
в графе "Ф.И.О. медицинского работника" указываются полностью фамилия, имя, отчество
медицинского работника, имеющего право назначения и выписывания медицинских изделий;
в графе "наименование медицинского изделия" указывается наименование МИ в соответствии
с указанным в гос. реестре МИ и организаций, осуществляющих производство и изготовление
МИ, при заполнении формы N 2-МИ указывается "Очки корригирующие", при заполнении
формы N 3-МИ указывается "Линзы контактные";
в графе "Количество единиц" указывается точное количество и единица измерения.
Рецепт, выписанный на рецептурном бланке, подписывается медицинским работником,
заверяется его личной печатью, а также печатью мед. организации "Для рецептов".
На одном рецептурном бланке формы - выписывается только одно наименование МИ.
Для исправления ошибок следует перечеркнуть неверное значение, вписать правильное
значение и поставить подпись мед. работника и дату исправления. Все исправления заверяются
печатью лечащего врача. Не допускается исправление ошибок с помощью корректирующего
или иного аналогичного средства.
После отпуска из аптечной организации МИ, выписанного отдельным категориям граждан,
предусмотренным законодательством РФ и имеющим право на их бесплатное получение,
рецепт остается в аптечной организации, корешок от данного рецепта выдается пациенту (лицу,
его представляющему) с отметкой о наименовании МИ, количестве отпущенных единиц.
В остальных случаях рецепт возвращается пациенту (лицу, его представляющему).
53.
Учету подлежат все рецептурные бланки на медицинские изделия.Учет рецептурных бланков осуществляется в журналах учета, пронумерованных,
прошнурованных и скрепленных подписью руководителя и печатью медицинской
организации или подписью индивидуального предпринимателя, имеющего
лицензию на медицинскую деятельность.
Журнал учета рецептурных бланков содержит следующие графы:
а) номер по порядку; б) в разделе "Приход": дата регистрации приходного док-та;
номер и дата приходного документа, название поставщика;
общее количество поступивших рецептурных бланков;
Ф.И.О. и подпись ответственного медицинского работника, получившего
рецептурные бланки от поставщика;
в) в разделе "Расход": дата выдачи рецептурных бланков;
количество выданных рецептурных бланков;
Ф.И.О. ответственного мед. работника, получившего рецептурные бланки;
подпись ответственного мед. работника, получившего рецептурные бланки;
д) Ф.И.О. и подпись ответственного медицинского работника, выдавшего
рецептурные бланки;
е) остаток рецептурных бланков.
54.
Хранению подлежат только рецептурные бланки на медицинские изделия,выписанные отдельным категориям граждан, предусмотренным
законодательством РФ и имеющим право на их бесплатное получение.
Запас рецептурных бланков в медицинских организациях не должен превышать
полугодовой потребности.
В каждой мед. организации приказом руководителя назначается лицо,
ответственное за получение, хранение, учет и выдачу всех видов рецептурных
бланков.
Рецептурные бланки должны храниться ответственным лицом, назначенным
руководителем медицинской организации, под замком в металлическом шкафу
(сейфе) или металлическом ящике.
Индивидуальный предприниматель, имеющий лицензию на медицинскую
деятельность, должен хранить рецептурные бланки под замком в металлическом
шкафу (сейфе) или металлическом ящике.
Постоянно действующая комиссия, создаваемая в медицинской организации,
проверяет состояние хранения, учета, фактическое наличие и расход рецептурных
бланков один раз в квартал.
В случае несовпадения книжного остатка рецептурных бланков с фактическим
наличием лицо, ответственное за получение, хранение, учет и выдачу рецептурных
бланков, несет ответственность, предусмотренную законодательством Российской
Федерации.
Рецептурные бланки в количестве двухнедельной потребности выдаются
медицинским работникам по распоряжению главного врача или его заместителя.
55.
3. Правила оформления лекарственных препаратов.Статья 46, ФЗ №61 2010 "Об обращении лекарственных средств". Маркировка ЛС.
1. Лекарственные препараты, за исключением лекарственных препаратов,
изготовленных аптечными организациями, ветеринарными аптечными
организациями, индивидуальными предпринимателями, имеющими лицензию на
фармацевтическую деятельность, должны поступать в обращение, если:
1) на их первичной упаковке (за исключением первичной упаковки лекарственных
растительных препаратов) хорошо читаемым шрифтом на русском языке указаны
наименование лекарственного препарата (международное непатентованное, или
группировочное, или химическое, или торговое наименование), номер серии, дата
выпуска (для иммунобиологических лекарственных препаратов), срок годности,
дозировка или концентрация, объем, активность в единицах действия или
количество доз; (в ред. ФЗ от 11.10.2010 N 271-ФЗ, от 22.12.2014 N 429-ФЗ)
2) на их вторичной (потребительской) упаковке хорошо читаемым шрифтом на
русском языке указаны наименование лекарственного препарата (международное
непатентованное, или группировочное, или химическое и торговое наименования),
наименование производителя ЛП, номер серии, дата выпуска (для
иммунобиологических ЛП), номер регистрационного удостоверения, срок годности,
способ применения, дозировка или концентрация, объем, активность в единицах
действия либо количество доз в упаковке, лекарственная форма, условия отпуска,
условия хранения, предупредительные надписи. (в ред. ФЗ 2010 N 271-ФЗ, 2014 N
429-ФЗ)
56.
2. Фармацевтические субстанции должны поступать в обращение, если на ихпервичной упаковке хорошо читаемым шрифтом на русском языке указаны
наименование фармацевтической субстанции (МНН, или группировочное, или
химическое и торговое наименования), наименование производителя
фармацевтической субстанции, номер серии и дата изготовления, количество в
упаковке и единицы измерения количества, срок годности и условия хранения.
3. Лек. средства в качестве сывороток должны поступать в обращение с указанием
животного, из крови, плазмы крови, органов и тканей которого они получены.
4. На вторичную (потребительскую) упаковку ЛС, полученных из крови, плазмы
крови, органов и тканей человека, должна наноситься надпись: "Антитела к ВИЧ-1,
ВИЧ-2, к вирусу гепатита C и поверхностный антиген вируса гепатита B отсутствуют".
5. На первичную упаковку и вторичную (потребительскую) упаковку
радиофармацевтических ЛС должен наноситься знак радиационной опасности.
6. На вторичную (потребительскую) упаковку гомеопатических ЛП должна
наноситься надпись: "Гомеопатический".
7. На вторичную (потребительскую) упаковку растительных ЛП должна наноситься
надпись: "Продукция прошла радиационный контроль".
8. На первичную упаковку (при технической возможности) и вторичную упаковку
ЛП, предназначенных для клинических исследований, должна наноситься надпись:
"Для клинических исследований". (в ред. ФЗ от 22.12.2014 N 429-ФЗ)
9. Упаковка ЛС, предназначенных исключительно для экспорта, маркируется в
соответствии с требованиями страны-импортера.
57.
10. На транспортную тару, которая не предназначена для потребителей и в которуюпомещено ЛС, должна наноситься информация о наименовании, серии ЛС, дате
выпуска, количестве вторичных (потребительских) упаковок ЛС, производителе ЛС с
указанием наименования и местонахождения производителя ЛС (адрес, в том числе
страна и (или) место производства ЛС), а также о сроке годности ЛС и об условиях
его хранения и перевозки, необходимые предупредительные надписи и
манипуляторные знаки.
11. На первичную упаковку и вторичную (потребительскую) упаковку ЛС для
ветеринарного применения должна наноситься надпись: "Для ветеринарного
применения".
12. На вторичную (потребительскую) упаковку ЛП наносится штриховой код.
Статья 27 ФЗ о НС, ПВ №3 1998 (ред. 28.12.2017). Упаковка и маркировка НС, ПВ.
1. Внешняя и внутренняя упаковки и маркировка НС, ПВ должны соответствовать
требованиям законодательства об обращении лекарственных средств и №3-ФЗ.
2. Внешняя упаковка НС, ПВ должна исключать возможность их извлечения без
нарушения целостности указанной упаковки.
3. Внутренняя упаковка НС, ПВ, внесенных в Список II и используемых в
медицинских целях, должна быть помечена двойной красной полосой.
4. В случаях несоответствия внешней и внутренней упаковок и маркировки
наркотических средств и психотропных веществ, используемых в медицинских
целях, требованиям, предусмотренным пунктами 1 - 3 настоящей статьи,
наркотические средства и психотропные вещества уничтожаются в соответствии с
законодательством РФ.
58.
Лекарства, содержащие НС, ПВ, получаемые из аптек, должны иметь наэтикетке обозначения: "Внутреннее", "Наружное", "Для инъекций", "Глазные
капли" и т.д., название или номер аптеки, изготовившей лекарство,
наименование отделения (кабинета), состав лекарства в соответствии с
прописью, указанной в требовании ЛПУ, дату изготовления, N анализа, срок
годности и подпись лиц: изготовившего, проверившего и отпустившего
лекарство из аптеки.
При отсутствии на упаковках лекарств, содержащих НС, ПВ, перечисленных
обозначений, хранение и применение их в ЛПУ не разрешается.
Расфасовка, рассыпка, переливание и перекладывание в тару отделения
(кабинета), а также замена этикеток, категорически запрещаются.
На этикетках ЛП с НС, ПВ, д.б. поставлен штамп черной тушью "Яд".
НС, ПВ, сильнодействующие и ядовитые вещества должны храниться в
опечатанных или опломбированных сейфах.
НС, ПВ, полученные сменным медицинским персоналом, должны храниться в
прикрепленном к полу или стене закрытом и опечатанном сейфе в специально
отведенном помещении. На внутренней стороне дверки сейфа д.б. перечень НС,
ПВ с указанием высших разовых и суточных доз.
НС, ПВ для парентерального, внутреннего и наружного применения должны
храниться раздельно.
59.
Статья 56. Изготовление и отпуск лекарственных препаратов1. Изготовление ЛП аптечными организациями, ветеринарными аптечными
организациями, индивидуальными предпринимателями, имеющими лицензию на
фармацевтическую деятельность, осуществляется по рецептам на ЛП, по
требованиям медицинских организаций, ветеринарных организаций в соответствии с
правилами изготовления и отпуска ЛП, утвержденными ФОИВ.
2. При изготовлении ЛП аптечными организациями, ИП, имеющими лицензию на
фармацевтическую деятельность, используются фармацевтические субстанции,
включенные соответственно в государственный реестр ЛС для мед. применения.
Не допускается изготовление аптечными организациями, ИП, имеющими лицензию
на фармацевтическую деятельность, ЛП, зарегистрированных в РФ.
3. Маркировка ЛП, изготовленных аптечными организациями, ИП, имеющими
лицензию на фармацевтическую деятельность, и оформление таких препаратов
должны соответствовать правилам, указанным в части 1 настоящей статьи.
4. Аптечные организации, ИП, имеющие лицензию на фармацевтическую
деятельность, несут ответственность за несоблюдение правил изготовления и отпуска
лекарственных препаратов в соответствии с законодательством Российской
Федерации.
Статья 57. Запрещение продажи фальсифицированных лекарственных средств,
недоброкачественных лекарственных средств, контрафактных лекарственных
средств
Продажа фальсифицированных лекарственных средств, недоброкачественных
лекарственных средств, контрафактных лекарственных средств запрещается.
60.
Статья 67. Информация о лекарственных препаратах. Система мониторингадвижения лекарственных препаратов для медицинского применения
(в ред. Федерального закона от 28.12.2017 N 425-ФЗ)
1. Информация о ЛП , отпускаемых по рецепту на ЛП, должна содержаться только в
специализированных изданиях, предназначенных для медицинских,
фармацевтических, ветеринарных работников. Информация о ЛП для специалистов
в области обращения ЛС может содержаться в монографиях, справочниках, научных
статьях, в докладах на конгрессах, конференциях, симпозиумах, научных советах, а
также в инструкциях по применению ЛП.
2. Информация о ЛП, отпускаемых без рецепта на ЛП, может содержаться в
публикациях и объявлениях средств массовой информации, специализированных и
общих печатных изданиях, инструкциях по применению ЛП, иных изданиях
субъектов обращения ЛС. Рекламные материалы о ЛП, отпускаемом без рецепта на
ЛП, должны соответствовать инструкции по применению ЛП.
3. Допускается использование любых материальных носителей, позволяющих
хранить, передавать и использовать информацию о лекарственных препаратах без
ее искажения.
4. Для целей идентификации упаковок ЛП для медицинского применения
производители ЛС в порядке, установленном Правительством РФ, наносят на
первичную упаковку (в отношении ЛП, для которых не предусмотрена вторичная
упаковка) и вторичную (потребительскую) упаковку ЛП идентификации, за
исключением ЛП, производимых для проведения клинических исследований,
экспорта, ЛП, указанных в частях 5 и 8 статьи 13 настоящего Федерального закона.
(часть 4 введена ФЗ от 28.12.2017 N 425-ФЗ, вступает в силу с 1 января 2020 года).
61.
5. Характеристики средства идентификации, порядок его нанесения и требования кструктуре и формату информации, которую содержит средство идентификации,
определяются Правительством РФ. (часть 5 введена ФЗ 2017 N 425-ФЗ)
6. Порядок создания, развития, ввода в эксплуатацию, эксплуатации и вывода из
эксплуатации системы мониторинга движения лекарственных препаратов для
медицинского применения, порядок предоставления информации, содержащейся
в системе мониторинга движения лекарственных препаратов для медицинского
применения, и порядок взаимодействия указанной системы с иными
государственными информационными системами и информационными системами
юридических лиц и индивидуальных предпринимателей, указанных в частях 7 и 10
настоящей статьи, устанавливаются Правительством Российской Федерации.
Операторами системы мониторинга движения лекарственных препаратов для
медицинского применения являются федеральный орган исполнительной власти и
(или) организация, уполномоченные Правительством РФ.
(часть 6 введена ФЗ от 28.12.2017 N 425-ФЗ)
7. Юридические лица и индивидуальные предприниматели, осуществляющие
производство, хранение, ввоз в Российскую Федерацию, отпуск, реализацию,
передачу, применение и уничтожение ЛП, обеспечивают в порядке и в составе,
которые установлены Правительством РФ с учетом вида осуществляемой ими
деятельности, внесение информации о ЛП в систему мониторинга движения ЛП.
(ч. 7 введена ФЗ от 28.12.2017 N 425-ФЗ, вступает в силу с 1 января 2020 года).
62.
8. Организация информационного взаимодействия системы мониторинга движенияЛП с иными государственными информационными системами обеспечивается в т.ч.
посредством инфраструктуры, обеспечивающей информационно-технологическое
взаимодействие информационных систем, используемых для предоставления
государственных и муниципальных услуг и исполнения государственных и
муниципальных функций в электронной форме. (ч. 8 введена ФЗ 2017 N 425-ФЗ)
9. Общедоступная информация, содержащаяся в системе мониторинга движения
ЛП, размещается в информационно-телекоммуникационной сети "Интернет" (в т.ч.
в форме открытых данных) в порядке, установленном Правительством РФ.
10. Производители ЛС получают содержащуюся в системе мониторинга движения
ЛП информацию о сериях и партиях ЛП, производимых ими и находящихся в
гражданском обороте в РФ, безвозмездно. (ч. 10 введена ФЗ от 28.12.2017 N 425-ФЗ)
11. За производство или продажу ЛП без нанесения средств идентификации, с
нарушением порядка их нанесения, а также за несвоевременное внесение данных в
систему мониторинга движения ЛП или недостоверных данных ЮЛ и ИП, указанные
в ч. 4 и 7 ст. 67, несут ответственность в соответствии с законодательством РФ.
(ч. 11 введена ФЗ 2017 N 425-ФЗ, вступает в силу с 1 января 2020 года)
12. Правительство РФ вправе установить особенности внедрения системы
мониторинга движения ЛП, включая сроки ее внедрения, в отношении ЛП,
включенных в перечень ЖНВЛП, предназначенных для обеспечения лиц, больных
гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше,
злокачественными новообразованиями лимфоидной, кроветворной и родственных
им тканей, рассеянным склерозом, лиц после трансплантации органов и (или)
тканей, иных ЛП МП (ч. 12 введена ФЗ 2017 N 425-ФЗ).
63.
Заключение: Требования законодательства РФ попорядку назначения, выписывания, отпуску
лекарственных препаратов и медицинских изделий в
военно-медицинских организациях обязательны для
всех должностных лиц. Нарушение их может повлечь
дисциплинарную, административную и уголовную
ответственность.






























































 Медицина
Медицина








