Похожие презентации:
Ионная связь. Причина образования химической связи
1.
=<
Атом
Атом становится ионом
2.
Периодическая система химическихэлементов Д.И. Менделеева
3.
4.
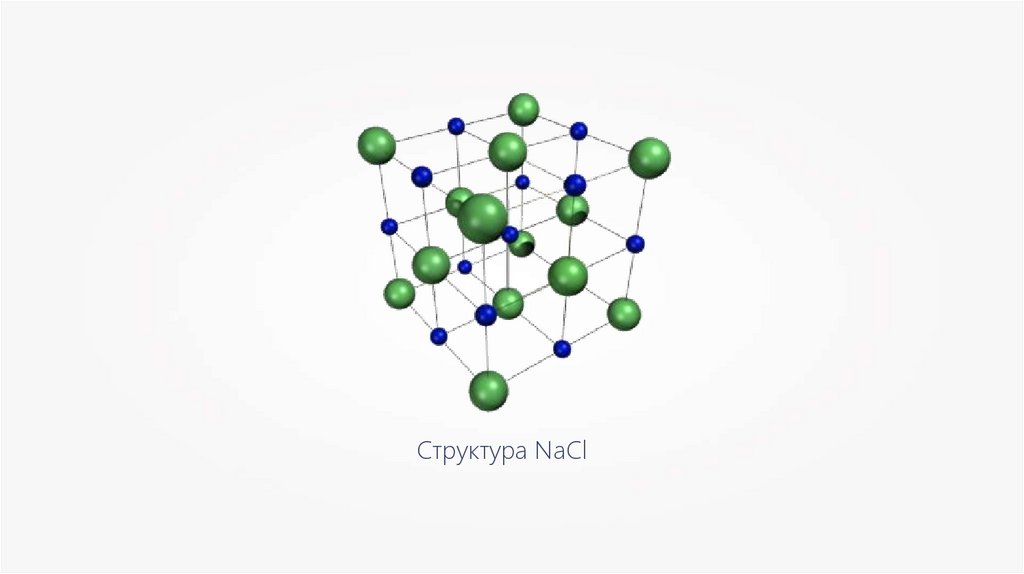
Структура NaCl5.
+Na
+
Cl
-
Химическая связь — взаимодействие,
которое связывает отдельные атомы в
более сложные системы (молекулы,
радикалы, кристаллы и т.д.).
6.
Причина образованияхимической связи — стремление
атомов посредством взаимодействия
с другими атомами достичь более
устойчивого состояния.
7.
++
Na
-
Cl
Валентные электроны играют ключевую роль в образовании
химической связи, так как они располагаются на внешнем
электронном слое и наименее прочно связаны с ядром атома.
8.
На внешнем энергетическомуровне у атома может
находиться от одного до
восьми электронов.
Три электрона на
внешнем уровне
9.
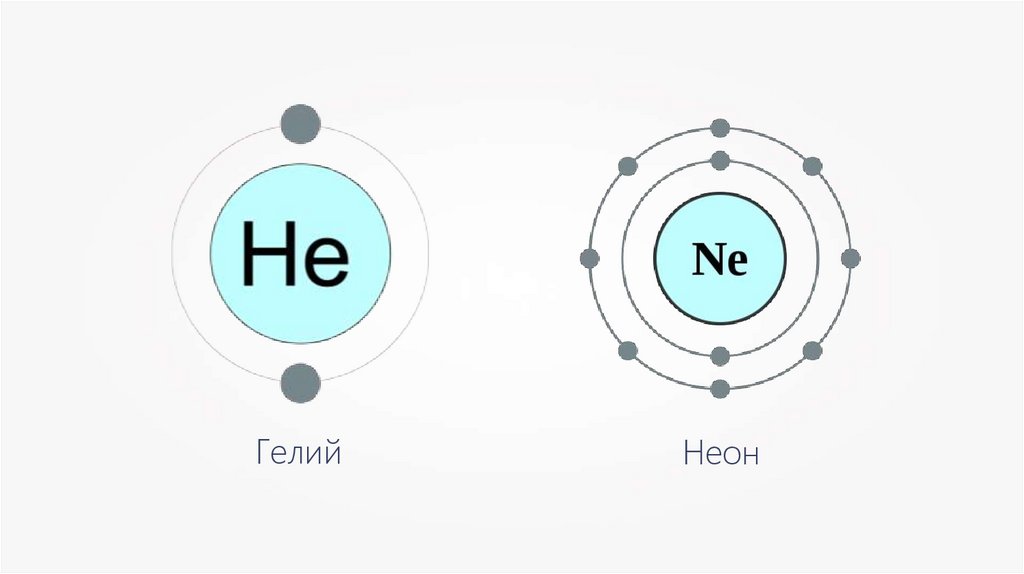
ГелийНеон
10.
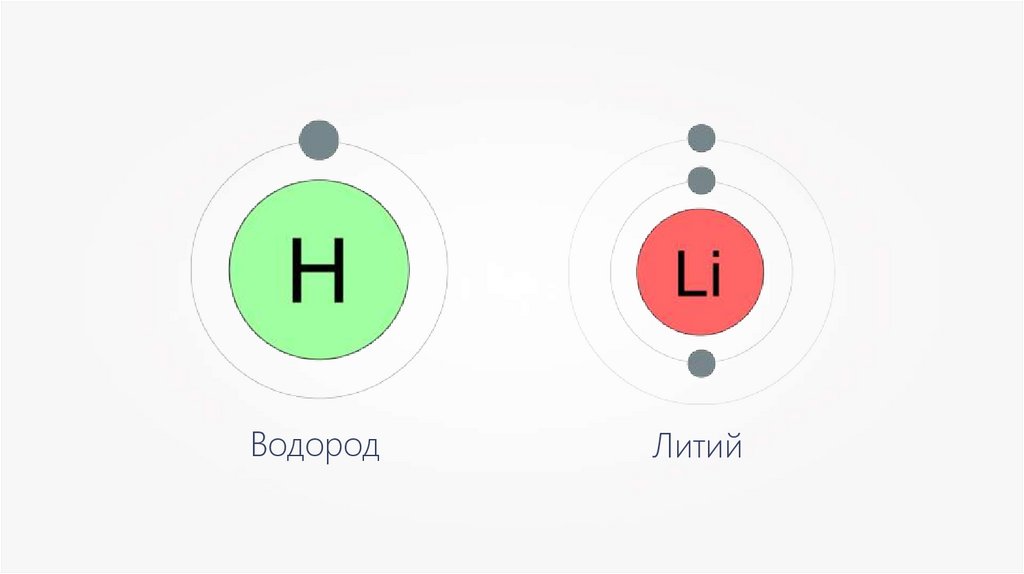
Внешние энергетическиеуровни всех атомов (кроме
атомов благородных газов)
являются незавершёнными,
поэтому атомы вступают в
химические связи.
Хлорид калия
11.
ВодородЛитий
12.
HCl
Обобществление электронов —
совместное пользование атомами
одной и той же электронной пары.
13.
Химическая связьИонная
Ковалентная
Металлическая
14.
1e-K + Cl
Атом
Атом
+ K + Cl K Cl
+
Ион
Ион
Ионное соединение
Ионная связь — химическая связь, которая
образуется между катионами и анионами за
счет их электростатического притяжения.
15.
ИоныПоложительные
Отрицательные
Катионы
Анионы
Образуются в результате
процесса окисления
Образуются в результате
процесса восстановления
16.
1eK + Cl
Атом
Атом
+
K + Cl
Ион
Ион
-
+
K Cl
-
Ионное соединение
Как правило, ионная связь возникает
между атомами типичных металлов и
типичных неметаллов.
17.
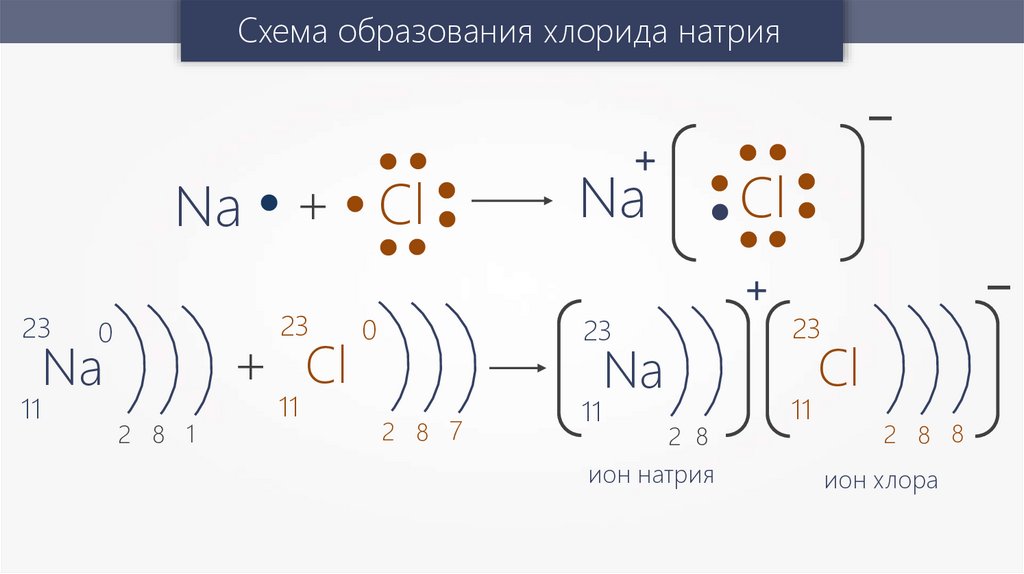
Схема образования хлорида натрияNa + Cl
23
11
23
0
+ Cl
Na
2 8 1
11
0
+
Na
23
2 8 7
11
Na
2 8
ион натрия
-
Cl
+
-
23
11
Cl
2 8 8
ион хлора
18.
Силы электростатическоговзаимодействия ионных
соединений направлены от иона
во все стороны, т.е. каждый ион
способен притягивать ионы
противоположного знака в любом
направлении.
19.
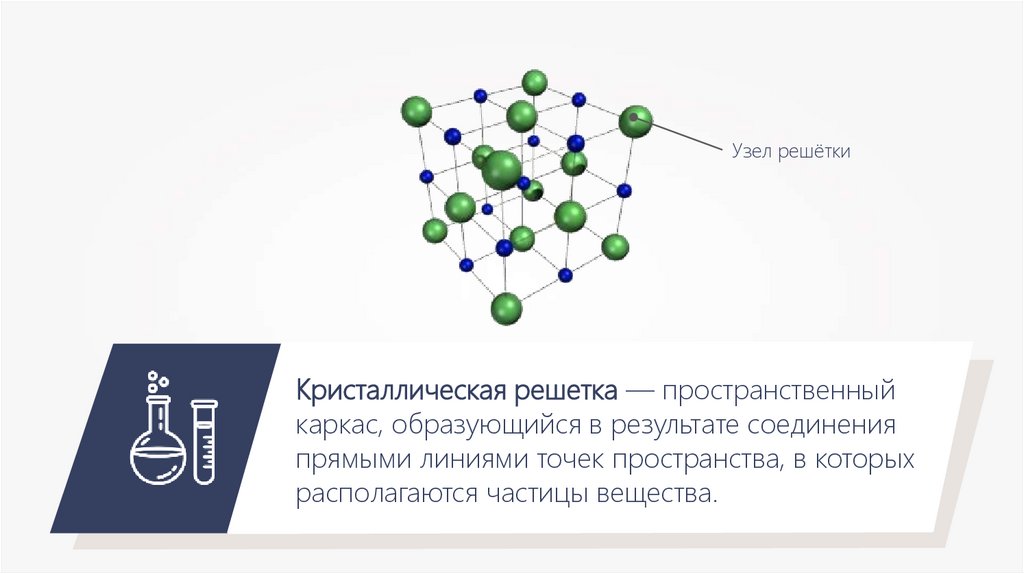
Узел решёткиКристаллическая решетка — пространственный
каркас, образующийся в результате соединения
прямыми линиями точек пространства, в которых
располагаются частицы вещества.
20.
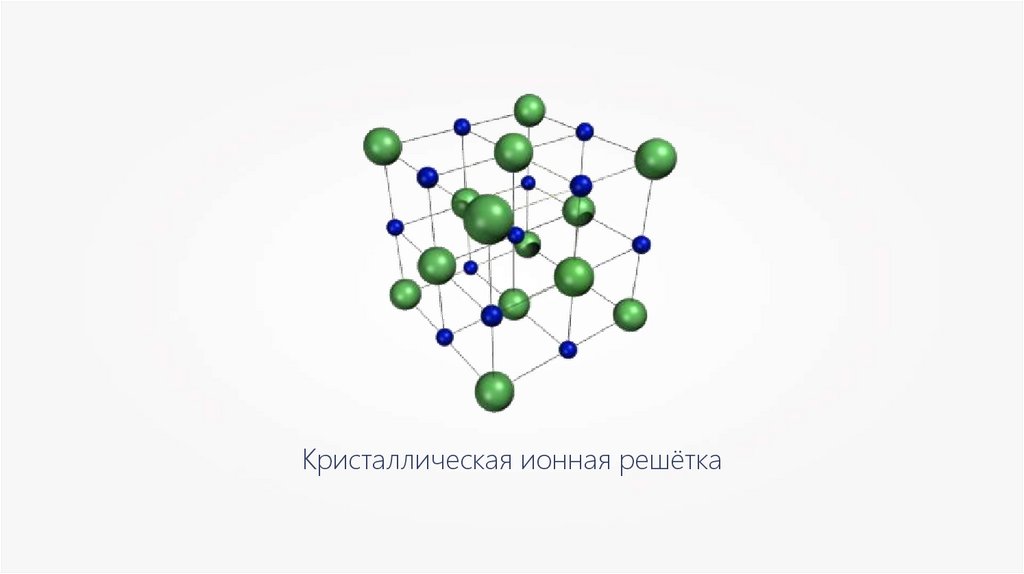
Кристаллическая ионная решётка21.
Физические свойства ионных веществ— твёрдые;
— нелетучие;
— имеют высокие температуры плавления и
кипения;
— не имеют запаха;
— не проводят электрический ток;
— хрупкие.
22.
Классификацияионов по составу
Простые
Ca2+, Cl-, S2-, Na+
Сложные
NH4+, SO42-,
NO3-, PO43-
23.
24.
Относительность ионной связи:— истинные заряды ионов не являются
целочисленными значениями, что
указывает на некоторую степень
проявления ковалентной связи;
— некоторые вещества с ионной связью
состоят только из неметаллов.


















 Химия
Химия