Похожие презентации:
Химическая связь. Урок 34-37
1.
3437
ХИМИЧЕСКАЯ
СВЯЗЬ
2.
Внутримолекулярные химические связиИонная
Ковалентная
Металлическая
В молекуле
происходит
электростатическое
притяжение между
катионом (+)
и анионом (-)
Общая электронная пара
между элементами
неметаллами
Простые вещества металлы:
Ag, Na, Hg, Au
(и вообще во всех солях
между катионом и анионом,
даже если металла там нет)
NaCl, СaO, NH4Cl,
LiOH, KH
Ковалентная
неполярная
Ковалентная
полярная
Между атомами
одного химического
элемента (неметаллы)
Между атомами разных
химических элементов
(неметаллов)
3. Ионная химическая связь
NaCl)
))
)
))
Cl
Na
+
11
17
2 8 7
2 8 1
+
-
[ ][ ]
+11
))
2 8
)))
+17
2 8 8
1e
Химическая связь, образующаяся между ионами за счет
электростатического притяжения – ионная химическая связь
4. Ионная химическая связь
2eСa + O
Атом
Атом
2+
Сa + O
Ион
Ион
2-
СaO
Ионное соединение
Ионная связь возникает при взаимодействии атомов, имеющих ярко выраженные противоположные свойства: между элементами-металлами IАи IIА-групп и элементами-неметаллами VIIА-группы, кислородом и азотом
5. Схема: ионная химическая связь
Ионнаяхимическая
связь
Схема:
ионная
химическая
связь
1. Возьмем два разных атома:
Сa – 2e
Атом
2+
Сa
Ион
N + 3e
Атом
N
3-
Ион
2. Наименьшее общее кратное между зарядами образовавшихся ионов равно 6.
Разделим его на заряды образовавшихся ионов и получим значения индексов:
3Сa + 2N
6e
2+ 3-
Сa N
3
2
6. Ионная химическая связь
Ионнаяонная химическая
химическая связь
связь
И
Все твёрдые вещества характеризуются
правильным расположением составляющих их
частиц. Если соединить эти точки линиями, то
возникнет пространственный каркас, называемый кристаллической решёткой
Так как в узлах веществ с ионной связью
располагаются ионы, такой тип решёток так и
называется — ионные кристаллические
решётки.
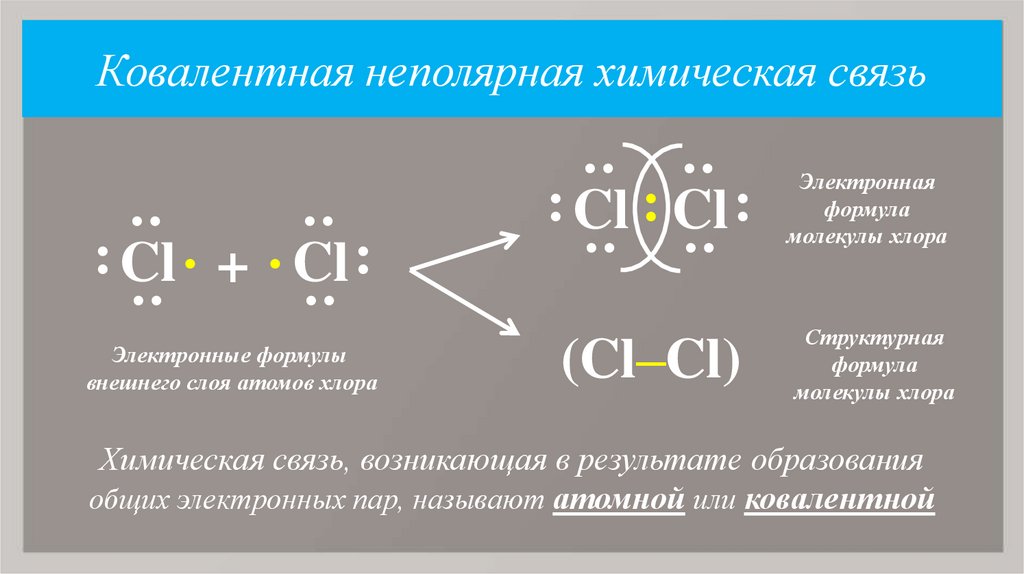
7. Ковалентная неполярная химическая связь
::
:
:
:
Электронные формулы
внешнего слоя атомов хлора
:
:
:
: Cl . + . Cl :
: Cl : Cl :
(Cl–Cl)
Электронная
формула
молекулы хлора
Структурная
формула
молекулы хлора
Химическая связь, возникающая в результате образования
общих электронных пар, называют атомной или ковалентной
8.
Ковалентная неполярная химическая связь.
.
Электронная
формула
молекулы азота
(N ––– N)
Структурная
формула
молекулы азота
.
.
:N. + . N:
..
:N . N:
Электронные формулы
внешнего слоя атомов азота
Число общих электронных пар (ковалентных химических связей), которые
данный атом образует с другими атомами, называют валентностью
9. Ковалентная неполярная химическая связь
:.
:
:
.
:
Электронные формулы
внешнего слоя атомов хлора
Электронные формулы
внешнего слоя атомов азота
.
:N. + . N:
.
: Cl . + . Cl :
Так как молекулы простых веществ-неметаллов образованы атомами
одного и того же химического элемента, то такую химическую связь
называют ковалентной неполярной
10. Ковалентная неполярная химическая связь
Некоторые вещества с ковалентнойнеполярной связью — алмаз, кремний,
кристаллический бор — имеют ещё
один тип кристаллической решётки,
в узлах которой располагаются атомы.
Эти решётки называют атомными
кристаллическими решётками
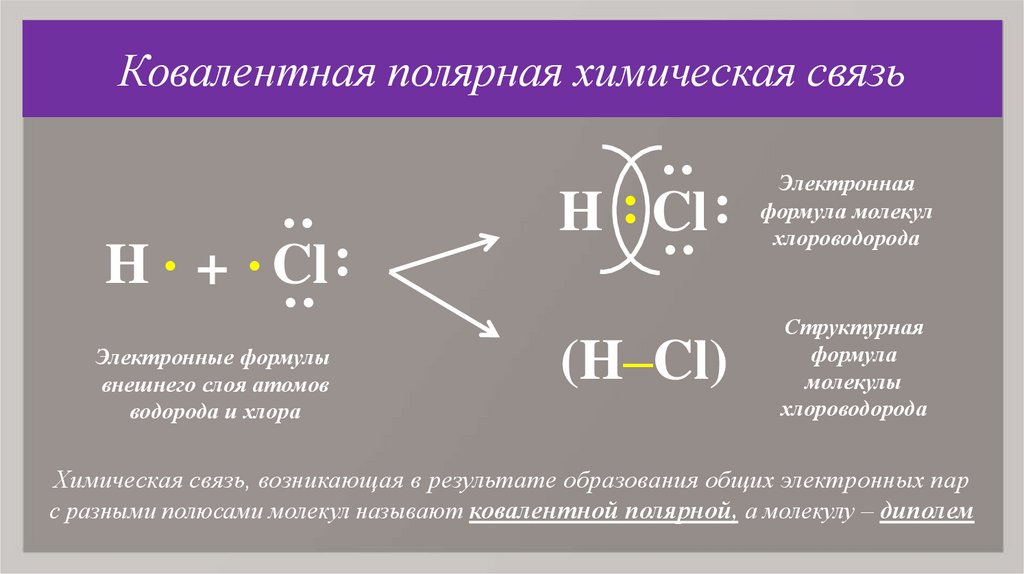
11. Ковалентная полярная химическая связь
::
:
(H–Cl)
Структурная
формула
молекулы
хлороводорода
:
H . + . Cl :
H : Cl :
Электронная
формула молекул
хлороводорода
Электронные формулы
внешнего слоя атомов
водорода и хлора
Химическая связь, возникающая в результате образования общих электронных пар
с разными полюсами молекул называют ковалентной полярной, а молекулу – диполем
12. Ковалентная полярная химическая связь
Ковалентная полярнаяполярная химическая
химическая связь
связь
Ковалентная
:
:
:
H :O:H
Электронные формулы внешнего
слоя атомов водорода и кислорода
Электронная формула
молекулы воды
:
H .+ . O . +. H
13. Ковалентная полярная химическая связь
Ковалентная полярнаяполярная химическая
химическая связь
связь
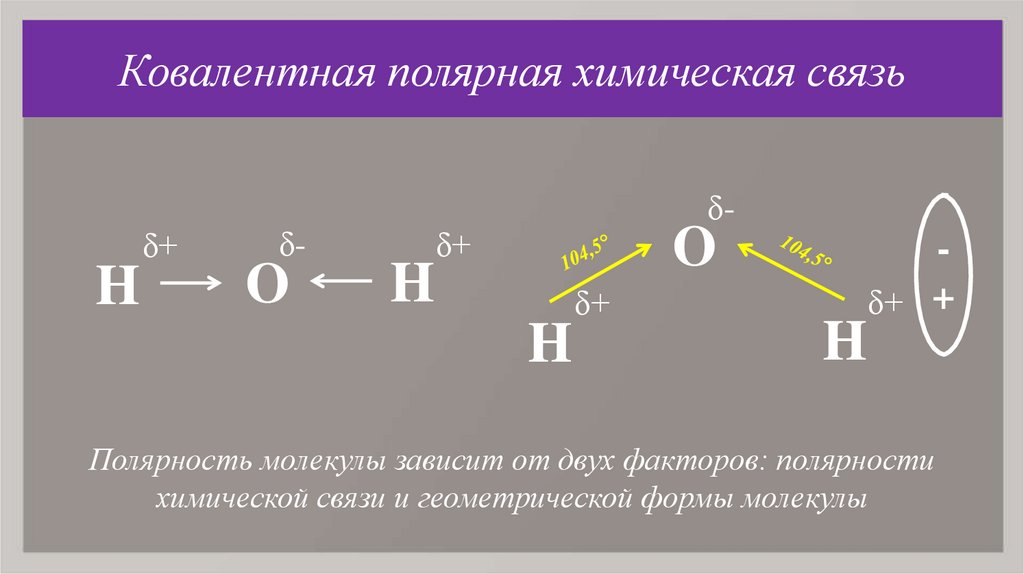
Ковалентная
δ+
H
δ-
O
H
δ-
δ+
O
δ+
H
H
δ+ +
Полярность молекулы зависит от двух факторов: полярности
химической связи и геометрической формы молекулы
14. Ковалентная полярная химическая связь
Ковалентная полярнаяполярная химическая
химическая связь
связь
Ковалентная
Электроотрицательность уменьшается
F O Cl N Br I S C Se P H
Электроотрицательность увеличивается
Электроотрицательность — это способность атома
химического элемента притягивать к себе общие электронные пары
15.
Ковалентная связь, образующаясямежду атомами с одинаковой
электроотрицательностью, называют
Ковалентная связь, образующаяся
между атомами с разной
электроотрицательностью, называют
ковалентной
неполярной связью
ковалентной
полярной связью
:
H . + . Cl :
:
:
:
Электронные формулы
внешнего слоя атомов хлора
:
:
: Cl . + . Cl :
Электронные формулы внешнего
слоя атомов водорода и хлора
16.
Электроотрицательность в периоде с увеличениемПНХЭ возрастает, а в группе с увеличением ПНХЭ – уменьшается
Электроотрицательность
увеличивается
Электроотрицательность уменьшается
17. Металлическая химическая связь
0M – ne
Атомы
-
M
n+
Ионы
Химическая связь, возникающая в металлах и сплавах между ион-атомами,
осуществляемая обобществленными электронами, называется металлической















 Химия
Химия








