Похожие презентации:
Химическая связь. Сравнение различных типов химической связи. Ионная химическая связь. 11 класс
1.
Химическая связь.Сравнение различных типов
химической связи.
Ионная химическая связь.
11 класс
профильный уровень
2.
23.09.20243
Понятие химической связи
• Что такое химическая связь?
— взаимодействие между атомами,
приводящее к образованию устойчивой
многоатомной системы: молекулы, иона,
кристалла.
• Каковы причины образования химической
связи?
— стремление
системы
к минимуму
энергии;
наиболее
устойчивой
является
такая
при этом всегда
выделяется
электронная
конфигурация,
приэнергия;
которой
внешний
уровеньатомов
завершен:
— стремление
к завершению
2
на
1
уровне
–
это
2ē,
как
у
He
1S
внешнего энергетического уровня.
2
6
или как у других благородных газов 8ē (nS np )
3.
23.09.20244
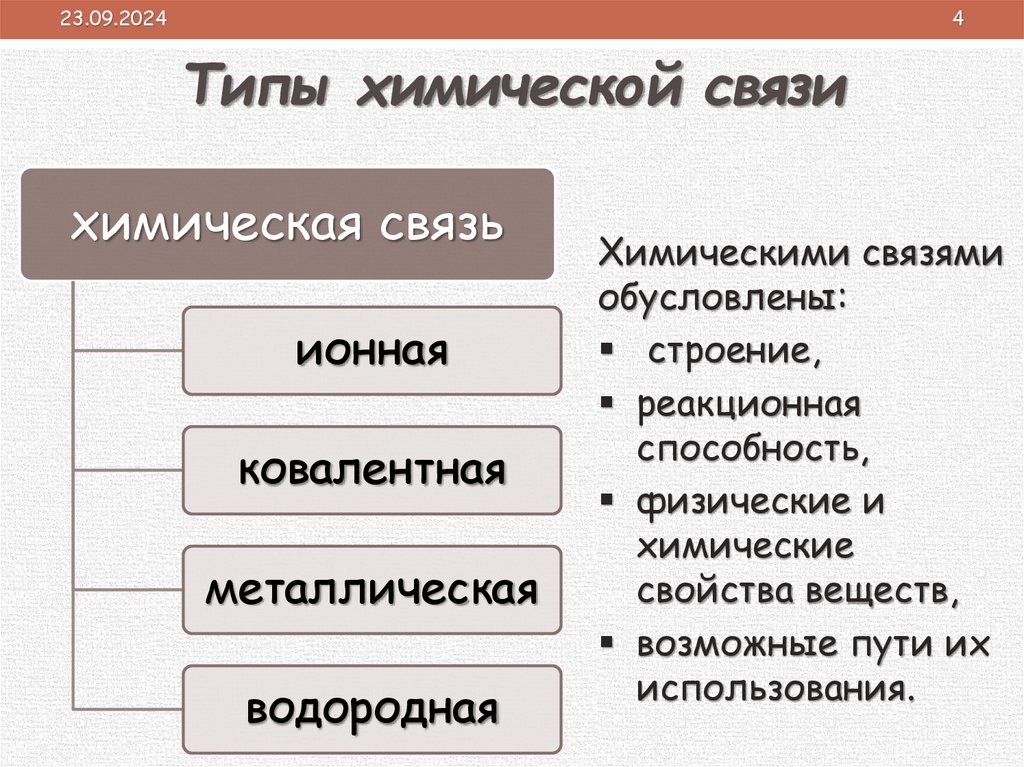
Типы химической связи
химическая связь
ионная
ковалентная
металлическая
водородная
Химическими связями
обусловлены:
строение,
реакционная
способность,
физические и
химические
свойства веществ,
возможные пути их
использования.
4.
23.09.20245
Природа химической связи
• имеет электрический характер, т.к. образуется
валентными ē;
• при образовании ионной связи устойчивая
конфигурация внешнего слоя формируется за
счет отдачи или присоединения ē;
• в случае ковалентной связи – посредством
образования общих электронных пар;
• ковалентная полярная и ионная связь
образуются в том случае, если атомы
элементов, образующих соединения
отличаются электроотрицательностью
5.
23.09.20246
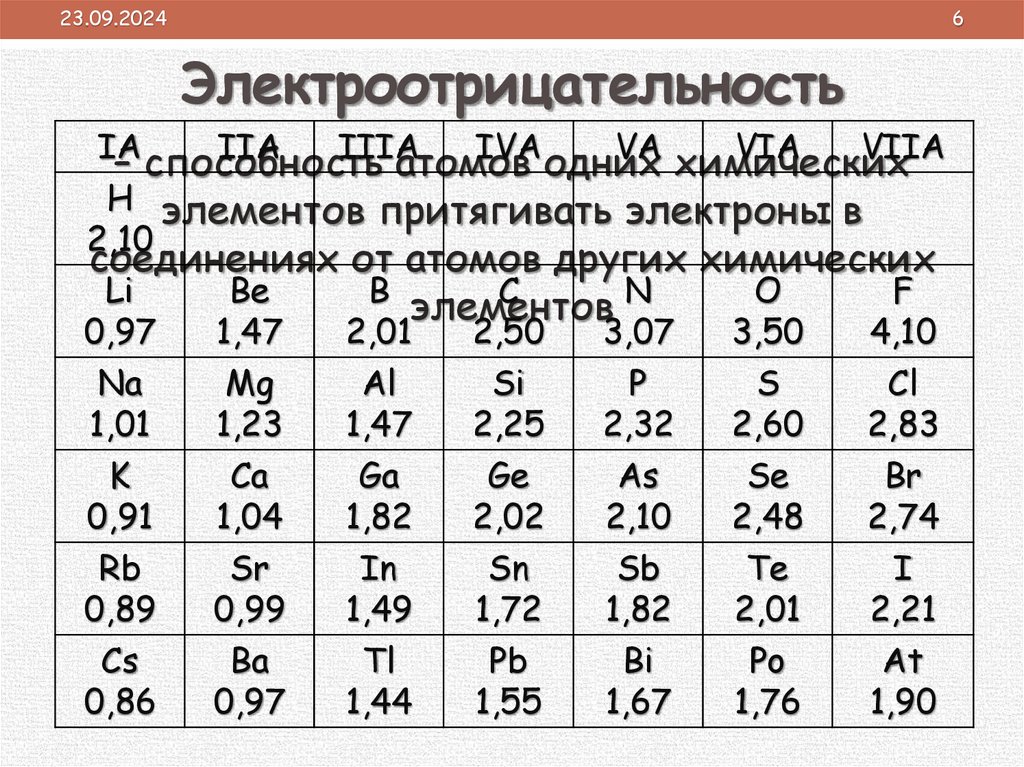
Электроотрицательность
IA
IIA
IIIA
IVA
VA
VIA
VIIA
– способность
атомов
одних
химических
H элементов притягивать электроны в
2,10
соединениях от атомов других химических
Li
Be
B
C
N
O
F
элементов
0,97
1,47
2,01
2,50
3,07
3,50
4,10
Na
Mg
Al
Si
P
S
Cl
1,01
1,23
1,47
2,25
2,32
2,60
2,83
K
Ca
Ga
Ge
As
Se
Br
0,91
1,04
1,82
2,02
2,10
2,48
2,74
Rb
Sr
In
Sn
Sb
Te
I
0,89
0,99
1,49
1,72
1,82
2,01
2,21
Cs
Ba
Tl
Pb
Bi
Po
At
0,86
0,97
1,44
1,55
1,67
1,76
1,90
6.
723.09.2024
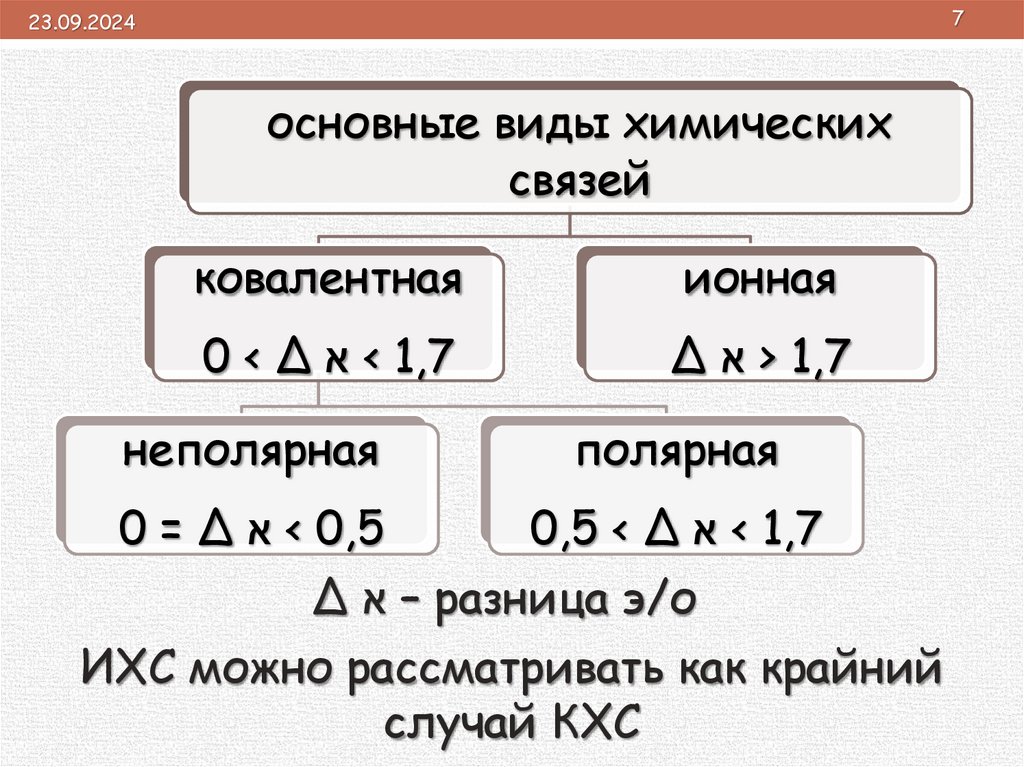
основные виды химических
связей
ковалентная
ионная
0 < Δ < א1,7
Δ > א1,7
неполярная
полярная
0 = Δ < א0,5
0,5 < Δ < א1,7
Δ – אразница э/о
ИХС можно рассматривать как крайний
случай КХС
7.
23.09.20248
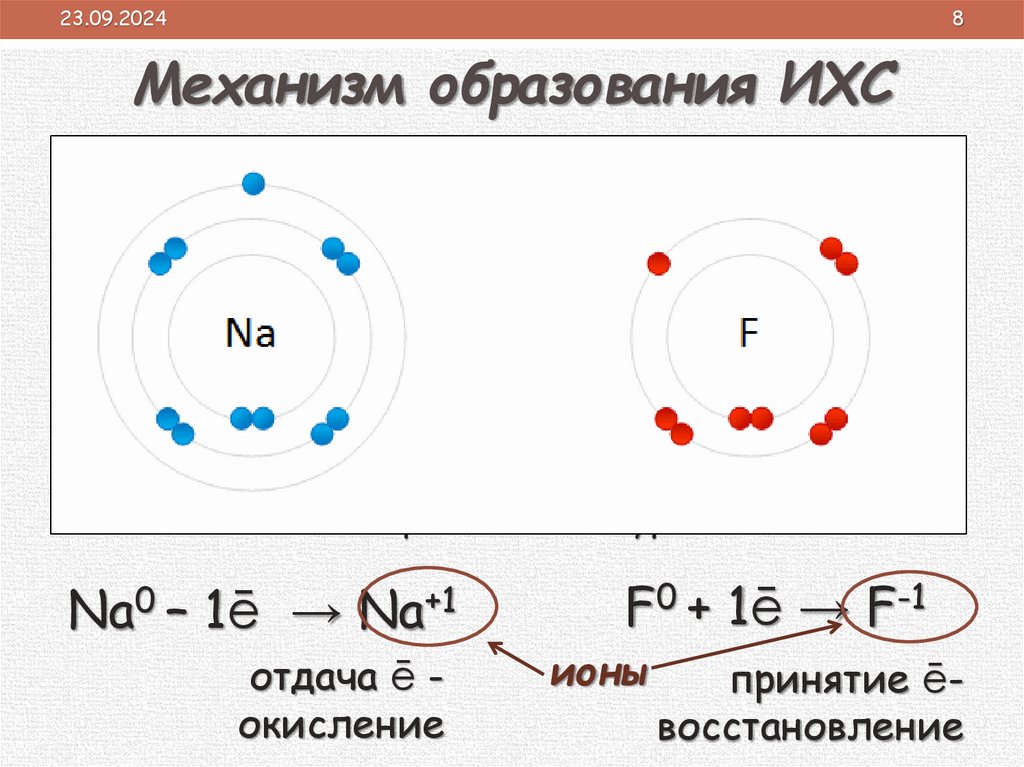
Механизм образования ИХС
устойчивая конфигурация внешнего
энергетического уровня
Na0 – 1ē
→ Na+1
отдача ē окисление
F0 + 1ē → F-1
ионы
принятие ēвосстановление
8.
23.09.20249
Ионная химическая связь
(ИХС)
• это связь между ионами;
• ионы- заряженные частицы, имеющие
устойчивую конфигурацию внешнего
+
+
уровня, которые образуются в результате
отдачи или принятия ē.
-
-
ион-катион
Ме0 – nē→Меn+
ион-анион
неМе0 + nē→неМеn-
9.
23.09.202410
Ионная связь возникает
• только между некоторыми Ме и неМе;
• характерна для:
оксидовAlCl3
э/о(Al)= 1,47
2. гидроксидов
э/о(Cl)= 2,83
3. гидридов
1.
Al2O3
щелочных
и 1,47
э/о(Al)=
щелочно-земельных
Ме
э/о(O)= 3,5
солей
Δ=א
Δ=א
• твердые, кристаллические вещества с
высокими Ткип. и Тпл., хорошо растворимые в
воде
4.
10.
23.09.202411
Свойства ионной связи
• ненасыщаемость
каждый ион может притягивать любое число
противоионов (очевидно, что с увеличением
расстояния между зарядами сила притяжения
между ними ослабевает)
• ненаправленность
каждый ион может притягивать к себе ионы
противоположного знака по любому
направлению
11.
23.09.202412
Для веществ с ИХС
• характерна ионная кристаллическая решетка;
• прочность веществ с ИХС условно определяется
энергией кристаллической решетки
н-р: Екрис.реш.(LiF) = 1004кДж/моль
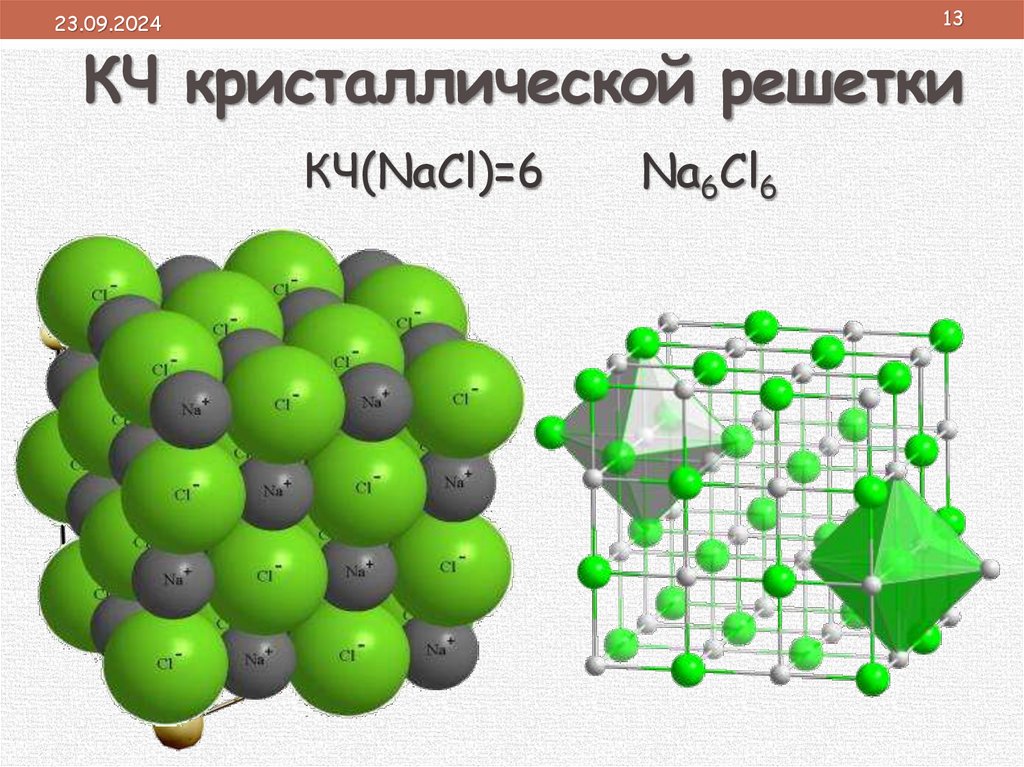
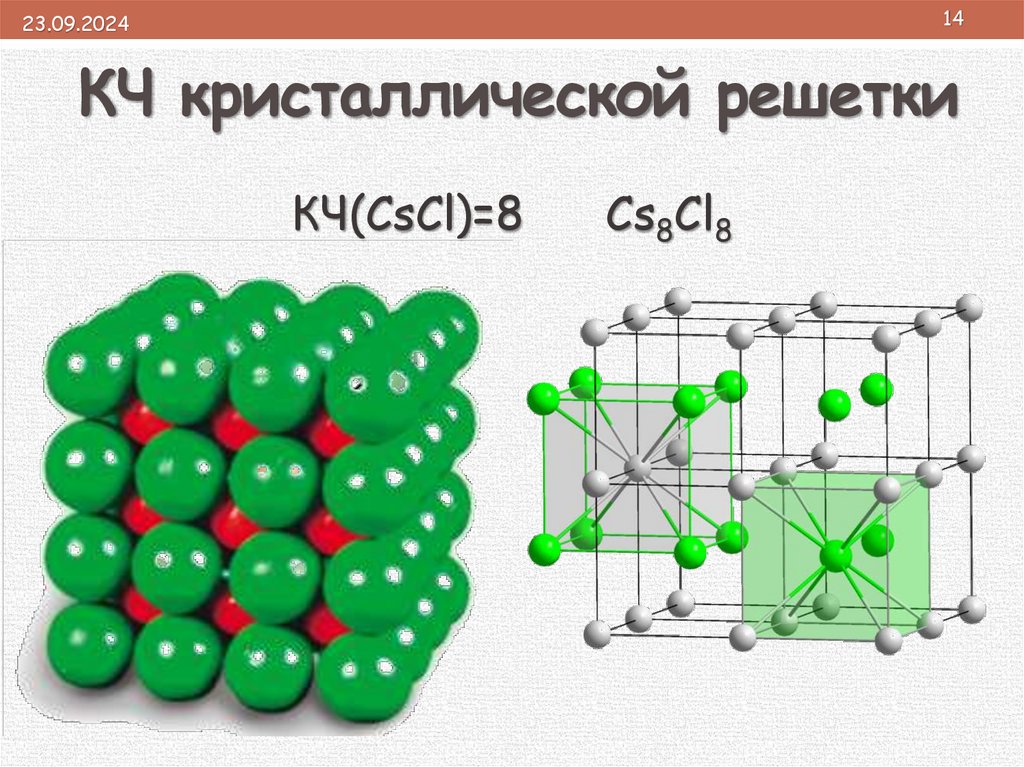
• плотность определяется координационным
Екрис.реш.(NaCl) = 755кДж/моль
числом (КЧ), которое показывает:
r(Li+) < r(Na+); r(F–) < r(Cl–)
1. число ближайших равноудаленных
• чем меньше размеры ионов и чем больше их
одинаковых частиц (ионов или атомов) в
заряд,
тем сильнее урешётке.
них электростатическое
кристаллической
поле и прочнее химическая связь.
2. отражает плотность упаковки вещества
12.
1323.09.2024
КЧ кристаллической решетки
КЧ(NaCl)=6
Na6Cl6
13.
1423.09.2024
КЧ кристаллической решетки
КЧ(CsCl)=8
Cs8Cl8
14.
23.09.2024Физические свойства веществ с
ИХС
15
• твёрдые, кристаллические в-ва, очень прочные
[н-р: Тпл (NaCl)=801°С]
• хрупкие;
• хорошо растворимые в воде
15.
1623.09.2024
Электропроводность веществ с ИХС
• в твердом состоянии ионы прочно связаны в
решетке и не могут двигаться и переносить
заряд, т. е. являются изоляторами;
• в расплаве или растворе диссоциируют на
ионы и становятся на 100% ионными:
NaCl
Na+ + Cl‾
проводники эл/тока 2 рода (электролиты)
16.
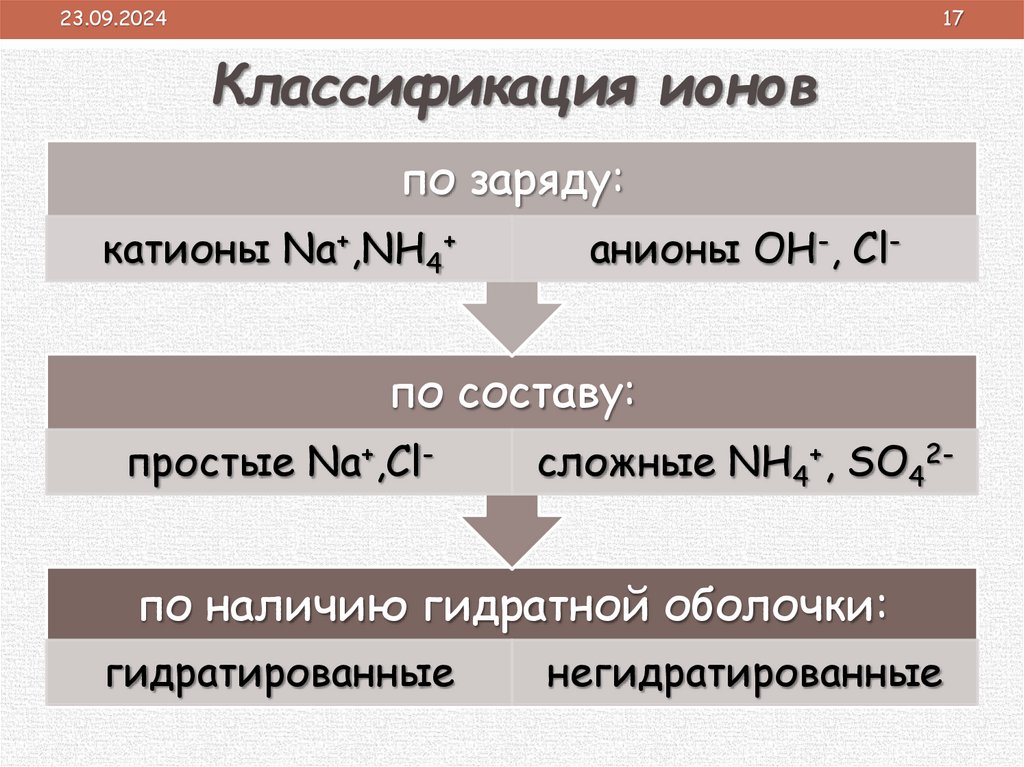
23.09.202417
Классификация ионов
по заряду:
катионы Na+,NH4+
анионы OH-, Cl-
по составу:
простые Na+,Cl-
сложные NH4+, SO42-
по наличию гидратной оболочки:
гидратированные
негидратированные
17.
23.09.2024Относительность понятия
“ИХС – это связь между Ме и неМе”
1. соли аммония имеют ионную
кристаллическую решетку и ИХС:
NH4Cl,
4NO3, (CH
3NH3)2SO4
ИХС
– NH
крайний
случай
2. AlCl3
Δ =א1,36 ⟹ КПС
КХС,перехода
и характеризуется
3. полного
электронов при
образовании ИХС не происходит:
степенью
ионности.
величины эффективных
зарядов
Na+0,8 Cl-0,8
Li+0,87 F-0,87
Cs+0,94 F-0,94
Rb+0,82 I-0,82
18
18.
1923.09.2024
Домашнее задание:
§6; записи;
распишите механизм
образования ионной связи в
молекулах:
хлорида кальция;
бромида калия;
нитриде натрия.










 Химия
Химия








