Похожие презентации:
Химические уравнения
1.
ХИМИЧЕСКИЕ УРАВНЕНИЯ2.
ХИМИЧЕСКИМ УРАВНЕНИЕМ НАЗЫВАЮТУСЛОВНУЮ
ЗАПИСЬ
ХИМИЧЕСКОЙ
РЕАКЦИИ С ПОМОЩЬЮ ХИМИЧЕСКИХ
ФОРМУЛ И МАТЕМАТИЧЕСКИХ ЗНАКОВ.
3.
ПРАВИЛА СОСТАВЛЕНИЯ ХИМИЧЕСКИХ УРАВНЕНИЙ:1. В ЛЕВОЙ ЧАСТИ УРАВНЕНИЯ ЗАПИСЫВАЮТ ФОРМУЛЫ
ТЕХ ВЕЩЕСТВ, КОТОРЫЕ ВСТУПАЮТ В РЕАКЦИЮ.
ЗАТЕМ СТАВЯТ СТРЕЛКУ:
N2 + H2 →
4.
2. В ПРАВОЙ ЧАСТИ (ПОСЛЕ СТРЕЛКИ) ЗАПИСЫВАЮТФОРМУЛЫ ВЕЩЕСТВ, ОБРАЗУЮЩИХСЯ В РЕЗУЛЬТАТЕ
РЕАКЦИИ:
N2 + H2 → NH3
5.
• З. УРАВНЕНИЕ РЕАКЦИИ СОСТАВЛЯЕТСЯ НА ОСНОВЕЗАКОНА СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ, Т. Е.СЛЕВА
И СПРАВА ДОЛЖНО БЫТЬ РАВНОЕ ЧИСЛО АТОМОВ
• ЭТО ДОСТИГАЕТСЯ РАССТАНОВКОЙ
КОЭФФИЦИЕНТОВ ПЕРЕД ФОРМУЛАМИ ВЕЩЕСТВ
6.
N2 + H2 → NH33. ПОДСЧИТАЕМ КОЛИЧЕСТВО АТОМОВ
КАЖДОГО ЭЛЕМЕНТА В ЛЕВОЙ И ПРАВОЙ
ЧАСТИ УРАВНЕНИЯ.
У ВОДОРОДА В ЛЕВОЙ ЧАСТИ УРАВНЕНИЯ 2
АТОМА, В ПРАВОЙ 3 АТОМА.
7.
4. НАХОДИМ НОК ДЛЯ 2 И 3, ЭТО 6N2 + H2 → NH3
ДЕЛИМ 6 НА ЧИСЛО АТОМОВ ВОДОРОДА
В ЛЕВОЙ ЧАСТИ, Т.Е ИНДЕКС 2, ПОЛУЧАЕМ 3 - ЭТО КОЭФФИЦИЕНТ
КОТОРЫЙ СТАВИМ ПЕРЕД ФОРМУЛОЙ
ВОДОРОДА:
N2 + 3H2 → NH3
В ПРАВОЙ ЧАСТИ ДЕЛИМ 6 НА 3, ПОЛУЧАЕМ КОЭФФИЦИЕНТ 2, СТАВИМ
ПЕРЕД ФОРМУЛОЙ 2:
N2 + 3H2 → 2NH3
8.
N2 + 3H2NH3
УРАВНЯЙТЕ ЛЕВУЮ И ПРАВУЮ ЧАСТИ
УРАВНЕНИЯ:
K + CL2 —> KCL
9.
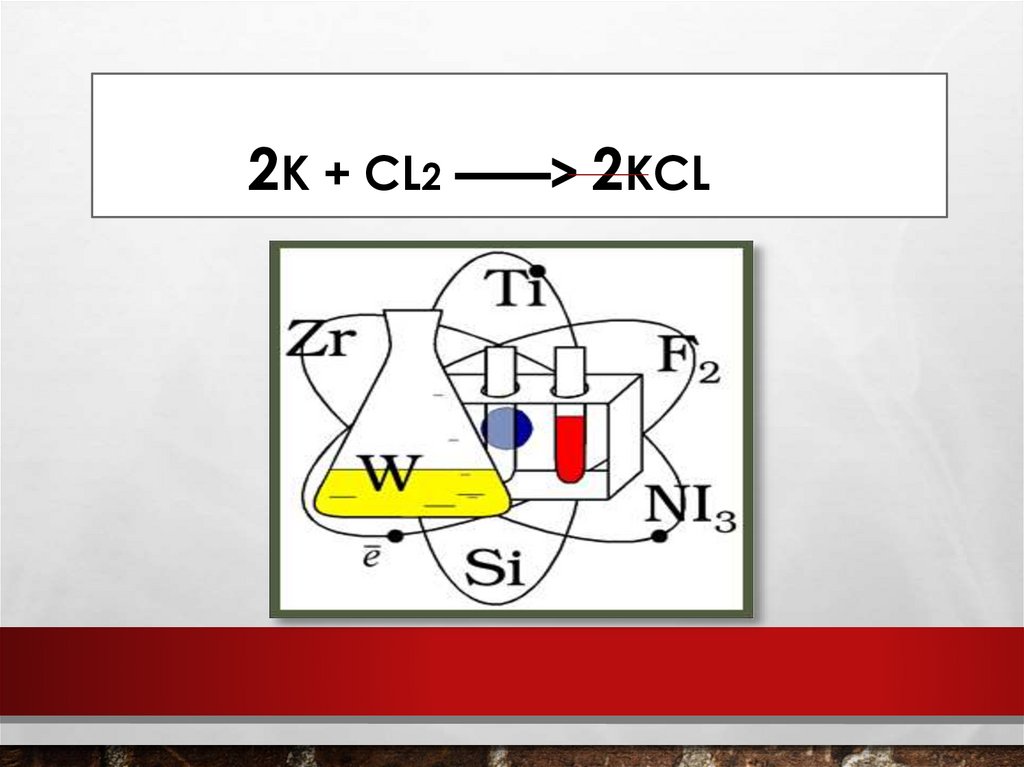
2K + CL22KCL









 Химия
Химия








