Похожие презентации:
Классификация неорганических соединений и их свойства. Кислоты. Занятие 12
1.
Классификациянеорганических соединений
и их свойства.
Кислоты.
Занятие 12
Преподаватель: Пимкова Э.В.
2.
План1.
2.
3.
4.
5.
6.
Классификация неорганических веществ.
Кислоты как электролиты, их классификация по
различным признакам.
Химические свойства кислот в свете теории
электролитической диссоциации.
Особенности взаимодействия концентрированной
серной и азотной кислот с металлами.
Правила разбавления серной кислоты.
Использование серной кислоты в промышленности.
3.
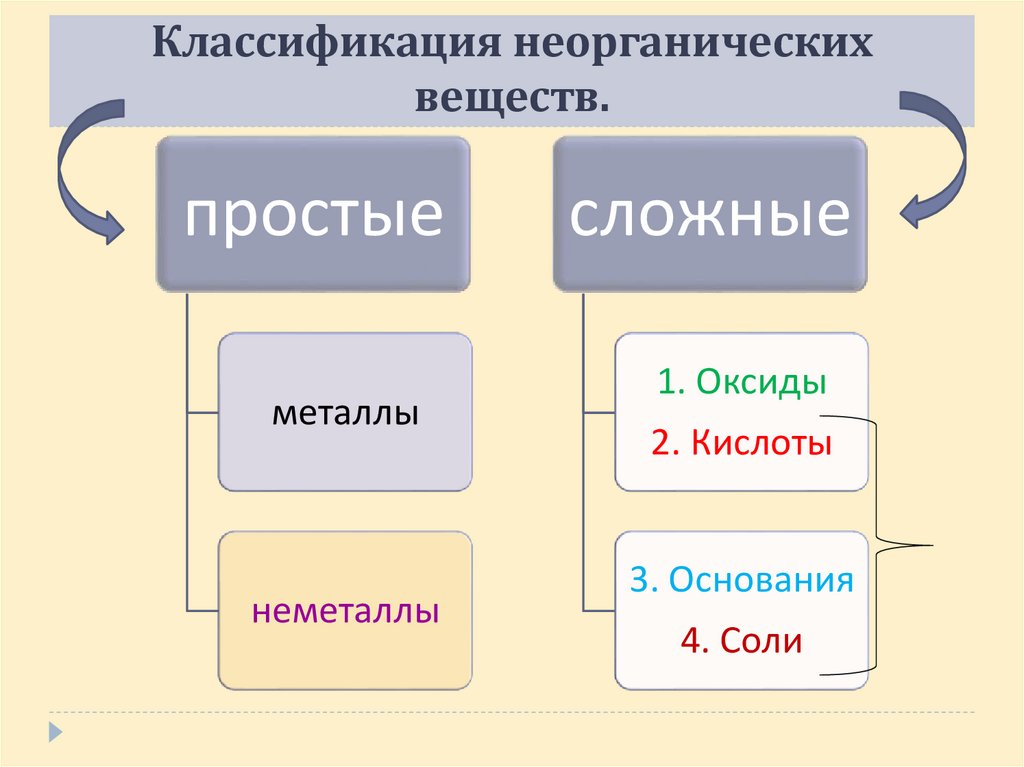
Классификация неорганическихвеществ.
простые
металлы
неметаллы
сложные
1. Оксиды
2. Кислоты
3. Основания
4. Соли
4.
Кислоты-
это электролиты,
при диссоциации
которых образуются
катионы водорода и
анионы кислотных
остатков
5.
Классификация кислот по степенидиссоциации:
сильные
HI иодоводородная
HBr бромоводородная
HCl хлороводородная
H2SO4 серная
HNO3 азотная
слабые
HF фтороводородная
H3PO4 фосфорная
H2SO3 сернистая
H2S сероводородная
H2CO3 угольная
H2SiO3 кремниевая
6.
Классификация кислот по стабильности(устойчивости):
стабильные
кислоты, которые не
разрушаются
самопроизвольно:
H2SO4
HCl
H3PO4
нестабильные
кислоты, которые
быстро разрушаются на
исходные вещества:
H2CO3 ↔ H2O + CO2↑
H2SO3 ↔ H2O + SO2↑
7.
Химические свойства кислот:1. Растворы кислот изменяют окраску индикаторов
2. Растворы кислот реагируют с металлами, стоящими в
ряду напряжений до H2
3. Растворы кислот реагируют с основными (амфотерными)
оксидами – оксидами металлов
4. Растворы кислот реагируют с основаниями – реакция
нейтрализации
5. Растворы кислот реагируют с солями слабых, летучих
кислот (например, карбонатами)
8.
1. Растворы кислот изменяют окраскуиндикаторов :
при добавлении индикатора «лакмус» –
раствор кислоты приобретает красный цвет
9.
2. Кислоты реагируют с металлами, стоящими вэлектрохимическом ряду напряжений до H2
кислота + металл → соль + водород
2HCl + Mg → MgCl2 + H2 ↑
молекулярное уравнение реакции
2H+ + 2Cl- + Mg0 → Mg2+ + 2Cl- + H2 ↑
полное ионное уравнение
2H+ + Mg0 → Mg2+ + H2 ↑
сокращенное ионное уравнение (суть реакции)
10.
Задание:Составьте уравнения возможных реакций:
1. серная кислота + алюминий →
2. соляная кислота + серебро →
3. бромоводородная кислота + цинк →
При составлении уравнений пользуйтесь рядом
напряжений.
Не забывайте, составляя формулы солей, учитывать
валентности металла и кислотного остатка.
11.
3. Растворы кислот реагируют с основными(амфотерными) оксидами – оксидами
металлов
кислота + оксид металла → соль + вода
2HCl + MgO → MgCl2 + H2O
молекулярное уравнение реакции
2H+ + 2Cl- + MgO → Mg2+ + 2Cl-+ H2O
полное ионное уравнение
2H+ + MgO → Mg2+ + H2O
сокращенное ионное уравнение (суть реакции)
12.
4. Растворы кислот реагируют соснованиями - реакция нейтрализации
кислота + основание → соль + вода
HCl + NaOH → NaCl + H2O
молекулярное уравнение реакции
H+ + Cl- + Na+ + OH- → Na++ Cl- + H2O
полное ионное уравнение
H+ +OH- → H2O
сокращенное ионное уравнение (суть реакции)
13.
Задание:Составьте уравнения возможных реакций:
1. серной кислоты и Fe(ОН)3 →
2. соляной кислоты и Ва(ОН)2→
3. сернистой кислоты и NаОН →
Не забудьте порядок действий:
составить формулу соли по валентности металла
и кислотного остатка;
расставить коэффициенты.
14.
5. Растворы кислот реагируют с солямислабых, летучих кислот
кислота 1 + соль 1 → соль 2 + кислота 2
2HCl + K₂CO3 → 2KCl
+ H₂O + CO₂ ↑
молекулярное уравнение реакции
2H++2Cl-+2K++CO32-→2K++2Cl-+H₂O+ CO₂↑
полное ионное уравнение
…
сокращенное ионное уравнение (суть реакции)
15.
Задание:Составьте уравнения возможных реакций:
1.
2.
3.
соляная кислота + FeS →
азотная кислота + Na2SiO3 →
серная кислота + K2CO3→
16.
Особенности взаимодействия концентрированнойсерной и азотной кислот с металлами
Азотная кислота:
Fe + 6HNO3 = Fe(NO3)3 + 3NO2↑ + 3H2O
Азотная кислота не реагирует с Pt, Au
Азотная кислота пассивирует Al, Cr, Fe
17.
Особенности взаимодействия концентрированнойсерной и азотной кислот с металлами.
Серная кислота:
Серная кислота не реагирует с Pt, Au
Серная кислота пассивирует Al, Cr, Fe
18.
Правила разбавления серной кислоты.!!! разбавление концентрированной серной
кислоты сопровождается сильным разогревом, поэтому
кислоту следует добавлять в воду !!!в воду.
Сначала вода,
потом кислота,
Иначе случится
большая беда
19.
Применение серной кислотыОчистка
Металлургия
нефтепродуктов
H2SO4
Производство
солей и кислот
Производство
минеральных
удобрений
Синтез красителей и
лекарственных веществ
20.
Домашнее задание:Напишите реакции нейтрализации между кислотами и
основаниями, в результате которых получаются
следующие соли: Al2(SO4)3, Nа2CO3, Fe(NO3)3, Mg3(PO4)2,
PbS, Li2SO4.



















 Химия
Химия








