Похожие презентации:
Железо и его свойства
1. Тема урока: «Железо и его свойства»
2. Цель урока:
Обобщить,систематизировать,
развить знания
о строении
металлов, свойствах металлов и их
важнейших
соединений,
рассмотреть
их
взаимообусловленность
3. Третий лишний Щелочные металлы
CaNa
Li
4. Третий лишний Щелочноземельные металлы
ВаRa
К
5. Мои соседи
Be
Na
Mg
Ca
Al
6. Мои соседи
Be
Na
Mg
Ca
Al
7. Крестики-нолики
БОКСИТАЛМАЗ
МРАМОР
МЕЛ
КОРУНД
ИЗВЕСТНЯК
ГРАФИТ
ПОВАРЕННАЯ
СОЛЬ
АЛЮМОСИЛИКАТЫ
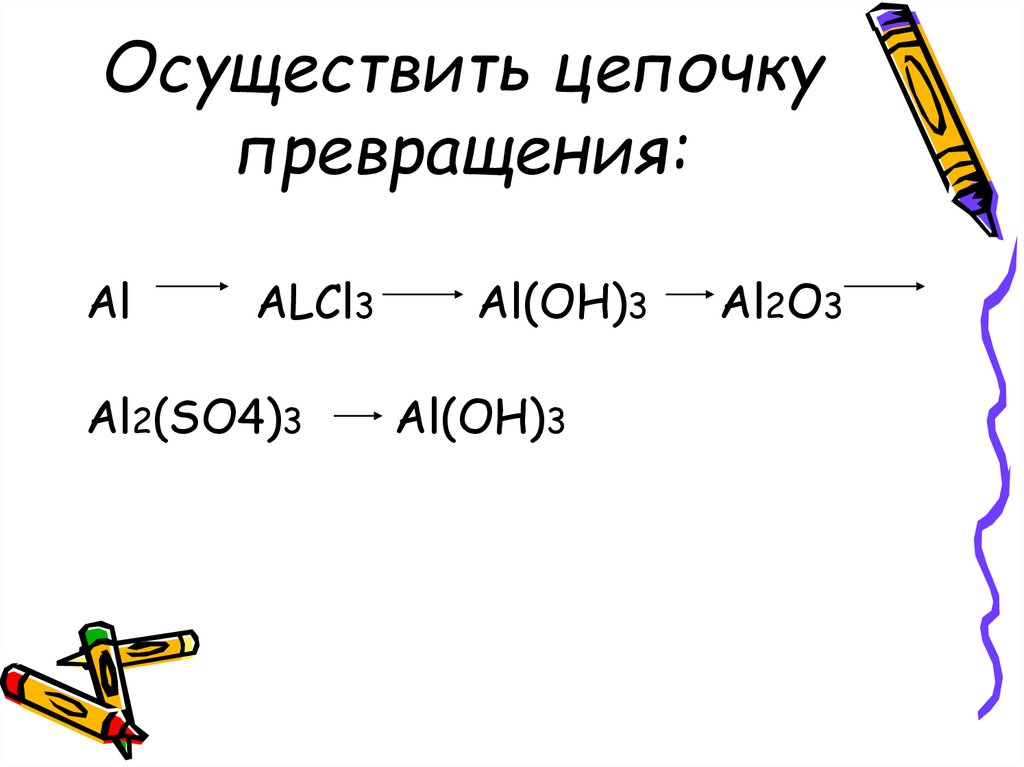
8. Осуществить цепочку превращения:
AlALCl3
Al2(SO4)3
Al(OH)3
Al(OH)3
Al2O3
9. Проверка:
2Al + 6HCl
2AlCl3 + 3H2
AlCl3 + 3NaOH
3NaCl + Al(OH)3
2Al(OH)3
Al2O3 + 3H2O
Al2O3 +3H2SO4
Al2(SO4)3 + 3H2O
Al2(SO4)3 + 6NaOH
2Al(OH)3 +
3Na2SO4
10. План изучения нового материала:
1. Строение атома
2. Нахождение железа в природе
3. Физические свойства железа
4. Химические свойства железа
11. 1. Строение атома железа:
Fe + 262)8)14)2
Степени окисления:
0
Fe
+2 FeО
+3 Fe2О3
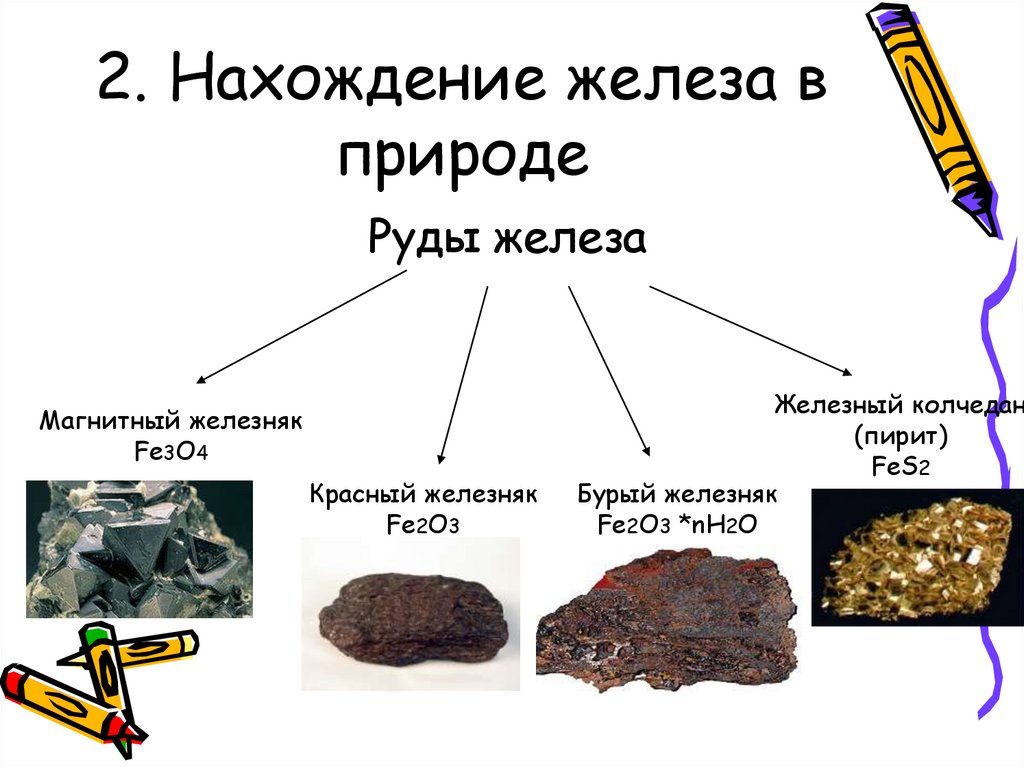
12. 2. Нахождение в природе
13. 2. Нахождение железа в природе
Руды железаМагнитный железняк
Fe3O4
Красный железняк
Fe2O3
Железный колчедан
(пирит)
FeS2
Бурый железняк
Fe2O3 *nH2O
14. 3. Физические свойства железа
1. Серебристо-белый блестящий металл
2. Температура плавления 1538ºС
3. Пластичность 7,87 г/см3
4. Пластичный (куется, прокатывается,
штампуется)
• 5. Намагничивается и размагничивается
15. 4. Химические свойства железа
• 1. Взаимодействие с простымивеществами
• Опыт 1 Горение железа
3Fe + 2O2
Fe3O4
(железная окалина)
16. 4. Химические свойства железа
• 1. Взаимодействие с простымивеществами
• Опыт 2 Взаимодействие железа с
серой
Fe + S
FeS
(сульфид железа II)
17. 4. Химические свойства железа
• 2. Взаимодействие со сложнымивеществами
• Опыт 3 Взаимодействие железа с
соляной кислотой
Fe + 2HCl
FeCl2 + H2
(хлорид железа II)
18. 4. Химические свойства железа
• 2. Взаимодействие со сложнымивеществами
• Опыт 4 Взаимодействие железа с
солями
• Fe + CuSO4
Cu + FeSO4
(сульфат железа II)
19. 4. Химические свойства железа
• 2. Взаимодействие со сложнымивеществами
Ржавление железа
4Fe + 6H2O + 3O2
4Fe(OH)3
(ржавчина)
20. Закрепление
Найди ошибку врассуждении
незадачливого химика?
21. Закрепление
• В результате какоговзаимодействия получится сульфат
железа (II)?
• SO2 + Fe(OH)2
• Fe + ZnSO4
• FeO + H2SO4
• Fe2O3 + H2SO4
22. Закрепление
• Найди ошибкуВ каких уравнениях реакции
коэффициенты расставлены верно?
• 3CO + Fe2O3
• 3Fe + 3Cl2
• Fe2O3 + 4CO
2Fe + 3CO2
3FeCl3
2Fe + 3CO2
23. Домашнее задание:
• «5» Почему не допустимоодновременное введение в внутрь
больному сульфата железа (II) и
нитрита натрия, учитывая, что среда в
желудке кислая? Рассмотреть данную
реакцию как окислительновосстановительную
• FeSO4 + NaNO2 + H2SO4
Fe2(SO4)3 + Na2SO4 + NO + H2O
24. Домашнее задание:
• «4» В настоящее время всем известно о содержаниижелеза в составе гемоглобина крови человека. Но в XIX
веке открытие этого факта французским ученым Мери
стало
сенсацией,
вызвало
небывалый
интерес
общественности и стало причиной трагических случаев.
Один
студент-химик
решил
подарить
своей
возлюбленной кольцо, сделанное из железа собственной
крови. Выпуская время от времени кровь, он получал
соединение, из которого химическим путем выделял
железо. Однако юноша погиб, так и не собрав нужного
для изготовления кольца количества железа. Что стало
причиной смерти юного возлюбленного?
25. Домашнее задание:
• «3» К раствору, содержащему 16грамм сульфата меди (II),
прибавили 12 грамм железных
опилок. Какая масса меди
выделится при этом?

























 Химия
Химия








