Похожие презентации:
Свойства металлов
1.
2.
3.
4.
• теплопроводность• электропроводность
• металлический блеск
• пластичность
• ковкость
5.
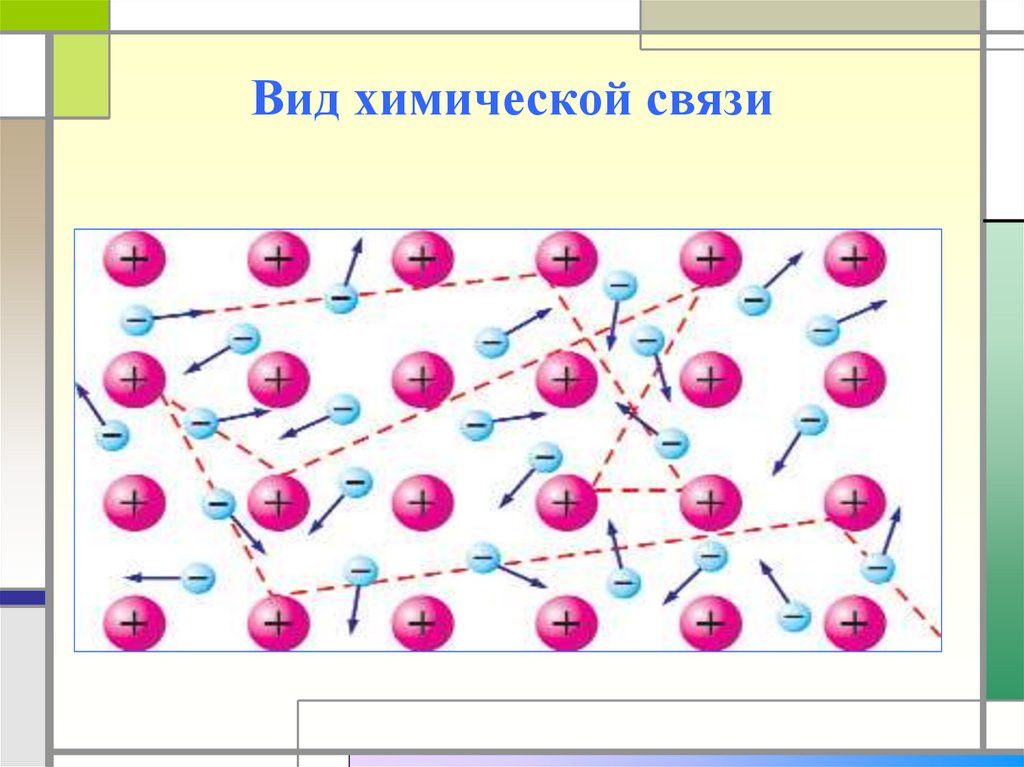
Вид химической связи6.
Электрохимический рядактивности металлов
Слева направо химическая активность атомов
ослабевает
7. Примеры взаимодействия металлов:
С простымивеществами
(неметаллами) –
кислородом O2
0
0
+2 -2
2Mg +O2 = 2MgO
0
+2
0
4 2 Mg -2ê → Mg, Mg –
восстановитель
0
-2
0
2 1 O2 + 4ê → 2O, O2 окислитель
8. – с серой S
00 t +2 -2
Fe + S = FeS
0
+2
2 1 Fe - 2ê → Fe –
восстановитель
0
-2
2 1 S + 2ê → S –
окислитель
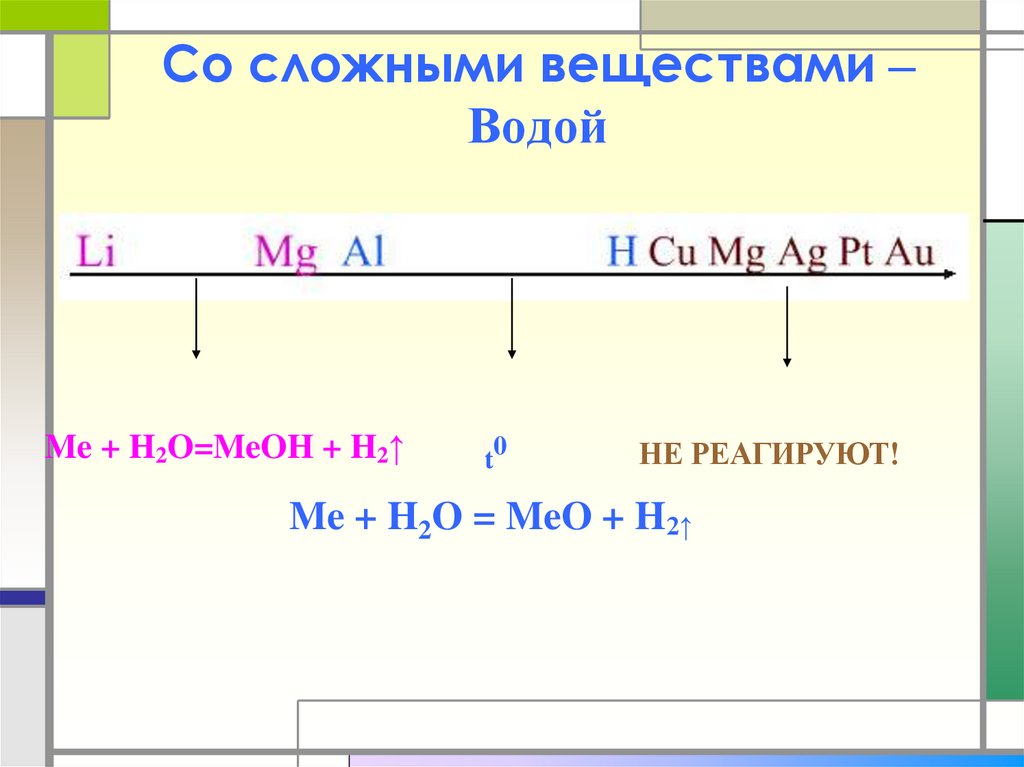
9. Со сложными веществами – Водой
Me + H2O=MeOH + H2↑t
0
НЕ РЕАГИРУЮТ!
Me + H2O = MeO + H2↑
10. Натрий в воде
0+1
+1
0
2Na + 2H2O(+ фенолфталеин)=2NaOH + H2
2
1
0
+1 0
Na - 1ê → Na, Na - восстановитель
+1
0 +1
2H + 2ê → H2, H -окислитель
11. Магний в воде
0+1 -1
+2 -2
0
Mg + H2O = MgO + H2 ↑
0
+2
0
2 1 Mg – 2ê → Mg, Mgвосстановитель
+1
0
+1
2 1 2H + 2ê → H2 , H –
окислитель
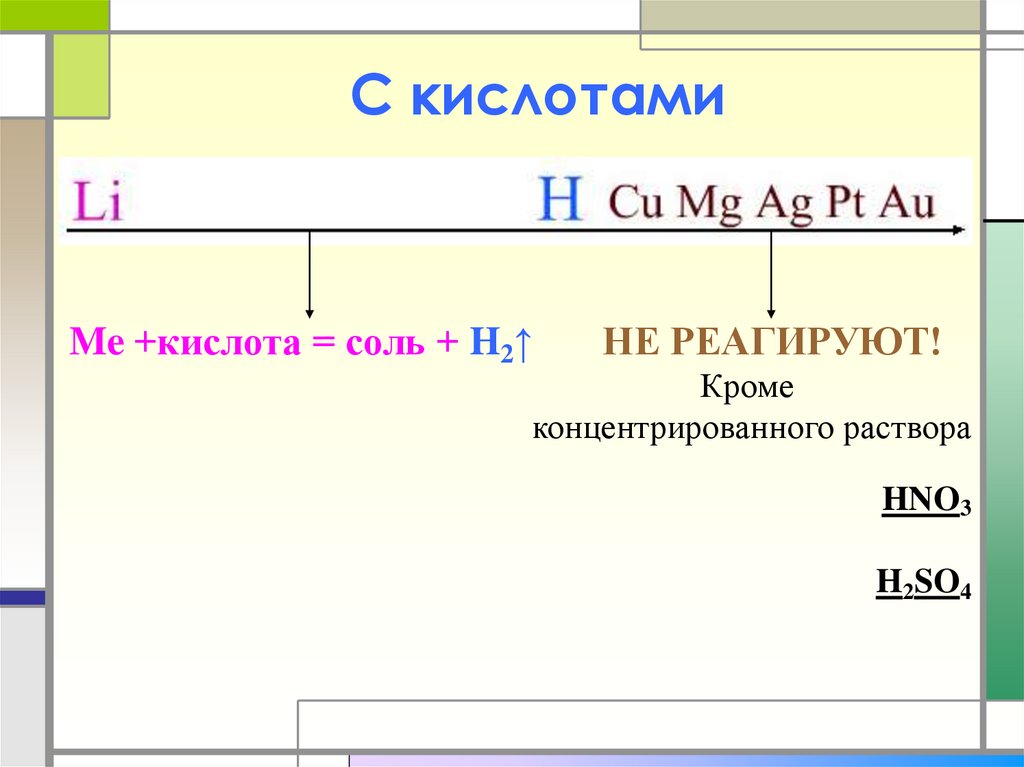
12. С кислотами
Me +кислота = соль + H2↑НЕ РЕАГИРУЮТ!
Кроме
концентрированного раствора
HNO3
H2SO4
13.
Mg+H2SO4 = MgSO4 +H2↑2+
+
2-
2+
2-
+
ПИФ Mg +2H+ SO4→Mg+ SO4+2H
2Al+3H2SO4=Al2(SO4)3 +3H2↑
3+
+
2-
3+
2-
+
ПИФ 2Al+6H+3SO4→2Al+3SO4+6H
Zn+H2SO4 = ZnSO4 + H2↑
2+
+
2-
2+
2-
+
ПИФ Zn+2H+SO4 →Zn+SO4 +2H
Cu+H2SO4 ≠
14. Zn+2HCl = ZnCl2 + H2↑ раствор
0+2
0
2 1 Zn – 2ê → Zn, Znвосстановитель
+1
21
0
+1
2H + 2ê → H2, H –
окислитель
15. 0 +1 +5 -2 +2 +4 -2 +1 -2 Cu +2HNO3(конц.) = Cu(NO3)2 + NO2 + H2O 0 +2 0 1 Cu - 2ê → Cu, Cu- восстановитель +5 +4 +5 2 N + 1ê →
0+1 +5 -2
+2
+4 -2
+1 -2
Cu +2HNO3(конц.) = Cu(NO3)2 + NO2 + H2O
0
1
0
Cu - 2ê → Cu, Cu- восстановитель
+5
2
+2
+4
N + 1ê → N,
+5
N-окислитель
16. С солями
«Предыдущий активнее, чемпоследующий»
17. 0 +2 -2 +2 -2 0 Fe +CuSO4 = FeSO4+Cu 0 +2 2 1 Fe - 2ê → Fe, Fe- восстановитель +2 0 2 1 Cu +2ê → Cu, Cu -окислитель
0+2
-2
+2 -2
0
Fe +CuSO4 = FeSO4+Cu
0
+2
2 1 Fe - 2ê → Fe, Feвосстановитель
+2
0
2 1 Cu +2ê → Cu, Cu окислитель
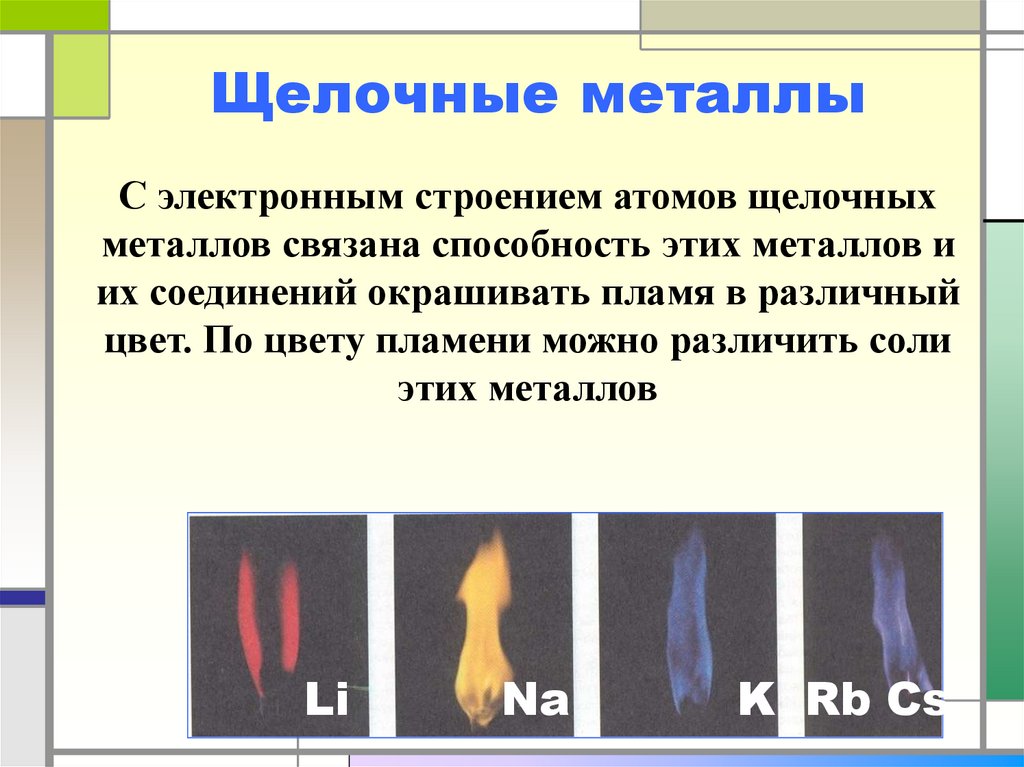
18. Щелочные металлы
С электронным строением атомов щелочныхметаллов связана способность этих металлов и
их соединений окрашивать пламя в различный
цвет. По цвету пламени можно различить соли
этих металлов
Li
Na
K Rb Cs
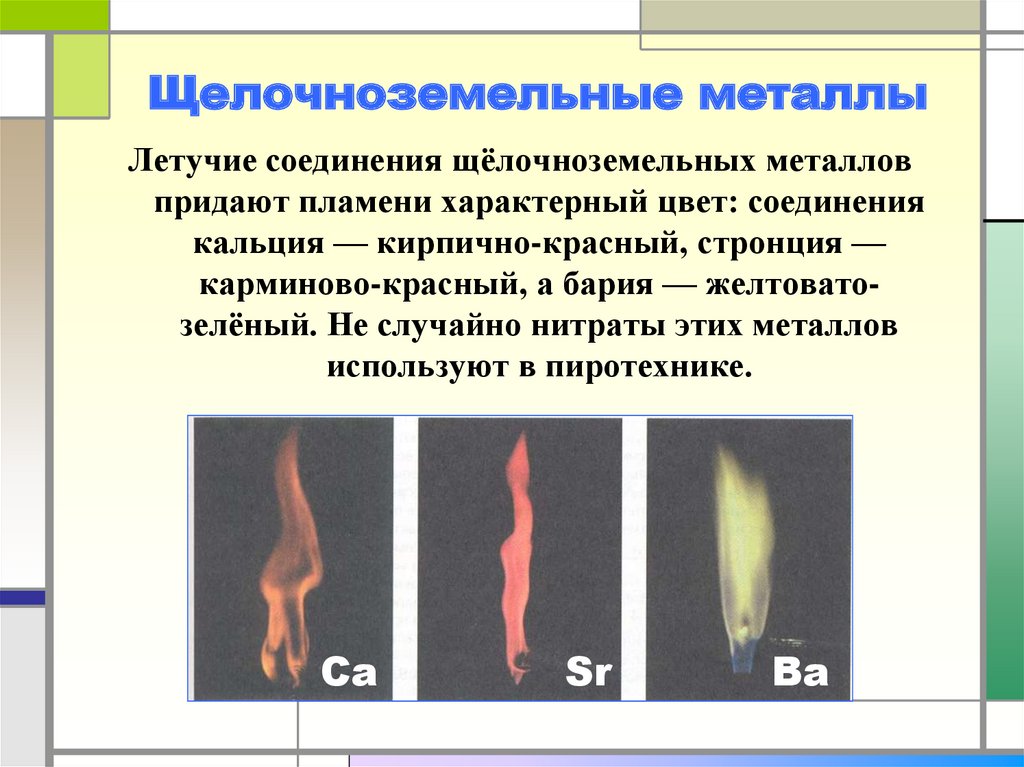
19. Щелочноземельные металлы
Летучие соединения щёлочноземельных металловпридают пламени характерный цвет: соединения
кальция — кирпично-красный, стронция —
карминово-красный, а бария — желтоватозелёный. Не случайно нитраты этих металлов
используют в пиротехнике.
Ca
Sr
Ba
20.
21. +13 Al ) ) ) 1S22S22P63S23P1
32
1
↑↓
↑
↑↓
↑↓
↑↓
S
P
↑↓
↑↓
+3
22.
Al2O3Al(OH)3
HAlO2
характерным свойством амфотерного соединения
является взаимодействие не только с кислотой….
Al(OH)3 + 3HCl→ AlCl3 +3H2O
23.
….но и с основанием (щелочью):Al(OH)3 + NaOH → NaAlO2 + 2H2O
Получение растворимого NaAlO2
(алюмината натрия)
24. Происхождение и физические свойства
В природе алюминий встречаетсятолько в соединениях (минералах):
глинозём: смеси
Бокситы с
–
каолинов
Полевой
шпат
Нефелины
Корунд
Алунит
–
песком
SiO
,
Al2O3 • H2O 2(с
(ортоклаз)
- ,
известняком
Al
O
KNa
[AlSiO
]
примесями
SiO
3 3 ) • 42Al(OH)
4
2
2
KAl(SO
4 2
3
CaCO
,
CaCO
3
2O 3 , O
3)
K2Fe
O·Al
2 3·6SiO2
магнезитом
MgCO3
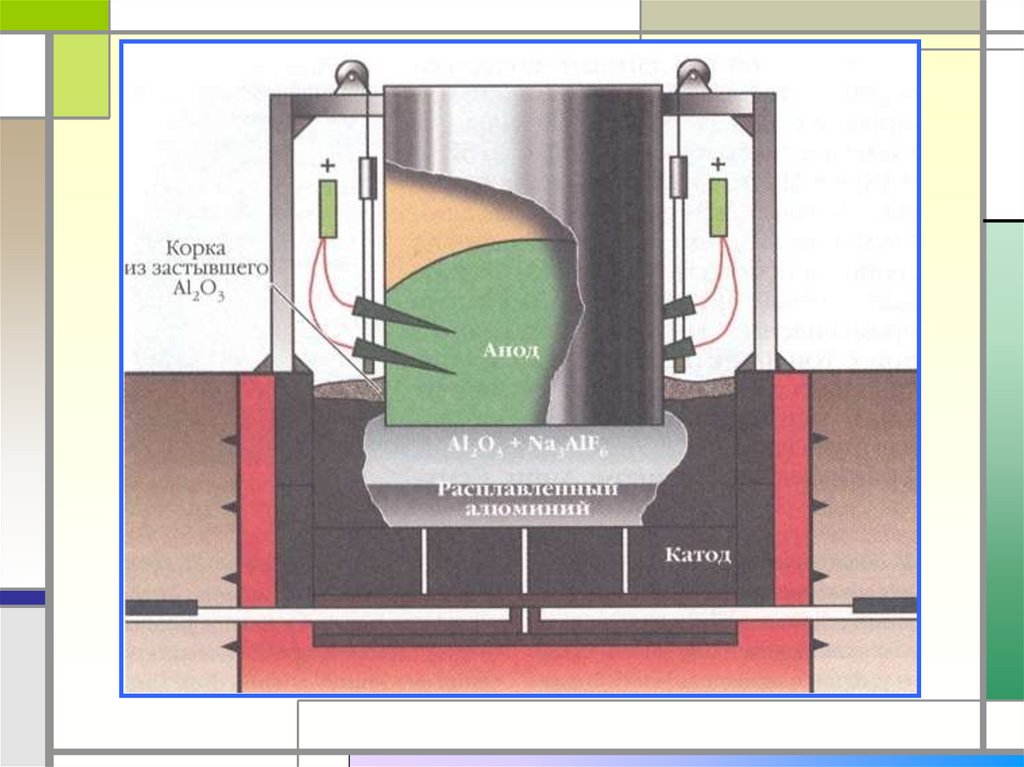
25. Получение алюминия
26. Алюмотермия
27. Применение алюминия и его сплавов.
АлюминиевыеРазличные
провода:
лекарства,при
меняемые
Фольга:при
болезнях
желудка:
28.
Химически активные металлы. Натрий.Na ) ) )
+11
2 8 1
3
↑
2
↑↓
↑↓
1
↑↓
p
s
↑↓
↑↓
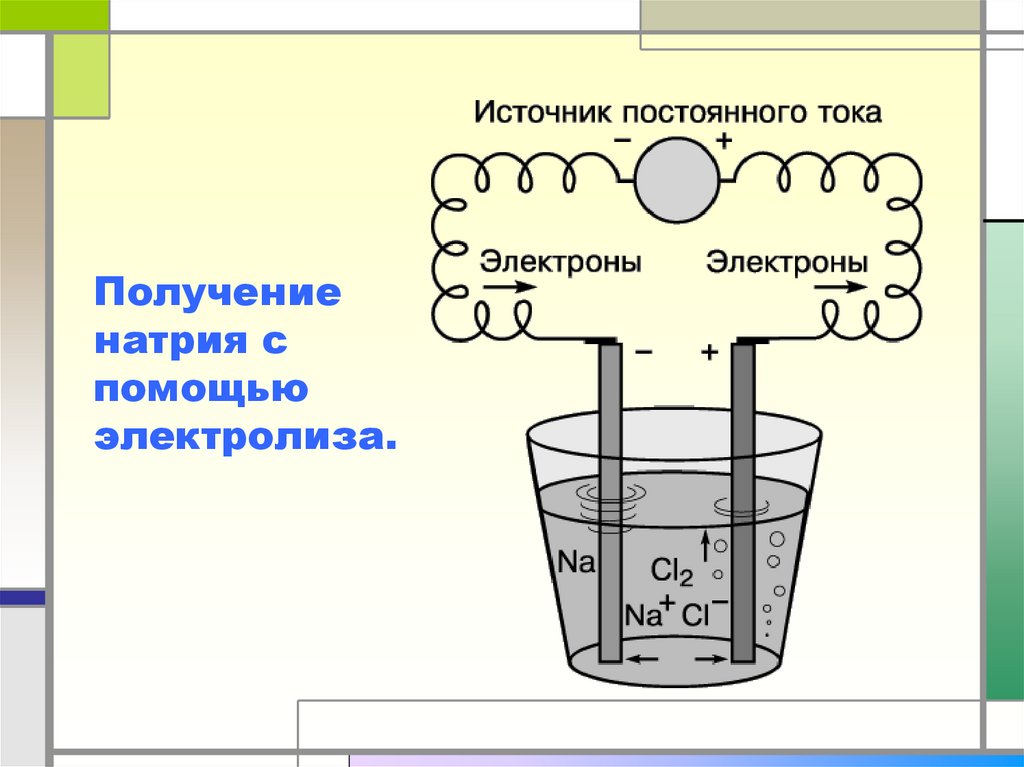
29.
Получениенатрия с
помощью
электролиза.
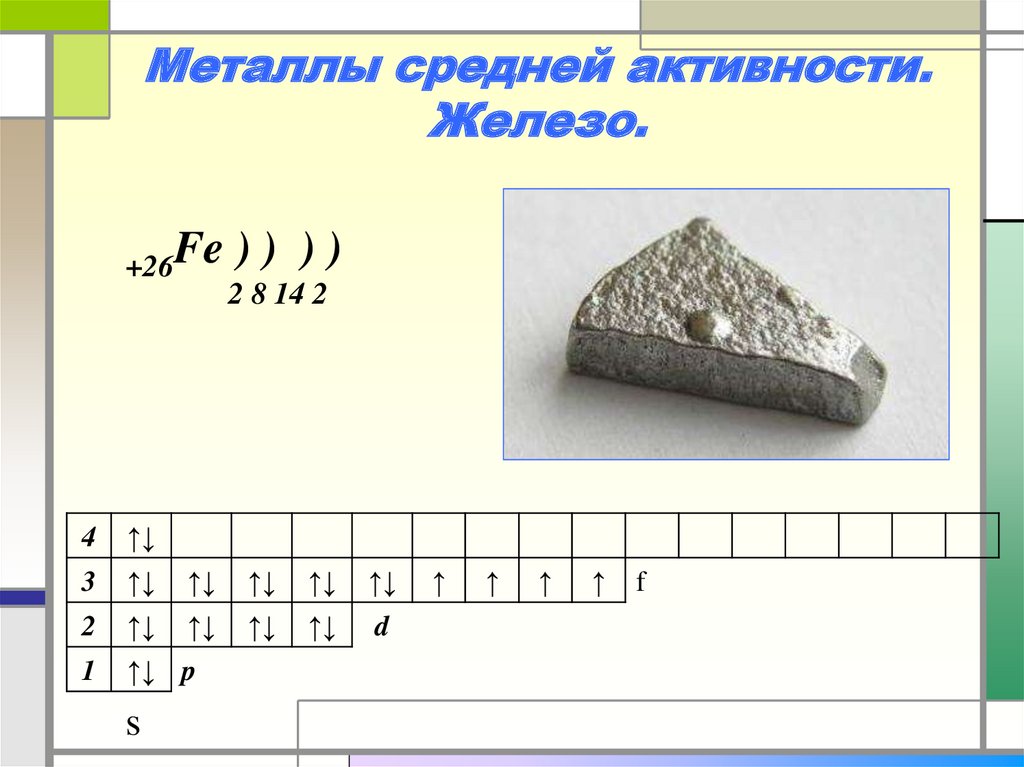
30. Металлы средней активности. Железо.
+26Fe)) ))
2 8 14 2
4
↑↓
3
↑↓
↑↓
↑↓
↑↓
↑↓
2
↑↓
↑↓
↑↓
↑↓
d
1
↑↓ p
s
↑
↑
↑
↑
f
31. Дамасская сталь
32. Извлечение железа из руд.
2C + O2 → 2CO↑3CO + Fe2O3 → 2Fe + 3CO2↑
CaCO3 → CaO + CO2↑
CaO + SiO2 → CaSiO3
33. Как горит железо?
34. Благородные металлы. Серебро.
+47Ag)) ) ))
5
↑
4
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
2 8 18 18 1 3 ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
2
↑↓
↑↓
1
↑↓
p
S
↑↓
↑↓
d
…
35.
Металлов в природе значительно больше, чемнеметаллов.
На внешнем электронном слое у атомов
металлов небольшое число электронов. Они
подвижны и легко переходят с атомов металла
к атомов неметаллов. Металлы в химических
реакциях проявляют металлические свойства –
они восстановители.
Изученные металлы I-III групп и железо
являются активными и в электрохимическом
ряду напряжений находятся левее водорода.
Следовательно, они могут вытеснять водород
из воды или раствора кислот.
Металлы – основной конструкционный
материал техники. Железный век
продолжается!


























 Химия
Химия








