Похожие презентации:
Бактериоскопические (микроскопические) методы исследования. Техника приготовления мазка
1.
Вопросы для самоконтроля1. Что такое морфологические свойства микроорганизмов?
2. Строение микробной клетки
3. Виды красителей, их классификация по цвету и рН
4. Понятие о фиксации мазка ее назначение
5. Понятие о простом и сложном методах окраски
6. Виды микроскопии
7. Понятие о темнопольной и фазово - контрастной микроскопии
8. Понятие о разрешающей способности микроскопа
9. микроскопия под иммерсией (объектив?)
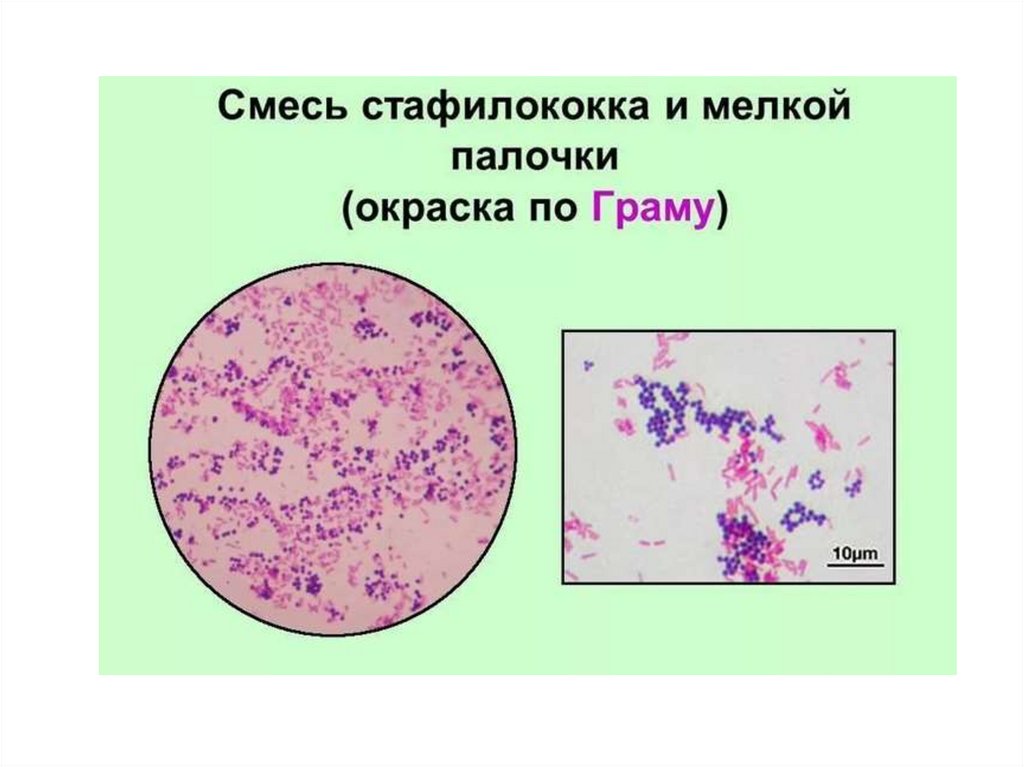
10. Метод окраски по Грамму – наизусть
11. функции клеточной стенки
12. Строение клеточной стенки Гр+ и Гр- микроорганизмов
13. основное вещество клеточной стенки
14. микроорганизмы без клеточной стенки. Понятие о L- формах
2.
Бактериоскопические(микроскопические) методы
исследования.
Техника приготовления мазка.
3.
Техника безопасности в кабинете(лаборатории) микробиологии
Работа с заразным материалом требует особой тщательности и соблюдения правил
личной и общественной безопасности при ее выполнении
В помещении лаборатории необходимо строго соблюдать чистоту и порядок. На
рабочем столе не должно быть никаких посторонних предметов. Запрещается
прием пищи, излишние разговоры, суета
Работа обязательно проводится в халате, шапочке, сменной обуви
Каждый студент имеет в лаборатории свое постоянное рабочее место
Материал для работы принимает дежурный по бригаде у лаборанта и раздает
студентам в присутствии преподавателя
В начале занятия необходимо записать в тетрадь дату, номер, тему занятия, план
выполняемой работы. В процессе работы делаются записи и зарисовки .
Все предметы, использованные при работе с живой культурой, обезвреживаются
В конце занятия студенты сдают весь материал дежурному по бригаде, а он
лаборанту или преподавателю
В конце занятия студент должен:
- привести в порядок свое рабочее место
- сдать микроскоп, материал дежурному
- вымыть руки дез. раствором, а затем мылом
- представить преподавателю для подписи тетрадь
4.
Правила работы со спиртовкой• Заправленную спиртовку хранят плотно закрытой притертым
колпачком, чтобы предотвратить испарение спирта с фитиля
• При зажигании спиртовки нужно снять колпачок и поджечь
фитиль спичкой. При этом нельзя сдвигать держатель фитиля,
т.к. пламя проскочит внутрь спиртовки, что вызовет сильную
вспышку и разбрызгивание горящего спирта
• Нельзя зажигать спиртовку от другой уже горящей спиртовки,
т.к. при этом может сдвинуться держатель фитиля и вылиться
спирт
• Нельзя дуть на пламя, чтобы погасить спиртовку. Для этого
следует аккуратно закрыть спиртовку колпачком.
• Необходимо следить за тем, чтобы спиртовка не перегревалась.
Это ведет к испарению спирта и опасности взрыва
• При длительном нагревании лучше пользоваться двумя
спиртовками
• Не следует при работе наклонять голову над спиртовкой, т.к. при
накоплении паров спирта под держателем фитиля может
происходить самопроизвольное вспыхивание
5.
Правила работы с живойкультурой
• Главное при посеве живой культуры – это оградить посев от
посторонних микробов и распространение культуры
микроорганизма с питательной среды или материала во внешнюю
среду
• Работать следует быстро, но без резких движений, усиливающих
колебания воздуха
• Во время посевов нельзя разговаривать, перемещаться по
лаборатории
• Вся посуда и оборудование, подвергшиеся обсеменению во время
работы с культурой, обрабатываются на месте путем
фломбирования в пламени спиртовки или сброса в емкость с дез.
средством
• По окончанию посевов рабочие поверхности столов подвергаются
дезинфекции, обрабатываются руки
• Лабораторная посуда с посевами помещается в термостат:
пробирки в штативе, а чашки Петри переворачивают дном вверх
• Использование материалов и средств личной гигиены,
раздражающих кожу рук, запрещается
6.
Виды микроскопииРазрешающая способность микроскопа — это способность выдавать чёткое раздельное
изображение двух близко расположенных точек объекта. Степень проникновения в
микромир, возможности его изучения зависят от разрешающей способности прибора.
Световая
• Темнопольная
• Фазовоконтрастная
• Иммерсионная
Электронная
Люминесцентная
• Вместо пучка светанаправленный поток
электронов
• Изучение строения вирусов
• Основана на способности
люминисцировать=светиться
• Используют спец. красители
7.
ЭТАПЫ ПРИГОТОВЛЕНИЯПРЕПАРАТА
Приготовление мазка
Высушивание
Фиксация
Окрашивание
8.
Фиксация мазка• Способ:
• 1. Физический – в пламени спиртовки 3 сек.
• 2.Химический – в растворах спирта, ацетона,
смеси Никифорова (1:1 спирт и эфир)
• Назначение фиксации:
• Обеззараживание патогенных микробов
• Закрепление клеток на стекле
• Убитые микроорганизмы лучше
воспринимают красители
9.
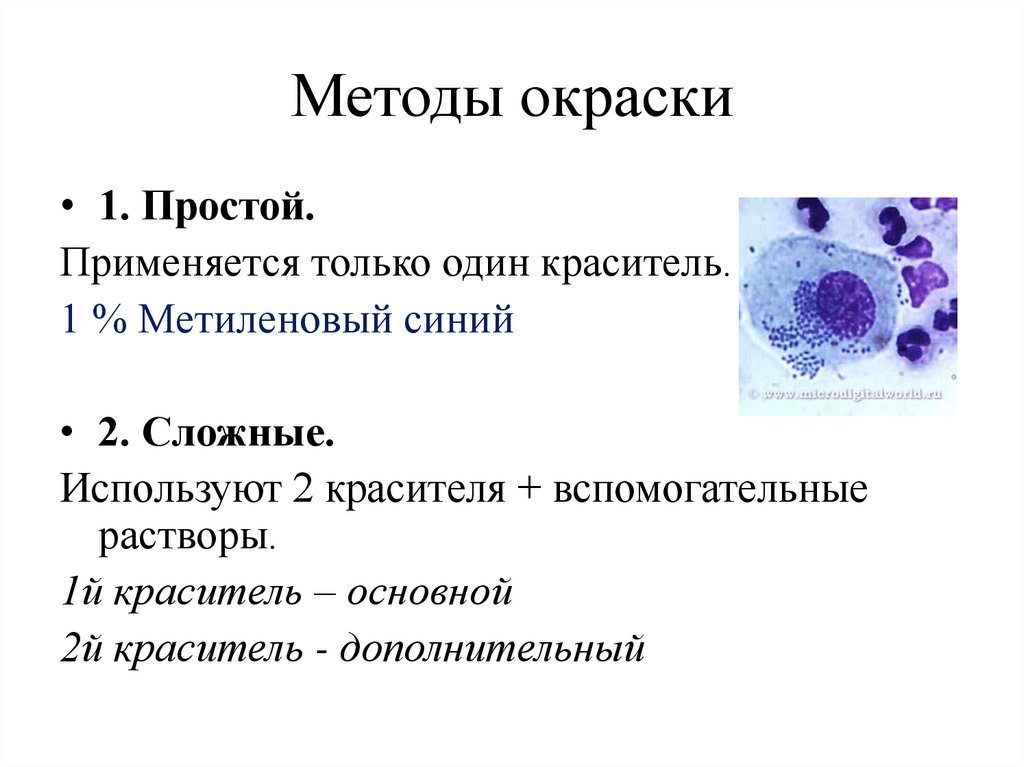
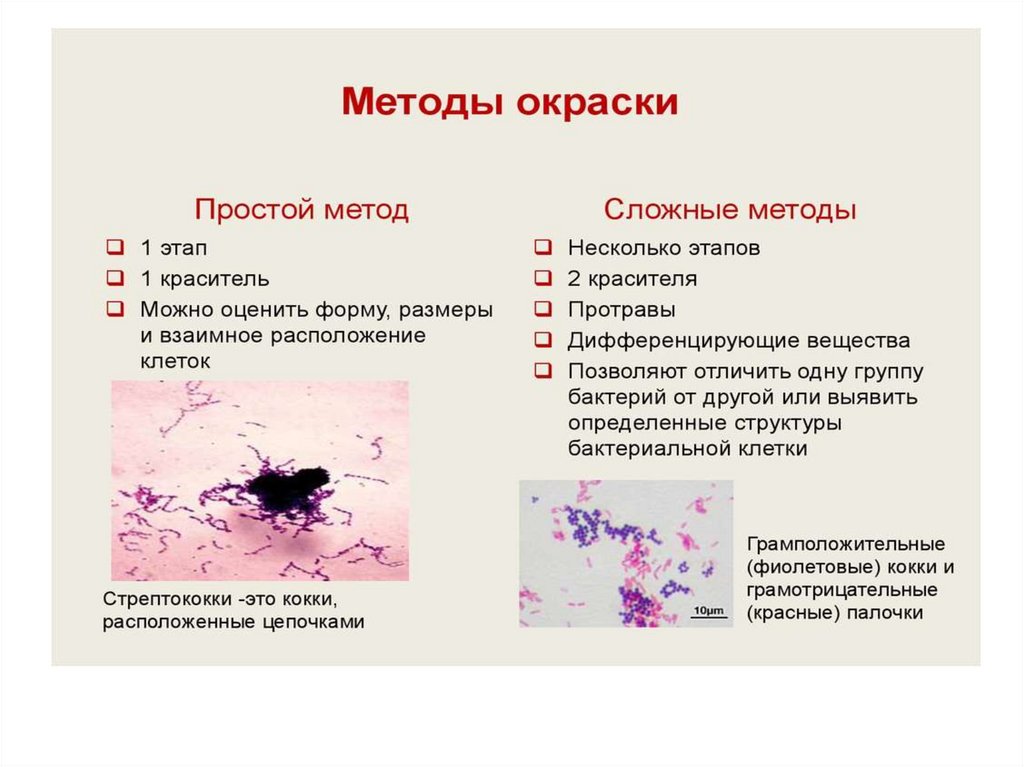
Методы окраски• 1. Простой.
Применяется только один краситель.
1 % Метиленовый синий
• 2. Сложные.
Используют 2 красителя + вспомогательные
растворы.
1й краситель – основной
2й краситель - дополнительный
10.
11.
Классификация красителей:По цвету:
• Красные (фуксин основной, фуксин кислый,
нейтральный красный, конго красный)
• Синие (метиленовый, толуединовый)
• Фиолетовые (генциановый, метиловый ,
кристаллический )
• Коричнево-желтые (везувин ,хризаедин)
• Зеленые (бриллиантовый, малахитовый)
По рН:
• Кислый
• Нейтральный
• Основной
12.
1.2.
3.
4.
5.
АЛГОРИТМ ПРИГОТОВЛЕНИЯ МАЗКА
Предметное стекло аккуратно берут за ребро и с
обратной стороны нанесения мазка наносят его границы
и номер культуры
Зажигают спиртовку, горелку, предварительно выпустив
пары спирта
Фламбируют поверхность стекла, где будет
располагаться мазок
Стекло помещают на салазки или на перевернутую ч.
Петри вблизи спиртовки
В левую руку берут пробирку со стерильным
физическим раствором (дистиллированной водой) и
помещают между 1 и 2 пальцами таким образом, что
ладонь находится под пробиркой и горлышко пробирки
направлено в зону спиртовки
13.
6. В правую берут бактериальную петлю, как карандаш7. Петлю фламбируют до покраснения сначала
горизонтально, затем вертикально (рис. №1)
8. Не выпуская петли, мизинцем правой руки прижимают
пробку физ.р-ра к ладони и осторожно вынимают е из
пробирки. Движения должны быть плавными
9. Горло пробирки обжигают в пламени и вводят петлю
10. Берут выпускной петлей физ. р-р и выносят на стекло
пару капель в границы мазка
11. Закрывают пробку, предварительно проведя через пламя
спиртовки пробку и горло пробирки одновременно
12. Ставят пробирку в штатив
13. В левую руку берут пробирку с культурой и помещают,
как и пробирку с физ. р-ром (см. пункт №5), петля в
правой руке
14. Петлю фламбируют
14.
15. Над пламенем спиртовки спокойно вынимают пробку скультуры (см. пункт №8), одновременно обжигая пробку
и горло пробирки
16. Вводят в пробирку петлю, охлаждая ее о стенки
пробирки
17. Осторожно закрывают и захватывают петлей культуру,
не повреждая агара, и вынимают петлю, не касаясь ею
стенок пробирки
18. Петлю с культурой вносят в каплю физ. р-ра и
осторожно эмульгируют, не заходя за границы мазка
19. Бактериальную петлю с остатками культуры прожигают
до покраснения в пламени спиртовки
20. Прожигают горло пробирки пробку в пламени,
одновременно. Закрывают пробирку.
21. Пробирку с культурой и петлю ставят в штатив
22. Приготовленный мазок высушивают либо на воздухе,
либо высоко над пламенем спиртовки
23. Зафиксировать мазок
15.
24.На приготовленный мазок нанестикраситель на 1 минуту
25. Смыть водой, высушить фильтровальной
бумагой.
26.На сухой мазок нанести иммерсионное
масло и микроскопировать х 90
27.Зарисовать в практической тетради
28.Вытереть фронтальную линзу марлей
29.Вытереть стекло от масла
30.Стекло сбросить в дезинфецирующий р-р
16.
• Примечание• При приготовлении мазка из культуры, выросшей на
чашке Петри необходимо:
• отметить изолированную колонию со стороны дна
чашки
• прокалить бак. петлю и остудить на воздухе
• в левую руку берут дно с ростом
• осторожно откалывают часть выделенной колонии
• дно ставят на место
• культуру выносят на стекло с физ. р-ром
• дальнейшие манипуляции согласно пунктам №18,
19, 21, 22
• При подсушивании мазка следует помнить: высокая
температура может нарушить структуру клетки
17.
18.
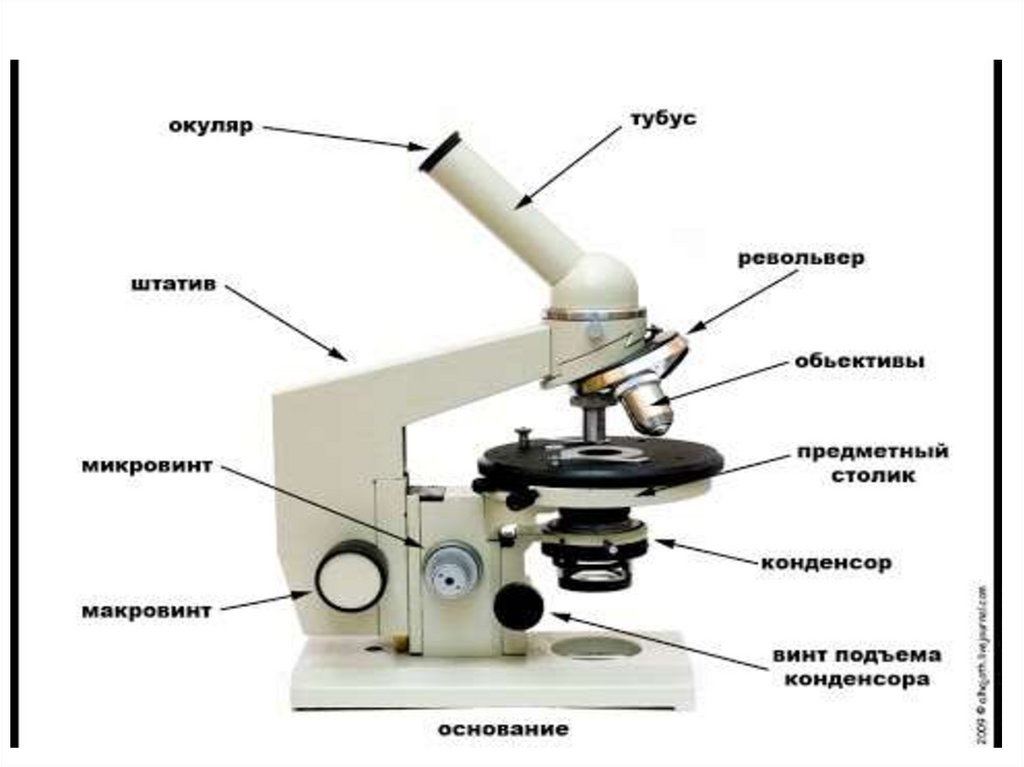
ПРАВИЛА ИММЕРСИОННОЙМИКРОСКОПИИ
Микроскоп устанавливают в рабочее положение – увеличение х 90 или х 100
Устанавливают освещение, Конденсор должен быть поднят до упора,
диафрагма открыта
3. На препарат наносят каплю иммерсионного масла
4. Препарат помещают на предметный столик и фиксируют его клеммами
5. Наблюдая сбоку, опускают тубус с объективом 90х, 100х макровинтами в
масло почти до соприкосновения с препаратом
6. Затем, глядя в окуляр (7х, 10х), макровинтом очень медленно поднимают
объектив до появления изображения и с помощью микровинта производят
окончательную фокусировку четкого изображения
7. При микроскопии определяют взаимное расположение микроорганизмов, их
размеры, форму, структуру, окраску
8. После просмотра препарата револьвер переводят на малое увеличение 8х и
только после этого препарат снимают со столика
9. Фронтальную линзу объектива протирают марлей, смоченной чистым
бензином или эфиром для удаления остатков иммерсионного масла
10. Затем опускают предметный столик (или конденсор в микроскопах с
неподвижным столиком) и накрывают микроскоп чехлом.
1.
2.

















 Медицина
Медицина Биология
Биология








