Похожие презентации:
Ферме́нты, или энзи́мы
1.
Урок по теме: «Ферменты»Остроухова Татьяна Юрьевна
учитель биологии МАОУ лицей № 17 г. Калининграда
2.
Ферменты3.
Ферме́нты, или энзи́мы(от лат. fermentum, греч. ζύμη, ἔνζυμον – закваска)
Наука о ферментах
Энзимология
Модель фермента
нуклеозид-фосфорилазы
Успехи энзимологии во второй
половине XX века привели к
тому, что в настоящее время
выделено и очищено более
2000 ферментов, которые
используются в различных
отраслях человеческой
деятельности.
4.
Будучи катализаторами, ферментыускоряют как прямую, так и обратную
реакции.
Активность ферментов
определяется их
трёхмерной структурой
5.
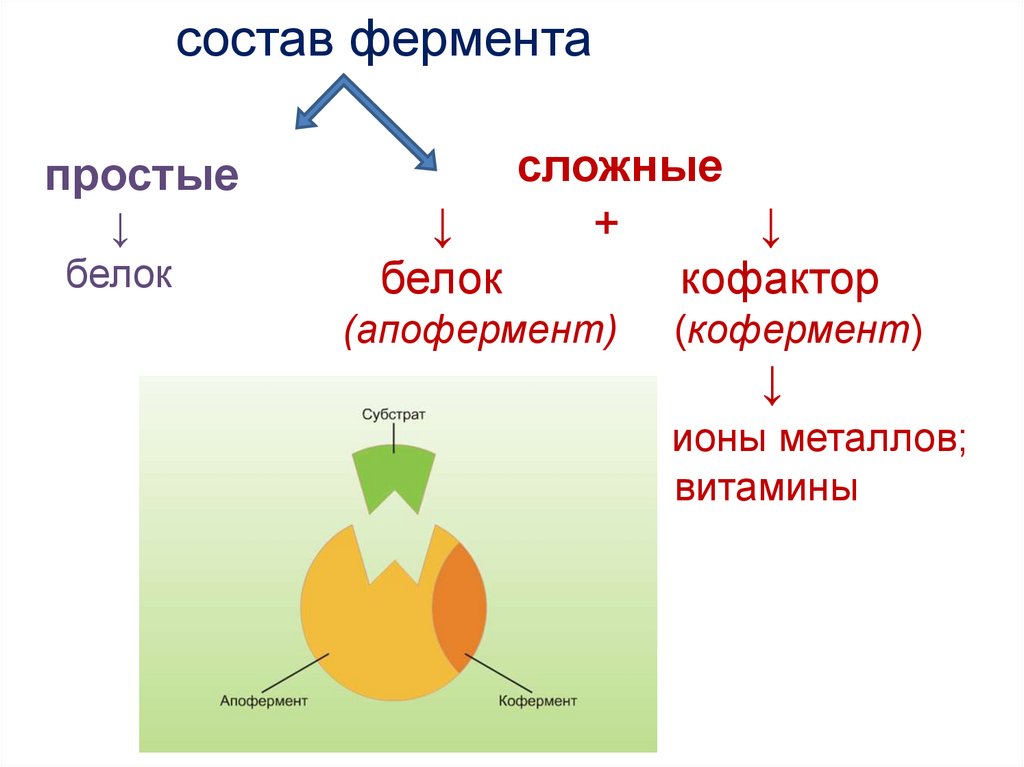
состав ферментапростые
↓
белок
сложные
↓
+
↓
белок
кофактор
(апофермент)
(кофермент)
↓
ионы металлов;
витамины
6.
Внимание!Зачем нужны витамины?
Витамины – вещества органической природы, поступающие извне или
синтезирующиеся в организме, участвуют в построении ферментов и
гормонов, которые в свою очередь, исполняют роль регуляторов
различных биохимических процессов.
7.
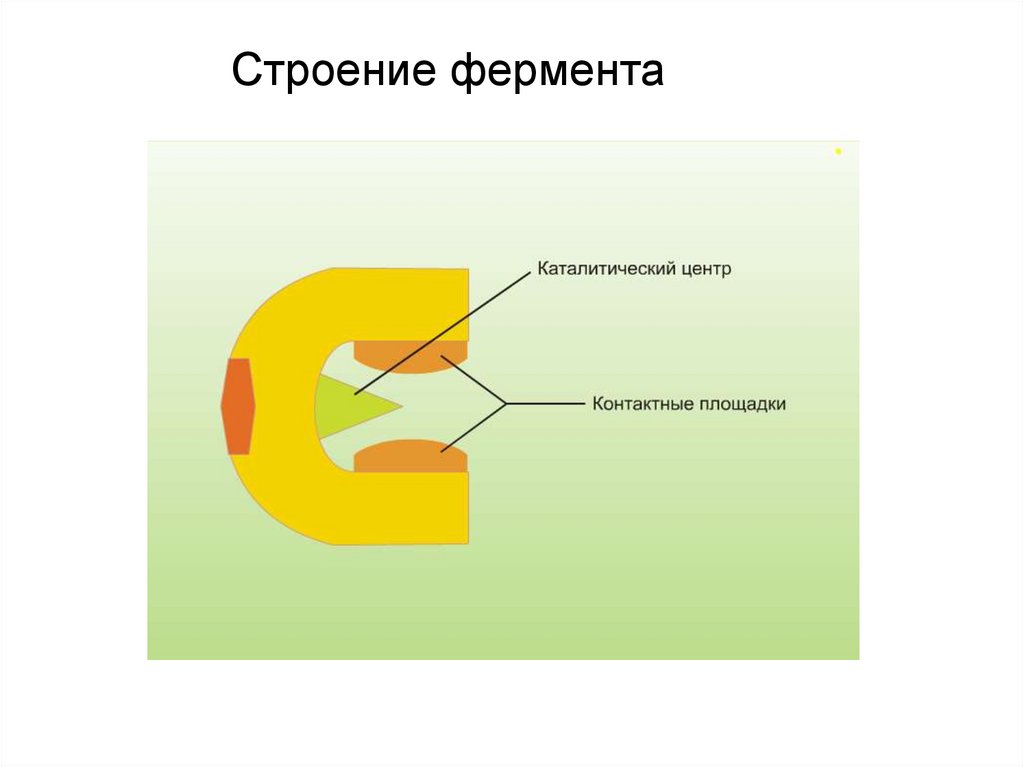
Строение фермента8.
Активный центр – уникальная комбинацияостатков аминокислот в молекуле фермента,
обеспечивающая взаимодействие с молекулой
субстрата и прямое участие в акте катализа.
В активном центре условно выделяют:
• каталитический центр – непосредственно
химически взаимодействующий с субстратом;
• связывающий центр (контактная или
«якорная» площадка) – обеспечивающий
специфическое сродство к субстрату и
формирование комплекса фермент-субстрат.
9.
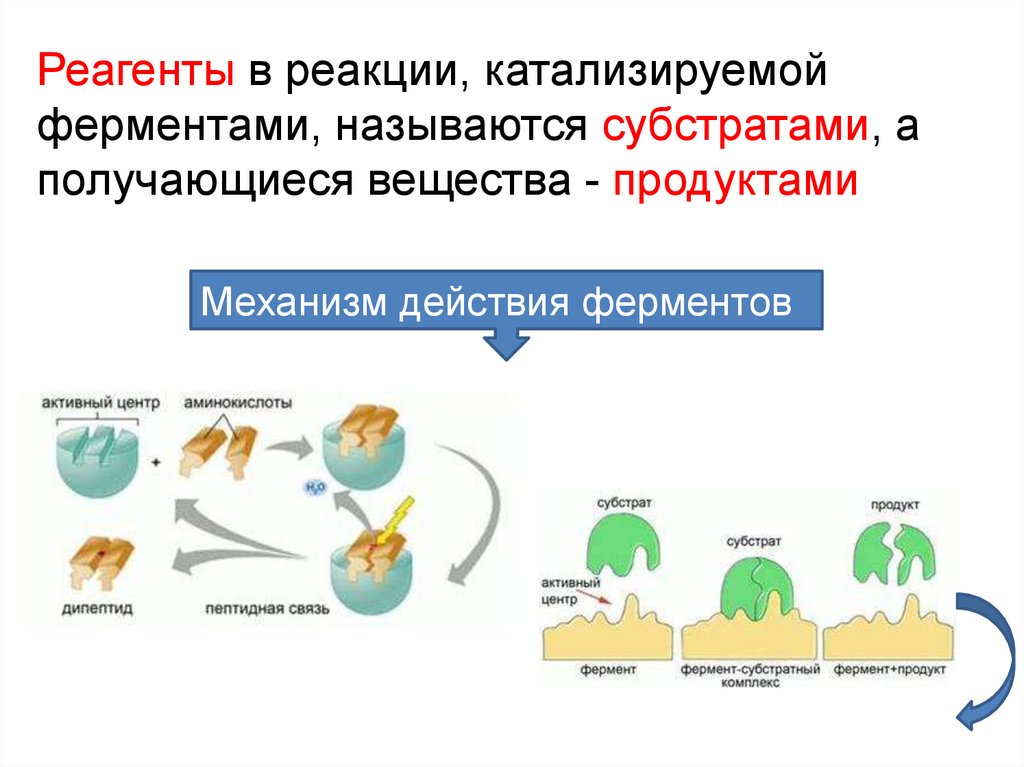
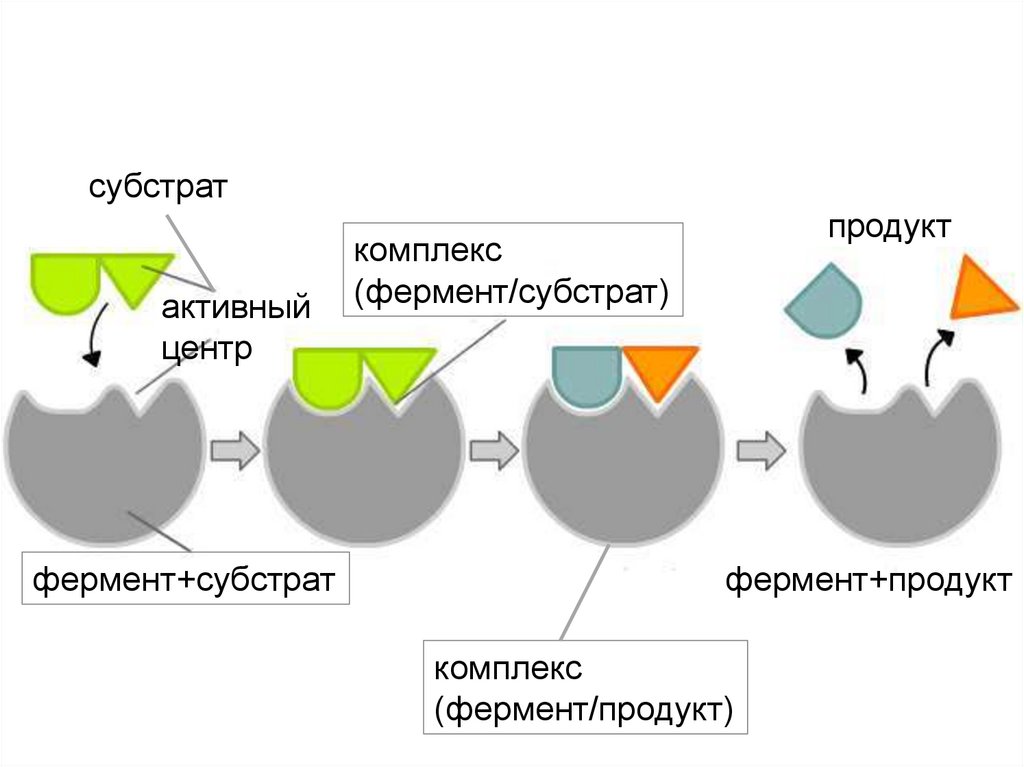
Реагенты в реакции, катализируемойферментами, называются субстратами, а
получающиеся вещества - продуктами
Механизм действия ферментов
10.
субстратактивный
центр
фермент+субстрат
продукт
комплекс
(фермент/субстрат)
фермент+продукт
комплекс
(фермент/продукт)
11.
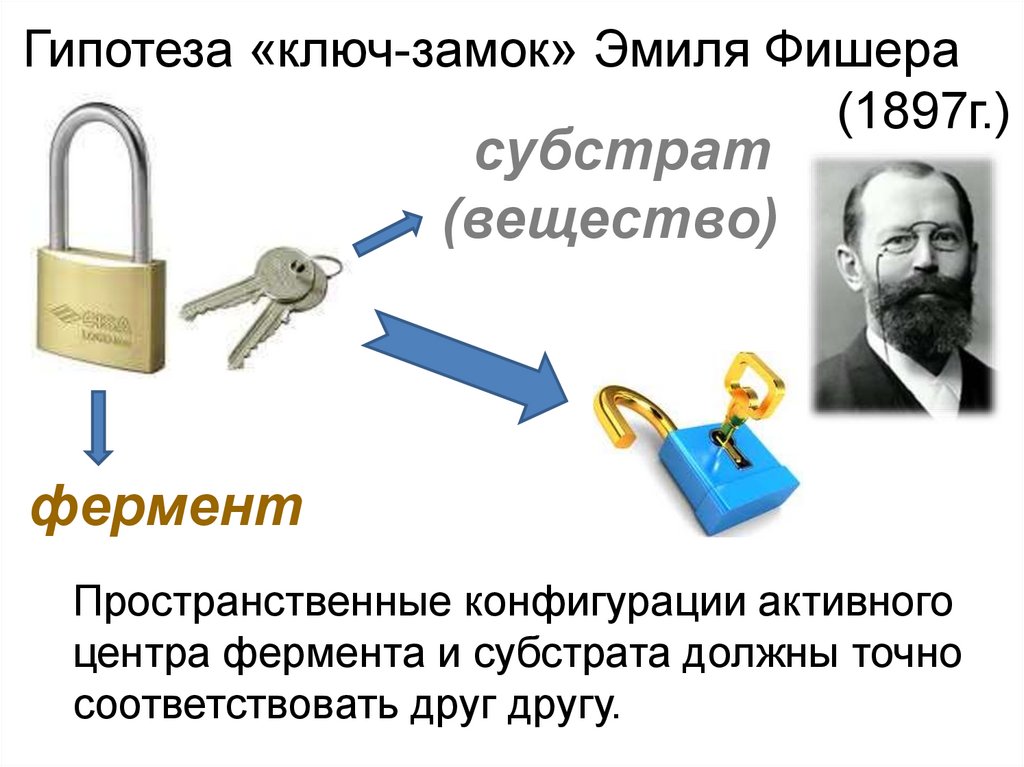
Гипотеза «ключ-замок» Эмиля Фишера(1897г.)
субстрат
(вещество)
фермент
Пространственные конфигурации активного
центра фермента и субстрата должны точно
соответствовать друг другу.
12.
Гипотеза «рука-перчатка» Даниела Кошланда(1958г.)
(гипотеза индуцированного
соответствия)
Пространственное соответствие структуры
субстрата и активного центра фермента
создается лишь в момент их взаимодействия
друг с другом.
13.
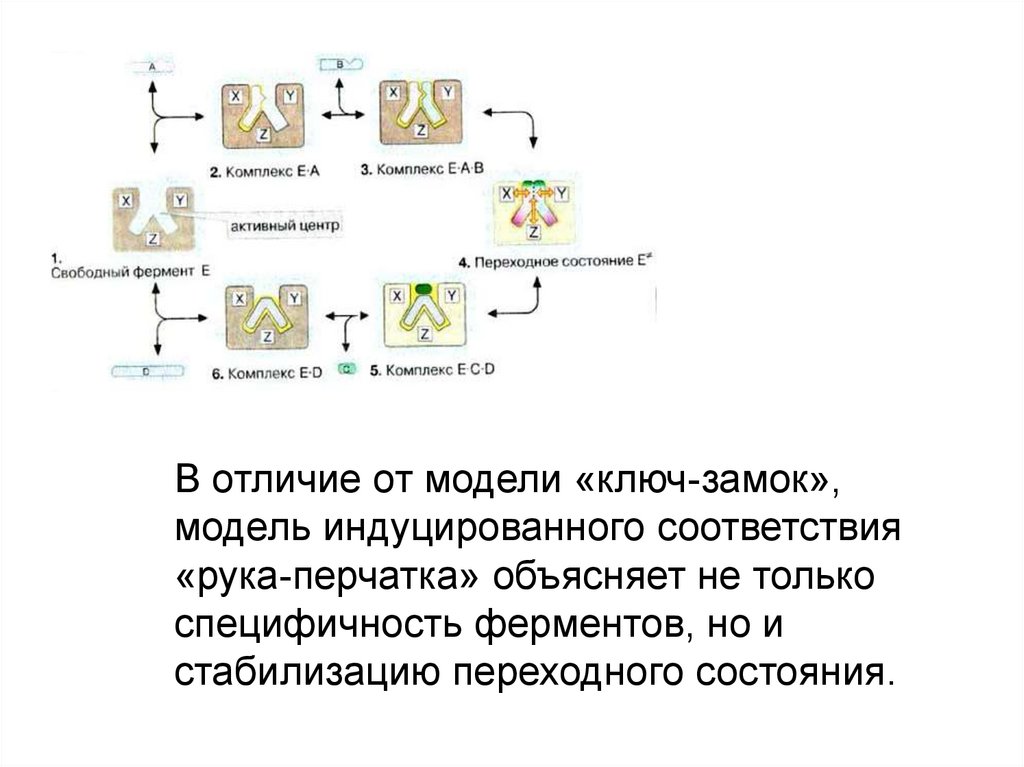
В отличие от модели «ключ-замок»,модель индуцированного соответствия
«рука-перчатка» объясняет не только
специфичность ферментов, но и
стабилизацию переходного состояния.
14.
Свойства ферментовНе расходуются в процессе катализа
(Ферменты не входят в состав конечных продуктов реакции и выходят из неё
в первоначальном виде – т.е. они не расходуются в процессе катализа.)
Избирательно действуют на вещества,
специфичны
(Каждый фермент катализирует только одну или небольшую группу
сходных реакций.)
Имеют высокую каталитическую активность
(Каталитическая активность ферментов в несколько раз выше, чем у
неорганических катализаторов.)
Проявляют активность при определённых
условиях среды
15.
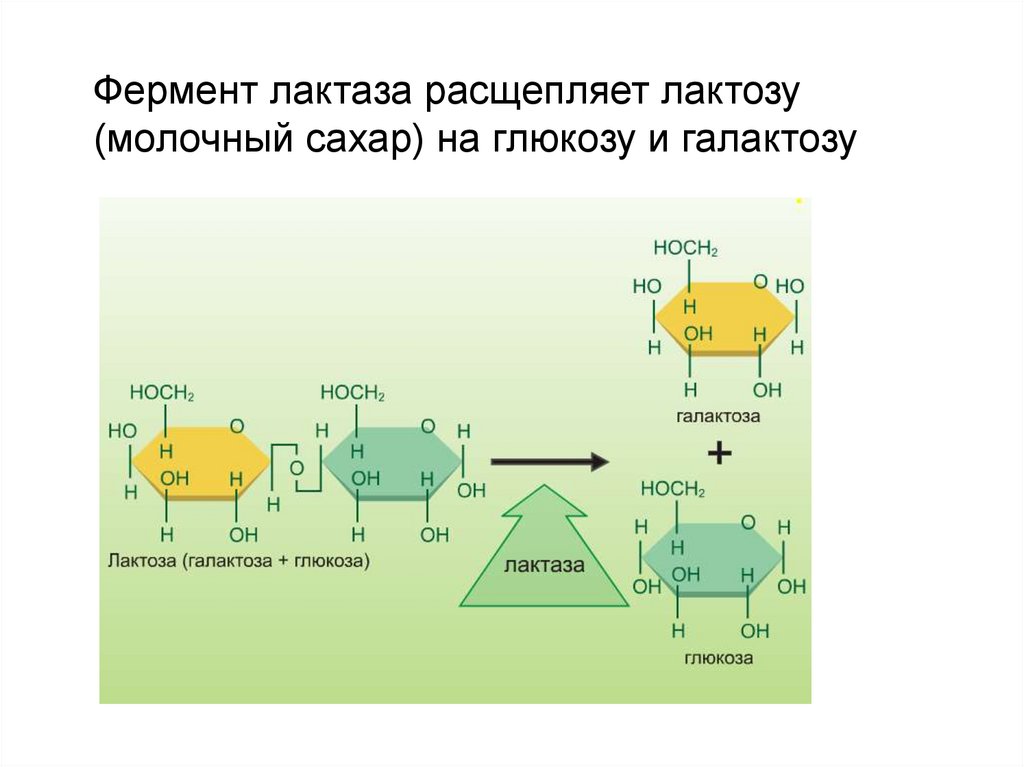
Фермент лактаза расщепляет лактозу(молочный сахар) на глюкозу и галактозу
16.
Активность ферментазависит от:
давления
кислотности среды
температуры
количества субстрата
количества продукта
количества фермента
присутствия активаторов
или ингибиторов
17.
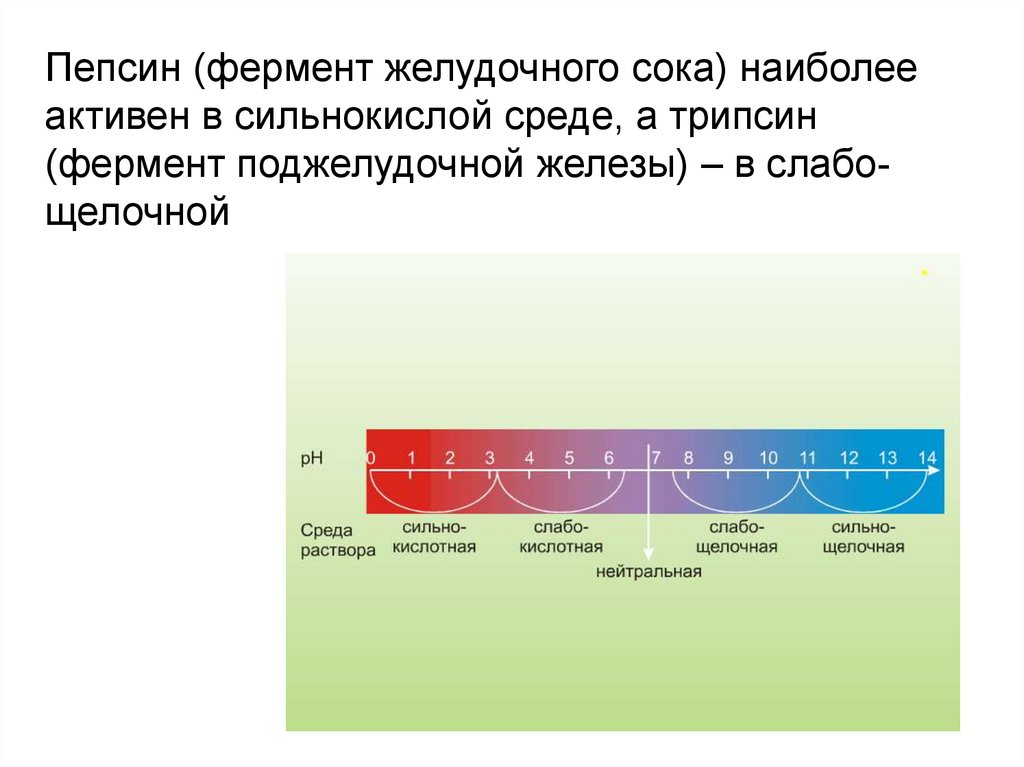
Пепсин (фермент желудочного сока) наиболееактивен в сильнокислой среде, а трипсин
(фермент поджелудочной железы) – в слабощелочной
18.
Внимание!В столовой к обеду был приготовлен винегрет,
обильно заправленный уксусом. Как будет
перевариваться в ротовой полости картофель,
имеющийся в винегрете?
Ферменты слюны проявляют свою активность при pH 6,5-7,5,
следовательно, уксус замедлит расщепление крахмала картофеля.
19.
Внимание!Почему ферменты слюны активны в ротовой
полости, но теряют свою активность в
желудке?
Для работы ферментов слюны нужна слабощелочная среда. В желудке
же среда кислая. Кислая реакция желудочного сока тормозит
ферментативную активность слюны.
20.
Внимание!Почему температура выше 40°C опасна для
жизни?
Температурный оптимум для большинства ферментов человека
составляет 37-38°С. При увеличении температуры выше 40°С происходит
денатурация фермента, сопровождающаяся изменением конформации
белка. Активность фермента снижается, а затем прекращается. Это
приводит к нарушению всего обмена веществ.Кроме того происходит
внутрисосудистое свёртывание белков крови
21.
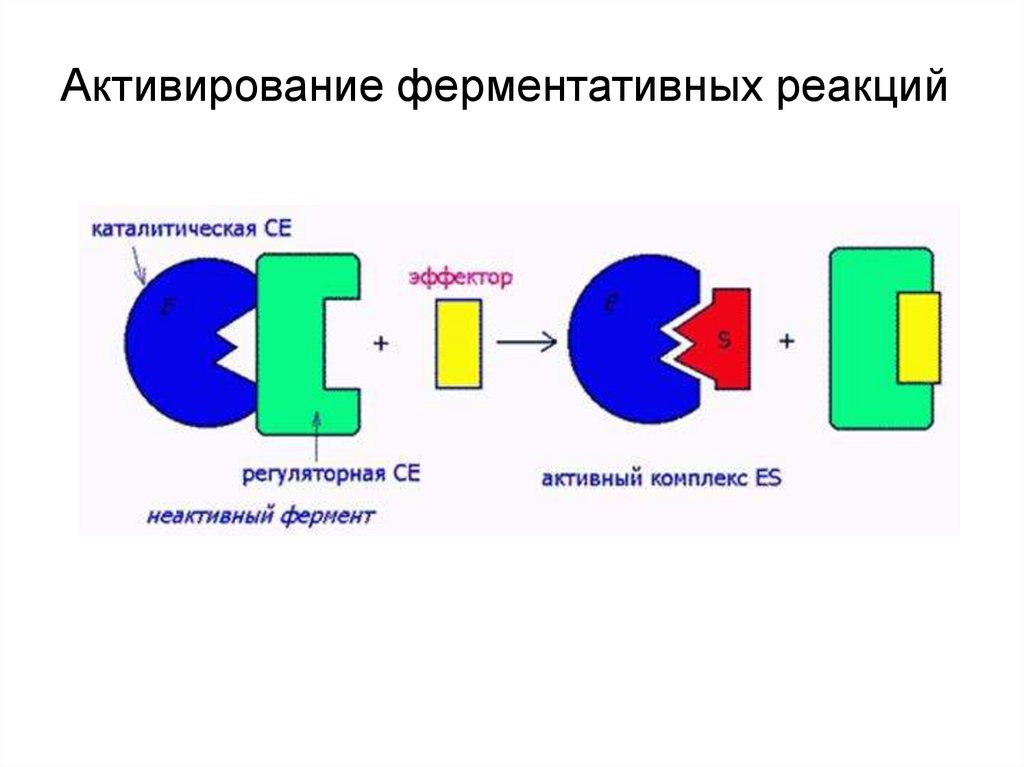
Олимпиадникам!Аллостерические ферменты – ферменты,
активность которых регулируется не только количеством
молекул субстрата, но и другими веществами,
называемыми эффекторами.
→ обладают четвертичной структурой (состоят из
нескольких полипептидных цепей);
→ имеют помимо активного центра обособленные
«аллостерические» центры (один или несколько) на
поверхности своих молекул,
→ меняют свою активность в результате нековалентного
присоединения к аллостерическому центру
специфического метаболита – эффектора
22.
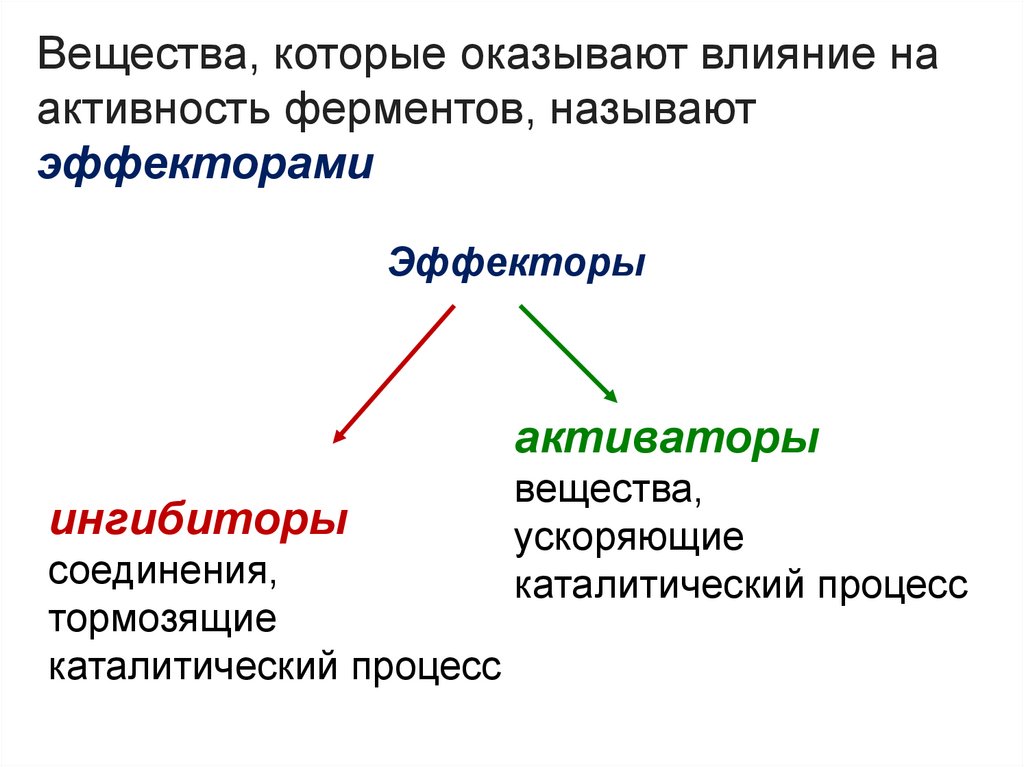
Вещества, которые оказывают влияние наактивность ферментов, называют
эффекторами
Эффекторы
активаторы
ингибиторы
соединения,
тормозящие
каталитический процесс
вещества,
ускоряющие
каталитический процесс
23.
Активирование ферментативных реакций24.
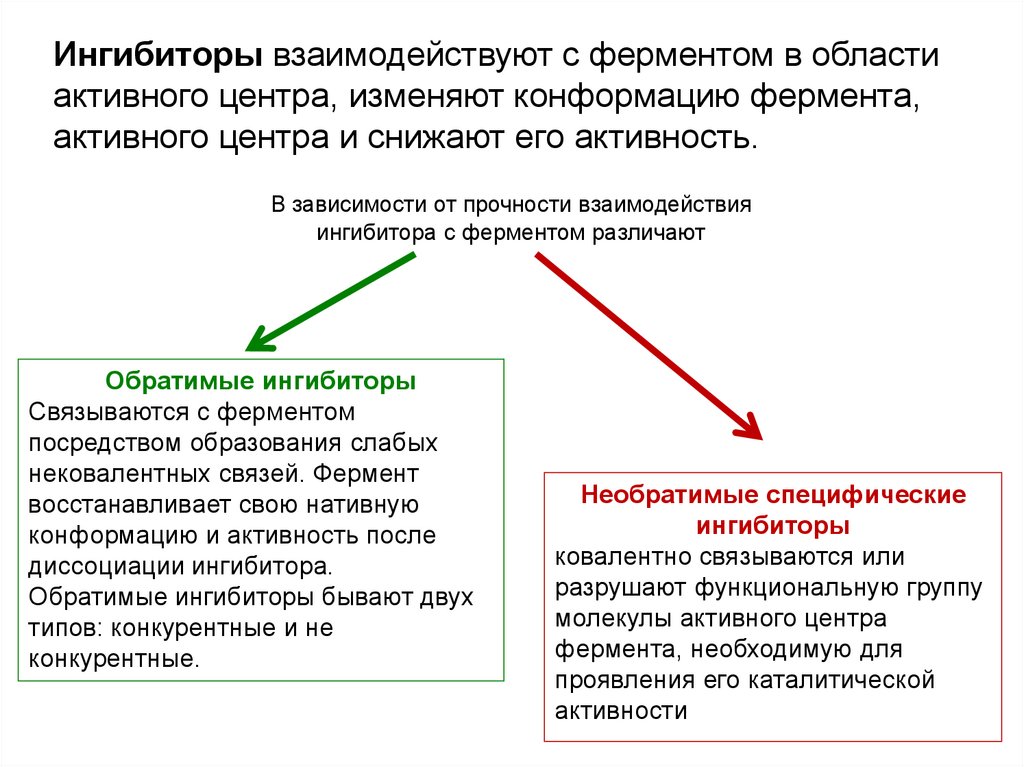
Ингибиторы взаимодействуют с ферментом в областиактивного центра, изменяют конформацию фермента,
активного центра и снижают его активность.
В зависимости от прочности взаимодействия
ингибитора с ферментом различают
Обратимые ингибиторы
Связываются с ферментом
посредством образования слабых
нековалентных связей. Фермент
восстанавливает свою нативную
конформацию и активность после
диссоциации ингибитора.
Обратимые ингибиторы бывают двух
типов: конкурентные и не
конкурентные.
Необратимые специфические
ингибиторы
ковалентно связываются или
разрушают функциональную группу
молекулы активного центра
фермента, необходимую для
проявления его каталитической
активности
25.
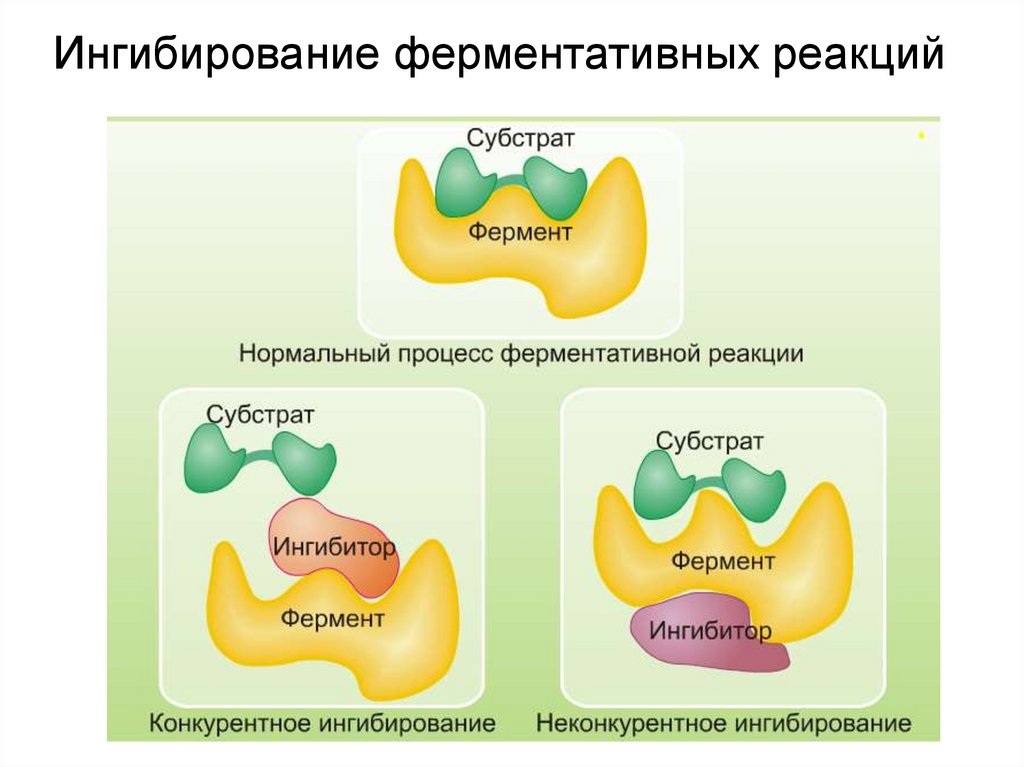
Ингибирование ферментативных реакций26.
Классификация ферментов→ Оксидоредуктазы - окисление или
восстановление (например: каталаза,
алкогольдегидрогеназа)
→ Трансферазы - перенос химических групп с одной
молекулы субстрата на другую
→ Гидролазы - гидролиз химических связей
(например, пепсин, трипсин, амилаза)
→ Лиазы - разрыв химических связей без гидролиза
с образованием двойной связи в одном из продуктов.
→ Изомеразы - структурные или геометрические
изменения в молекуле субстрата.
→ Лигазы - образование химических связей между
субстратами за счет гидролиза АТФ (например, ДНКполимераза)
27.
Обычно ферменты именуют по типукатализируемой реакции, добавляя
суффикс -аза к названию субстрата
(например, лактаза - фермент,
участвующий в превращении лактозы).
Таким образом, у различных ферментов,
выполняющих одну функцию, будет
одинаковое название. Такие ферменты
различают по другим свойствам,
например, по оптимальному рН (щелочная
фосфотаза) или локализации в клетке
(мембранная АТФаза).
28.
Функции ферментов29.
30.
Внимание!Зачем в стиральные порошки добавляют
энзимы?
Энзимы (ферменты), входящие в состав средств для стирки, расщепляют
различные молекулы загрязнений.
Энзим протеаза – выводит белковые пятна.
Липаза – жировые.
Амилаза борется с крахмальными загрязнениями.
Целлюлаза – удаляет ворсинки, приводящих к закатыванию ткани.
31.
Вспоминаем!1. Что такое фермент?
2. Как ферменты работают?
3. Как ферменты получают имена?
Назовите известные вам группы
ферментов.
4. Назовите ученых, которые внесли
особый вклад в дело изучения
ферментов.
32.
Закрепляем!Найдите предложения, в которых содержатся биологические ошибки.
Запишите номера этих предложений, а затем сформулируйте их
правильно.
1. Ферменты – это специфические белки.
2. Ферменты замедляют скорость течения биохимических
реакций в клетке.
3. Молекулы одних ферментов состоят только из белков,
другие включают белок и небелковое соединение, или
кофермент.
4. Один и тот же фермент способен катализировать
разные типы реакций с различными химическими
веществами.
5. Активность ферментов не зависит от условий среды, в
которой протекает реакция.
6. Ферменты локализуются в цитоплазме или в тех или
иных органоидах клетки.
33.
Ферменты – это жизнь!Любые действия живого организма
независимо от того, какие они будут,
обеспечиваются биохимическими реакциями,
которые не могут протекать без участия в
них ферментов!

















 Биология
Биология








