Похожие презентации:
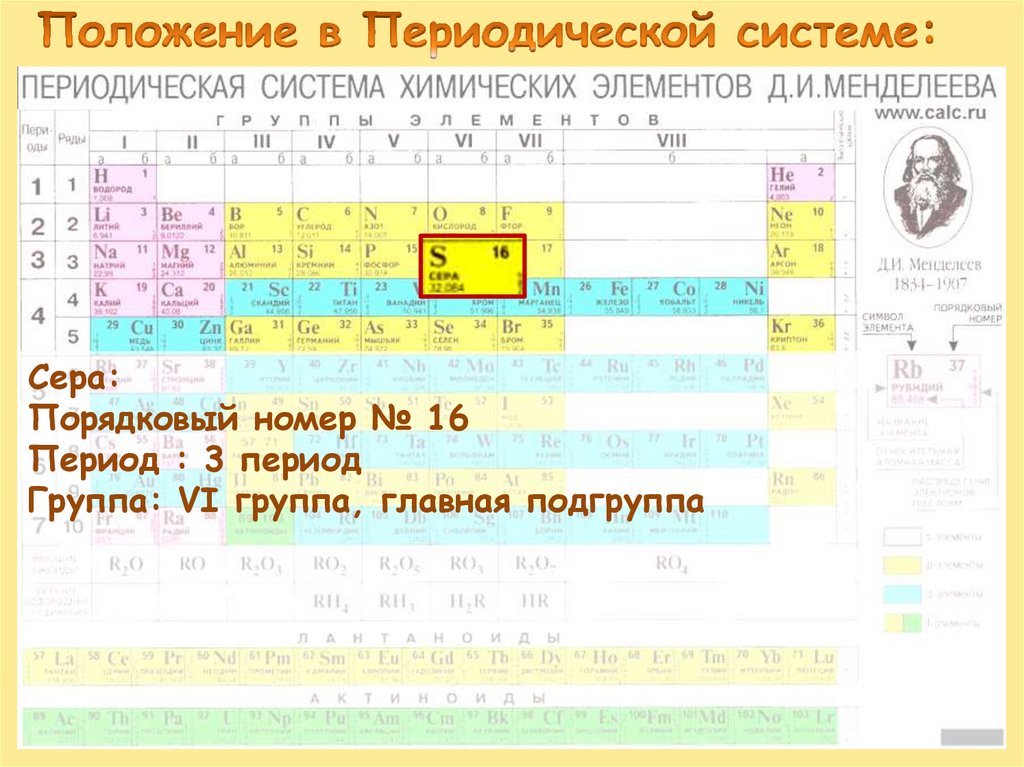
Сера: Порядковый номер № 16
1.
2.
Сера:Порядковый номер № 16
Период : 3 период
Группа: VI группа, главная подгруппа
3.
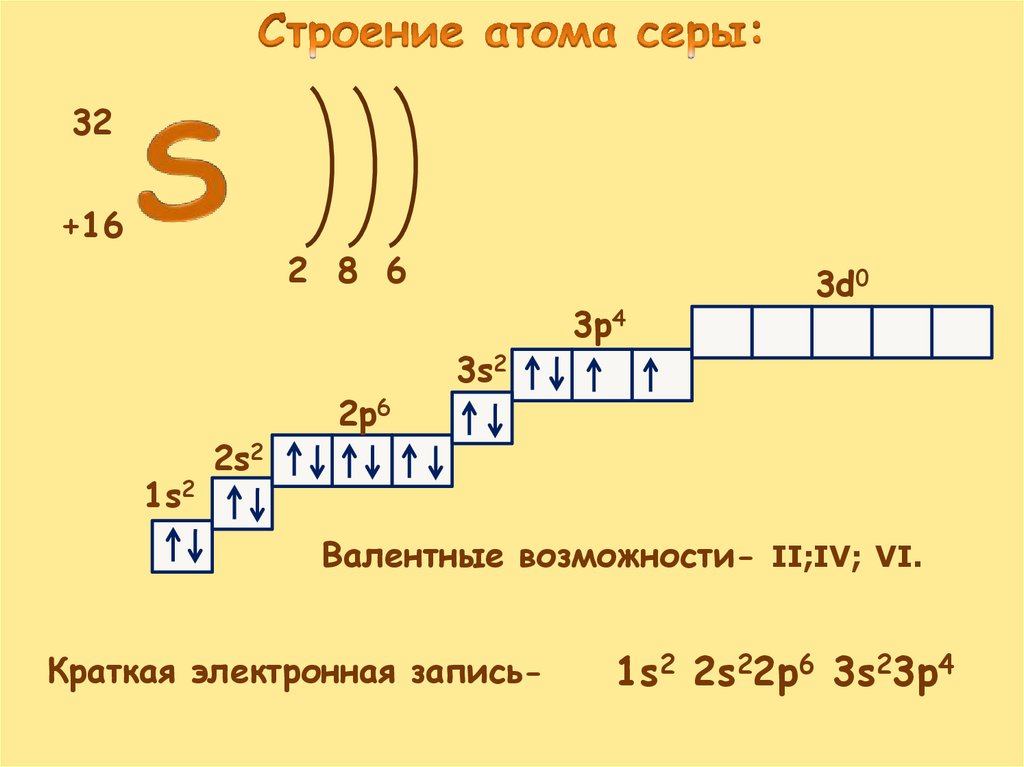
32+16
2 8 6
1s2
2s2
2p6
3s2
3p4
3d0
Валентные возможности- II;IV; VI.
Краткая электронная запись-
1s2 2s22p6 3s23p4
4.
Серный колчедан(пирит FеS2)
Сера самородная (S)
S
Свинцовый блеск
(галенит PbS)
Киноварь (HgS)
Цинковая обманка
(сфалерит ZnS)
5.
6.
7.
8.
9.
10.
Cера встречается вприроде в
свободном
(самородном)
состоянии,
поэтому она была
известна человеку
уже в глубокой
древности.
Сера привлекала внимание характерной окраской,
голубым цветом пламени и специфическим запахом,
возникающим при горении (запах сернистого газа).
11.
Считалось, что горящая сераотгоняет нечистую силу.
В Библии говорится об
использовании серы для
очищения грешников.
Применение горящей серы для дезинфекции
упоминается Гомером.
В Древнем Риме с помощью сернистого газа
отбеливали ткани.
Издавна использовалась сера в медицине — ее
пламенем окуривали больных, ее включали в состав
различных мазей для лечения кожных заболеваний.
12.
В 11 в.алхимики
полагали, что
металлы, в том
числе золото и серебро,
состоят из находящихся в
различных соотношениях
серы и ртути.
Поэтому сера играла важную роль в попытках
алхимиков найти «философский камень» и
превратить недрагоценные металлы в драгоценные.
В 16 в. Парацельс считал серу наряду с ртутью и
«солью» одним из основных «начал» природы,
«душою» всех тел.
13.
Практическое значение серырезко возросло после того, как
изобрели черный порох
(в состав которого обязательно
входит сера).
Византийцы в 673 г., защищая
Константинополь,
сожгли флот неприятеля с
помощью так называемого греческого огня — смеси
селитры, серы, смолы и других веществ — пламя
которого не гасилось водой.
В средние века в Европе применялся черный порох,
по составу близкий к смеси греческого огня.
14.
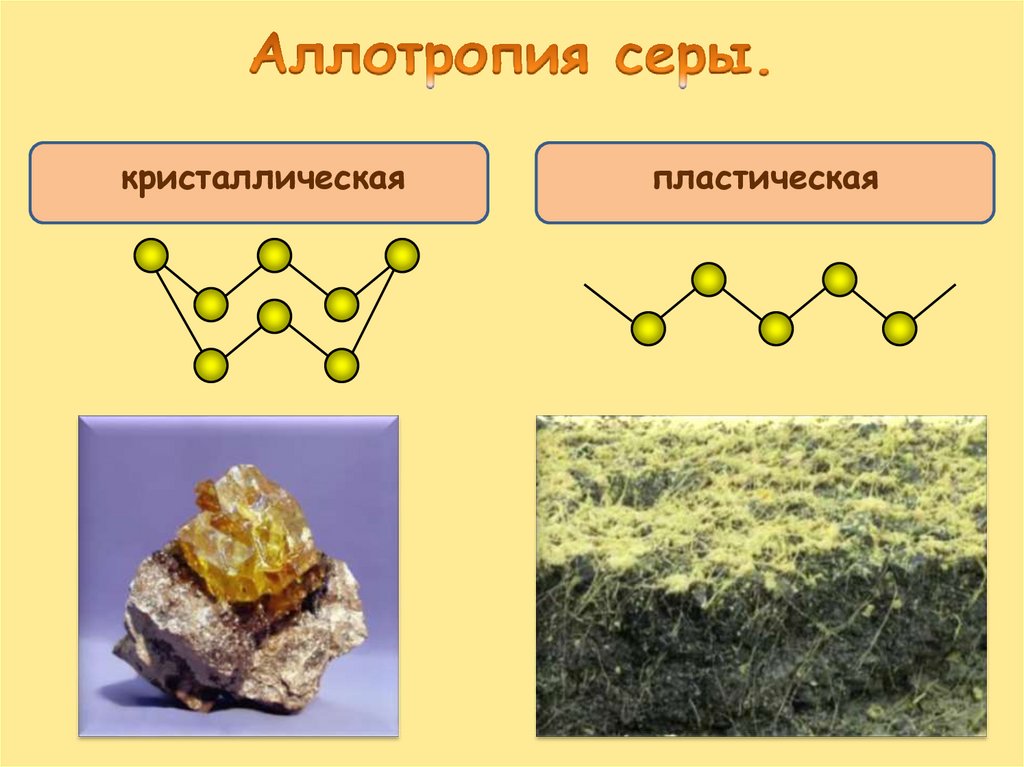
Аллотропия – явление, когда один химическийэлемент образует несколько простых веществ.
Сами простые вещества, образованные одним
химическим элементом называются
или
Для серы характерно явление аллотропии.
15.
кристаллическаяпластическая
16.
— твердое агрегатноесостояние
— желтого цвета
— не растворима в воде
— не смачивается водой
(
ация)
— растворяется в
органических
растворителях
17.
Химические свойстваОкислительные свойства
серы
0
S
+ 2ē
-2
S
18.
Химические свойстваВосстановительные свойства
+2
S - 2ē S ;
S - 4ē
+6
S - 6ē S
+4
S ;
19.
Химические свойстваВосстановительные свойства сера проявляет в реакциях
с сильными окислителями:
кислородом:
S + O2 –t S+4O2
2S + 3O2 –t ;Рt 2S+6O3
c галогенами (кроме йода):
S + Cl2 S+2Cl2
c кислотами - окислителями:
S + 2H2SO4(конц) 3S+4O2 + 2H2O
S + 6HNO3(конц) H2S+6O4 + 6NO2 + 2H2O
20.
Окислительныесвойства
Восстановительные
свойства
21.
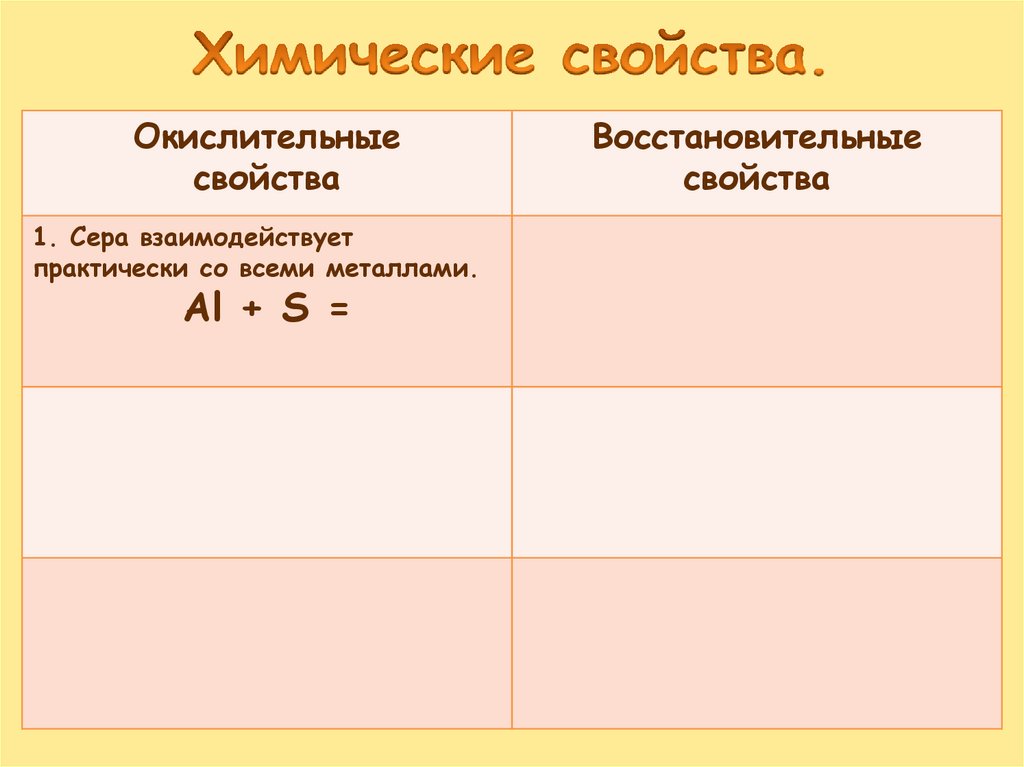
Окислительныесвойства
1. Сера взаимодействует
практически со всеми металлами.
Al + S =
Восстановительные
свойства
22.
Окислительныесвойства
1. Сера взаимодействует
практически со всеми металлами.
Al + S =
2. Со щелочными металлами сера
взаимодействует без нагревания.
Na + S =
Восстановительные
свойства
23.
Окислительныесвойства
1. Сера взаимодействует
практически со всеми металлами.
Al + S =
2. Со щелочными металлами сера
взаимодействует без нагревания.
Na + S =
3. При повышенной температуре
сера взаимодействует с водородом.
H2 + S =
Восстановительные
свойства
24.
Окислительныесвойства
1. Сера взаимодействует
практически со всеми металлами.
Al + S =
2. Со щелочными металлами сера
взаимодействует без нагревания.
Na + S =
3. При повышенной температуре
сера взаимодействует с водородом.
H2 + S =
Восстановительные
свойства
1. Сера взаимодействует с
кислородом (горит)
S + O2 =
25.
Окислительныесвойства
Восстановительные
свойства
1. Сера взаимодействует
практически со всеми металлами.
1. Сера взаимодействует с
кислородом (горит)
2. Со щелочными металлами сера
взаимодействует без нагревания.
2. Сера взаимодействует со
фтором.
Al + S =
Na + S =
3. При повышенной температуре
сера взаимодействует с водородом.
H2 + S =
S + O2 =
S + F2 =
26.
Окислительныесвойства
Восстановительные
свойства
1. Сера взаимодействует
практически со всеми металлами.
1. Сера взаимодействует с
кислородом (горит)
2. Со щелочными металлами сера
взаимодействует без нагревания.
2. Сера взаимодействует со
фтором.
Al + S = Al2S3
Na + S = Na2S
3. При повышенной температуре
сера взаимодействует с водородом.
H2 + S = H2S
S + O2 = SO2
S + F2 = SF6
27.
Окислительныесвойства
Восстановительные
свойства
1. Сера взаимодействует
практически со всеми металлами.
1. Сера взаимодействует с
кислородом (горит)
2. Со щелочными металлами сера
взаимодействует без нагревания.
2. Сера взаимодействует со
фтором.
2Al + 3S = Al2S3
2Na + S = Na2S
3. При повышенной температуре
сера взаимодействует с водородом.
H2 + S = H2S
S + O2 = SO2
S + 3F2 = SF6
28.
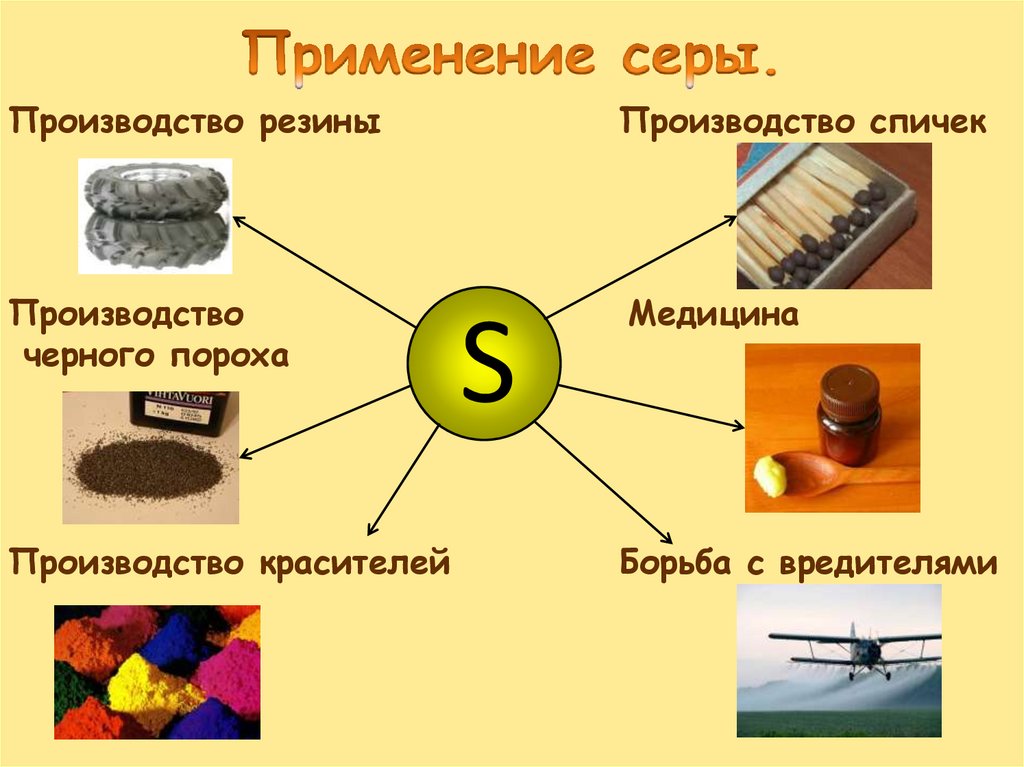
Производство резиныПроизводство спичек
Производство
черного пороха
Медицина
Производство красителей
S
Борьба с вредителями
29.
Напишите уравнения реакцийS → SO2 → SO3 → H2SO4 → CaSO4
30.
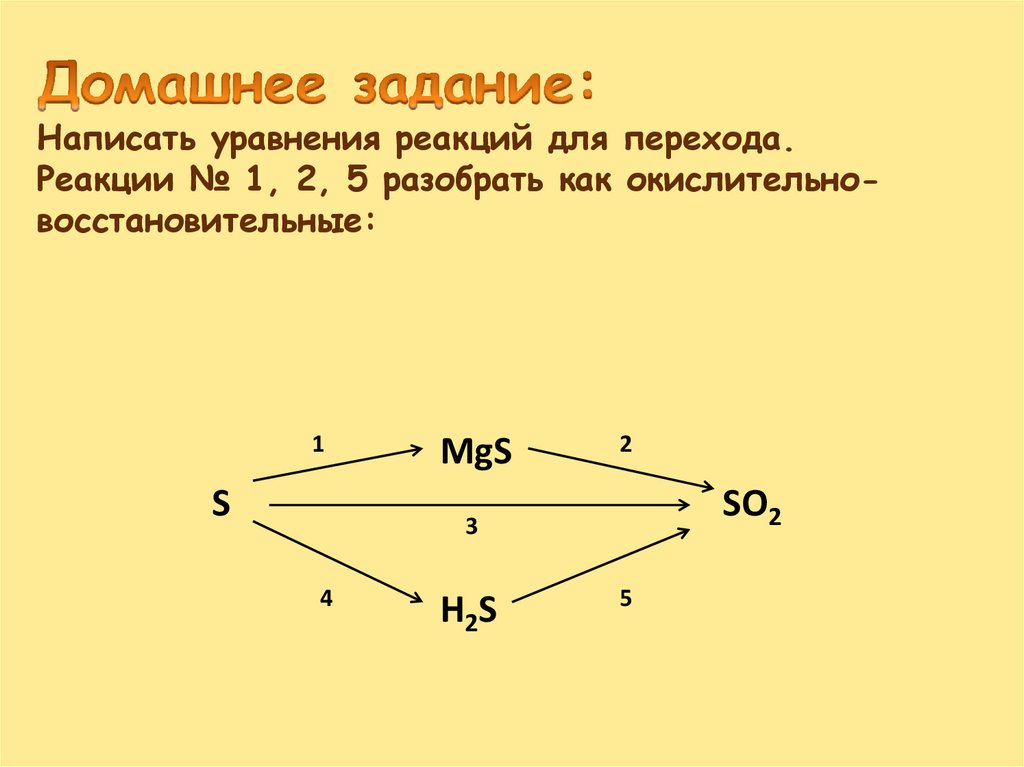
Написать уравнения реакций для перехода.Реакции № 1, 2, 5 разобрать как окислительновосстановительные:
1
S
MgS
2
SO2
3
4
H2S
5























 Химия
Химия








