Похожие презентации:
Гидролиз солей. Теория электролитической диссоциации (ТЭД). Лабораторная работа №3
1.
Лабораторная работа №3Гидролиз солей.
Теория электролитической диссоциации (ТЭД).
Цель работы: систематизировать
теоретические знания, сформировать
практическое умение определять
характер среды в водных растворах
солей с помощью кислотно-основных
индикаторов и универсальной pHиндикаторной бумаги.
2.
Работа в лабораторииОборудование и реактивы:
планшетки;
штатив с реактивами;
индикаторы, pH-индикаторная бумага.
Проведение работы:
3.
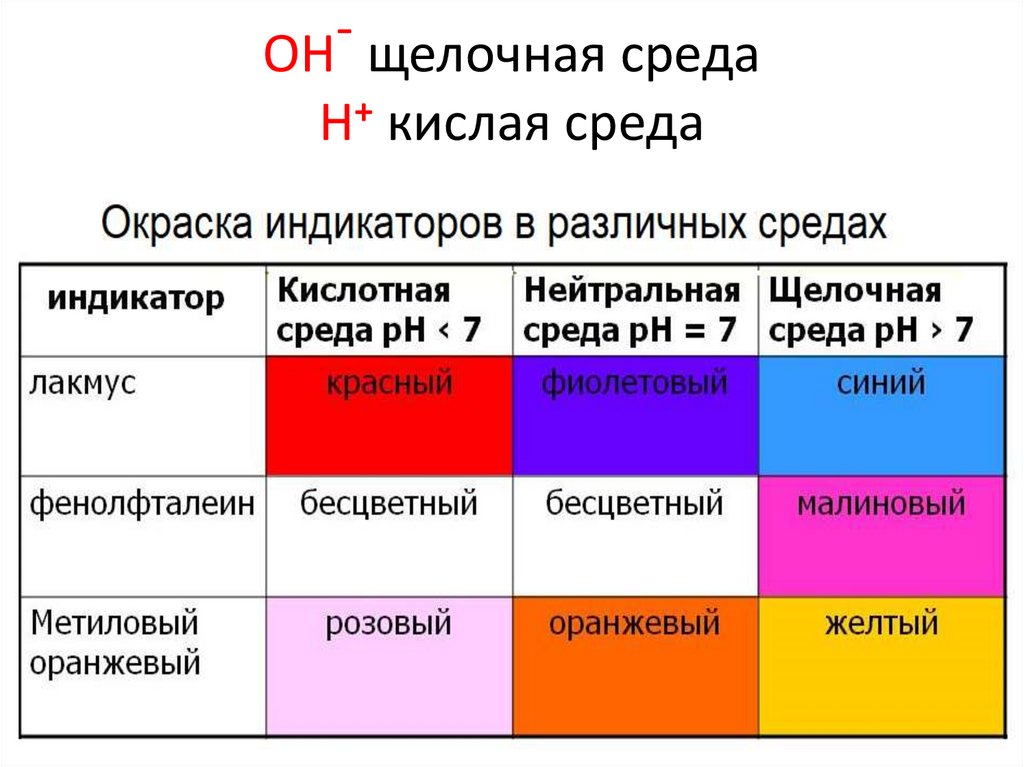
ОН щелочная средаН+ кислая среда
4.
Опыт 1. Изменение окраскииндикаторов в растворах кислот и
щелочей.
5.
1.1 Испытание растворов кислот индикаторамиВ три лунки налейте по 8-10 капель раствора
серной кислоты,
затем добавьте: в первую –каплю фенолфталеина,
во вторую – небольшое количество раствора
лакмуса,
в третью – небольшой объем раствора метилового
оранжевого.
Повторите опыт с использованием соляной
кислоты
Напишите уравнения диссоциации кислот серной и
соляной .
Указать, какие ионы влияют на изменение окраски
индикаторов.
Оформите вывод.
6.
1.2 Испытание растворов щелочейиндикаторами
В три лунки налейте по 8-10 капель раствора
гидроксида натрия,
затем добавьте: в первую – несколько капель
фенолфталеина,
во вторую – небольшое количество раствора
лакмуса,
в третью – небольшой объем раствора метилового
оранжевого.
Что наблюдаете?
Напишите уравнения диссоциации щелочи.
Указать, какие ионы влияют на изменение окраски
индикаторов. Оформите вывод.
7.
Опыт 2. Реакция среды врастворах различных солей.
На универсальную pH-индикаторную бумагу нанесите
1 каплю раствора каждой из следующих солей:
2.1 хлорида натрия,
2.2 хлорида алюминия,
2.3. карбоната натрия,
2.4 хлорида железа (III).
2.5 хлоридом аммония
Сравните окраску pH-бумаги с индикаторной шкалой
изменений pH.
Запишите -уравнения диссоциации или
реакций гидролиза солей.
Оформите вывод по каждой соли.
8.
1. Определите, к какому типу солей (по отношению к гидролизу) относятсяследующие соли. Напишите уравнения гидролиза :
1. Хлорид калия, силикат
натрия, сульфат
марганца, хлорид
кальция
3. Сульфат лития, нитрит
калия, нитрат алюминия,
хлорид бария
2. Фторид натрия,
фосфат натрия, сульфат
меди, сульфат калия
4. Нитрат натрия, хромат
CrO42- калия, нитрат цинка,
сульфат кальция
2. При смешивании растворов солей Cr2(SO4)3 и K2S
образуется зеленый осадок гидроксида хрома(III) Cr(OH)3 и выделяется газ H2S. Напишите уравнения
реакций в молекулярной и ионно-молекулярной
формах.
9.
Контрольные вопросы и задания:1. Определите, к какому типу солей (по отношению к
гидролизу) относятся следующие соли. Напишите
уравнения гидролиза :
хлорид калия, силикат натрия, нитрат лития,
нитрат меди.
2. Напишите уравнения гидролиза следующих солей
и укажите среду раствора: Cu(NO3)2, СаSO4, K2S,
Na2SiO3,
3. При смешивании растворов солей Cr2(SO4)3 и K2S
образуется зеленый осадок гидроксида хрома(III) Cr(OH)3 и выделяется газ H2S. Напишите уравнения
реакций в молекулярной и ионно-молекулярной
формах.








 Химия
Химия








