Похожие презентации:
Путешествие по галактике «Неметаллоляндии»
1.
2.
3.
4.
15.
5. Определите положение неметаллов в Периодическойсистеме химических элементов Д.И. Менделеева?
4. Каковы особенности атомного строения элементов
неметаллов?
3. Каковы общие физические свойства простых
веществ неметаллов?
2. Почему у простых веществ неметаллов такие
разнообразные свойства?
1. Что такое аллотропия и каковы причины этого
явления?
6.
27.
38.
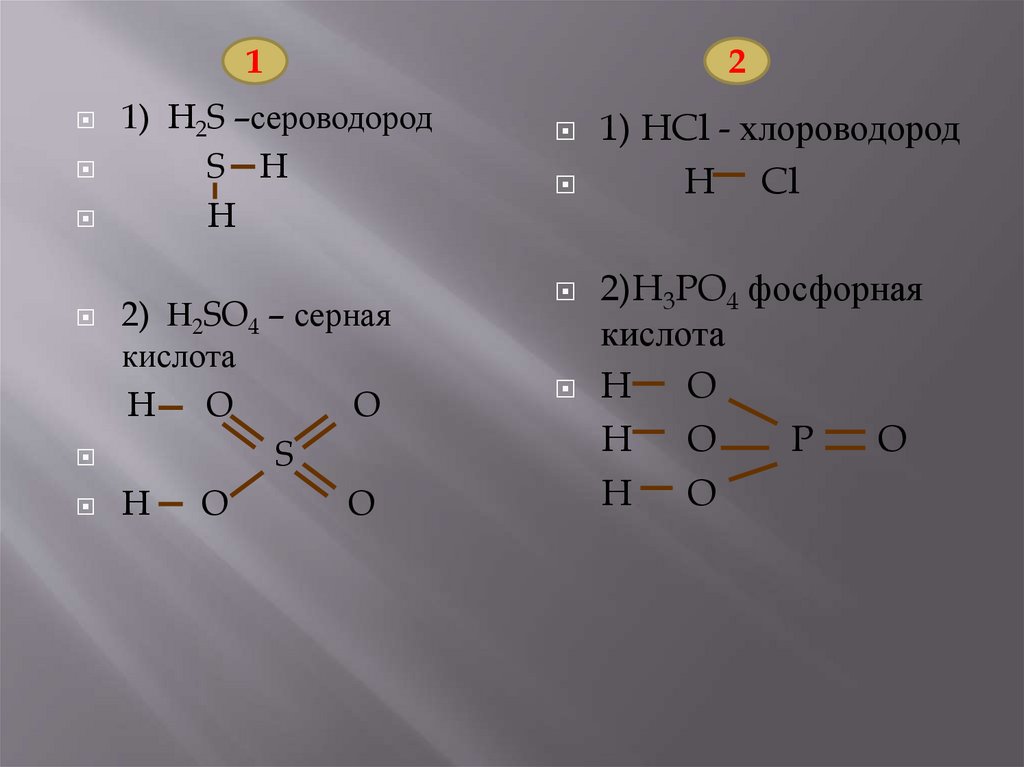
11) сероводород;
*2)серная кислота.
2
1)хлороводород;
*2)фосфорная кислота.
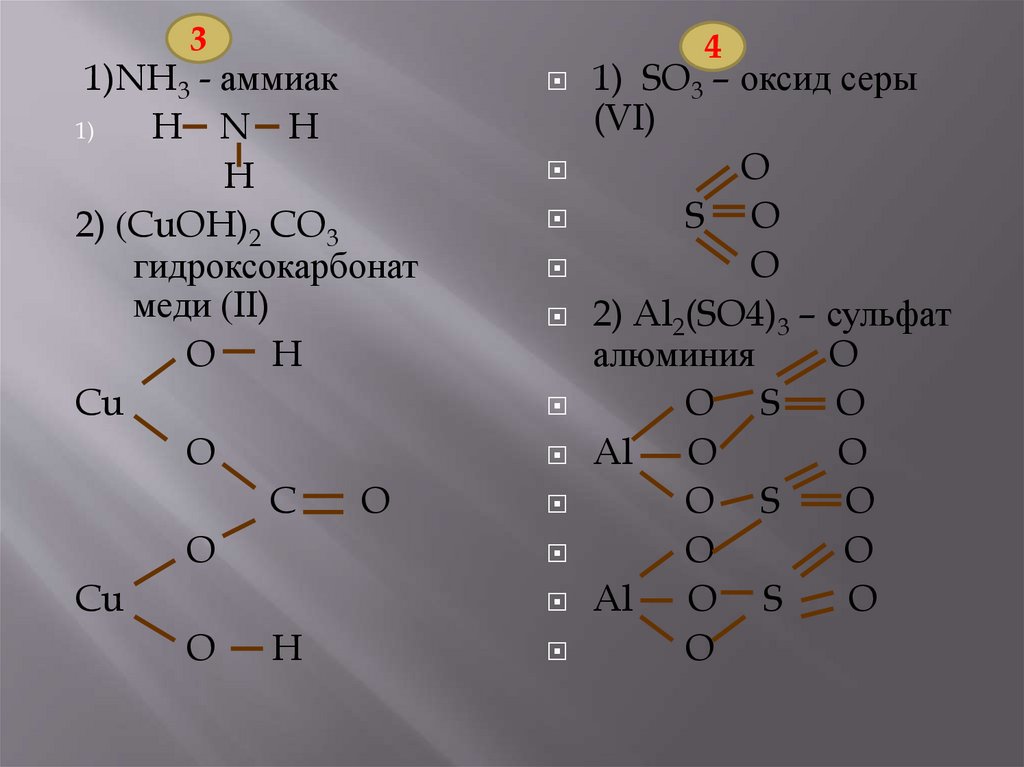
3
1)аммиак;
*2)гидрокарбонат меди
(II).
4
1)оксид серы (VI);
*2)сульфат алюминия.
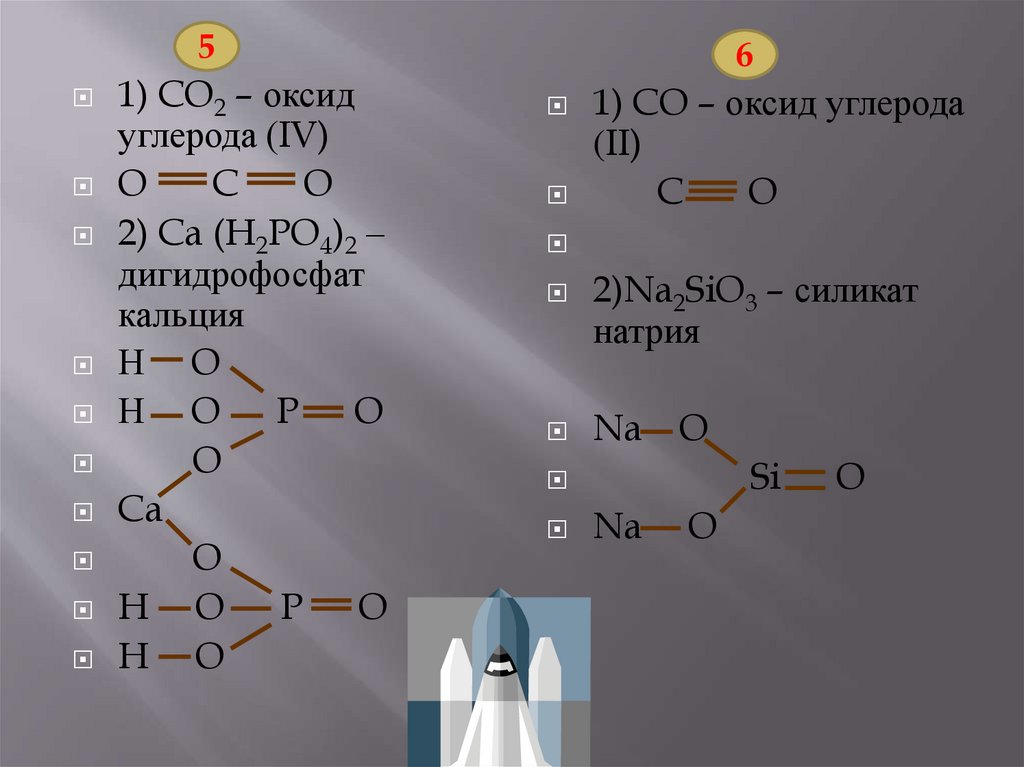
5
1)оксид углерода (IV);
*2)дигидрофосфа
кальция.
6
1)оксид углерода (II);
*2)силикат натрия.
9.
11) H2S –сероводород
S H
H
2) Н2SO4 – серная
кислота
H
O
O
S
H
O
O
2
1) HCl - хлороводород
H Cl
2)H3PO4 фосфорная
кислота
H O
H O
P
O
H O
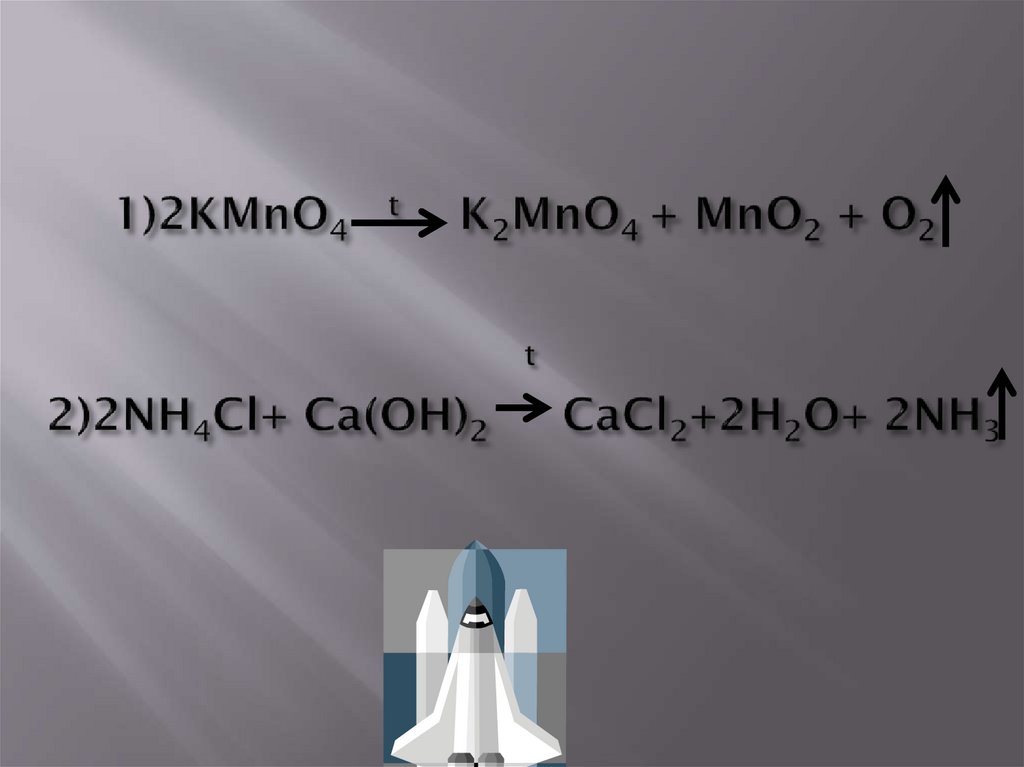
10.
31)NH3 - аммиак
1)
H N H
H
2) (CuOH)2 CO3
гидроксокарбонат
меди (II)
O H
Cu
O
C
O
O
Cu
O H
4
1) SO3 – оксид серы
(VI)
O
S O
O
2) Al2(SO4)3 – сульфат
алюминия
O
O S O
Al O
O
O S
O
O
O
Al O S
O
O
11.
51) CO2 – оксид
углерода (IV)
O
C
O
2) Ca (H2PO4)2 –
дигидрофосфат
кальция
Н O
Н O P O
O
Ca
O
H O P O
H O
6
1) CO – оксид углерода
(II)
C
O
2)Na2SiO3 – силикат
натрия
Na O
Si
Na
O
O
12.
4Задание №1
Получите кислород и
докажите, что в сосуде
находится именно этот
газ. Запишите
соответствующее
уравнение реакции.
Секретно
Задание №2
Получите аммиак и
докажите, что в сосуде
находится именно этот
газ. Запишите
соответствующее
уравнение реакции.
Секретно
13.
14.
5Задача для первой группы.
Какой объем оксида углерода(IV) можно получить
обжигом 1 тонны известняка, содержащего 90 %
карбоната
кальция,
если космического
выход оксида
углерода(IV)
Уважаемые
члены экипажа
корабля
«Удача»!
Просим поторопиться
космический корабль.
Для этого нужно
составляет
80 %заправить
от теоретически
возможного?
Задача
правильно решить расчетные задачи.
для второйЖелаем
группы.
удачи!
Какой объем водорода получится при взаимодействии
магния с 200г. 25% раствора
ЦУП.
серной кислоты?
15.
Задача №1Дано:
m (известняка) =1 т.
w (CaCO3) =90%
η(практ.) =80%
V(CO2) =?
Решение:
900кг.
Xм3
t
CaCO3
CaO + CO2
1кмоль
1кмоль
100кг.
22,4 м 3
m(в-ва) = m(смеси) х w(в-ва)
m(CaCO3) = 1000кг. х 0,9 = 900кг.
По уравнению реакции:
m(CaCO3) = M(CaCO3) х n (CaCO3) ;
M (CaCO3) = 40+ 12+16 х 3=100кг/кмоль.
m(CaCO3) =100кг/кмоль х 1кмоль =100кг.
V(CO2) = Vm (CO2) х n(CO2);
V(CO2) = 22,4 м3/кмоль х 1 кмоль = 22,4 м3
Составим пропорцию:
900кг
Хм3
900кг х 22,4 м3
100 кг
22,4м3 ; Х =
100кг
=201,28 м3
201,6 м3 составляют 100%
201,6 м3 х 80%
Хм3 ----------------- 80% ; Х =
100%
=
=161,28м3
16.
Задача №2Дано:
m (H2SO4) =200г.
W (H2SO4) =25%
V (Н2) =?
Решение:
50г.
Хл.
Mg + H2SO4
MgSO4 + H2
1моль
1моль
98г.
22,4л.
Найдем массу серной кислоты в растворе:
m(H2SO4) = m(р-ра H2SO4) х w(H2SO4)
m(H2SO4) = 200г. х 0,25 =50г.
По уравнению реакции:
m(H2SO4) = M(H2SO4) х n (H2SO4);
M(H2SO4) = 2 + 32 + 16 х 4 =98 г/моль
m (H2SO4) =98г/моль х 1моль =98г.
V = Vm х n ; V(H2) = 22,4 л/моль х 1 моль=22,4 л.
Составим пропорцию:
50г.
Хл.
50г. х 22,4 л.
98г.
22,4л. ; Х =
98г.
= 11,43 л.
17.
6Красный фосфор я сжигаю,
К дыму воду приливаю.
Проверяю лакмусом,
Станет сразу красным он!
Добавим натрия гидроксид –
Цвет фиолетовый в колбе возник.
Потом получаю фосфат серебра,
Цветом – лимонная кожура.
Растворяю осадок желтый
Добавлением кислоты азотной.
В тетради превращения эти
Запишите , умные дети!
18.
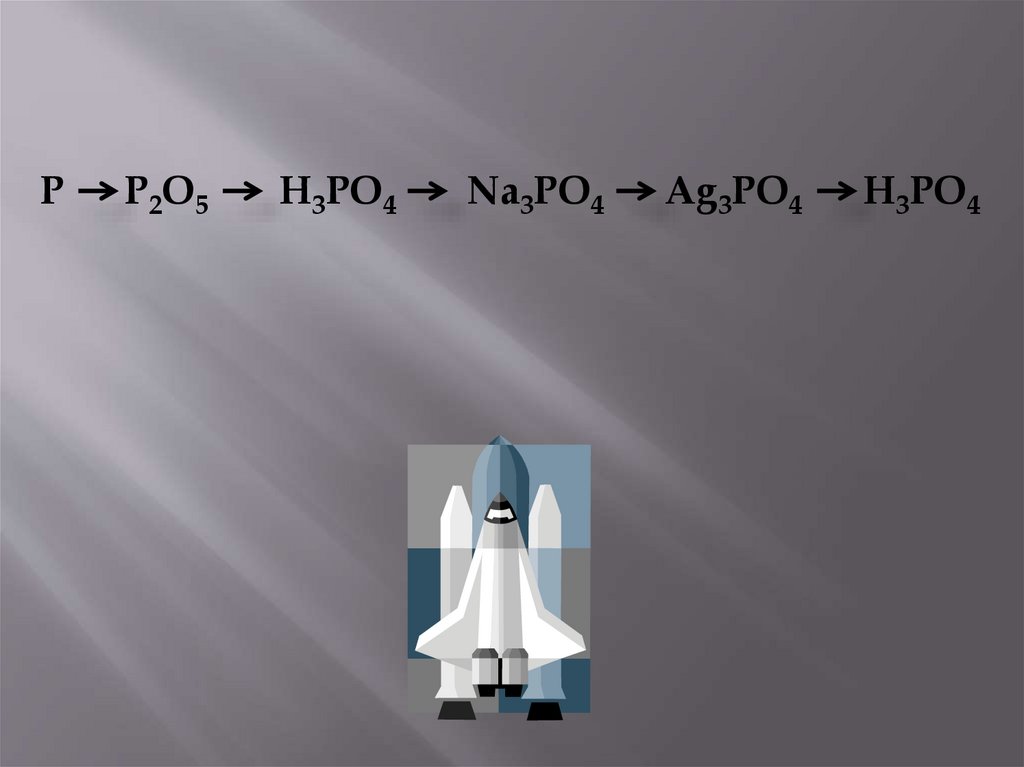
PP2O5
H3PO4
Na3PO4
Ag3PO4
H3PO4
19.
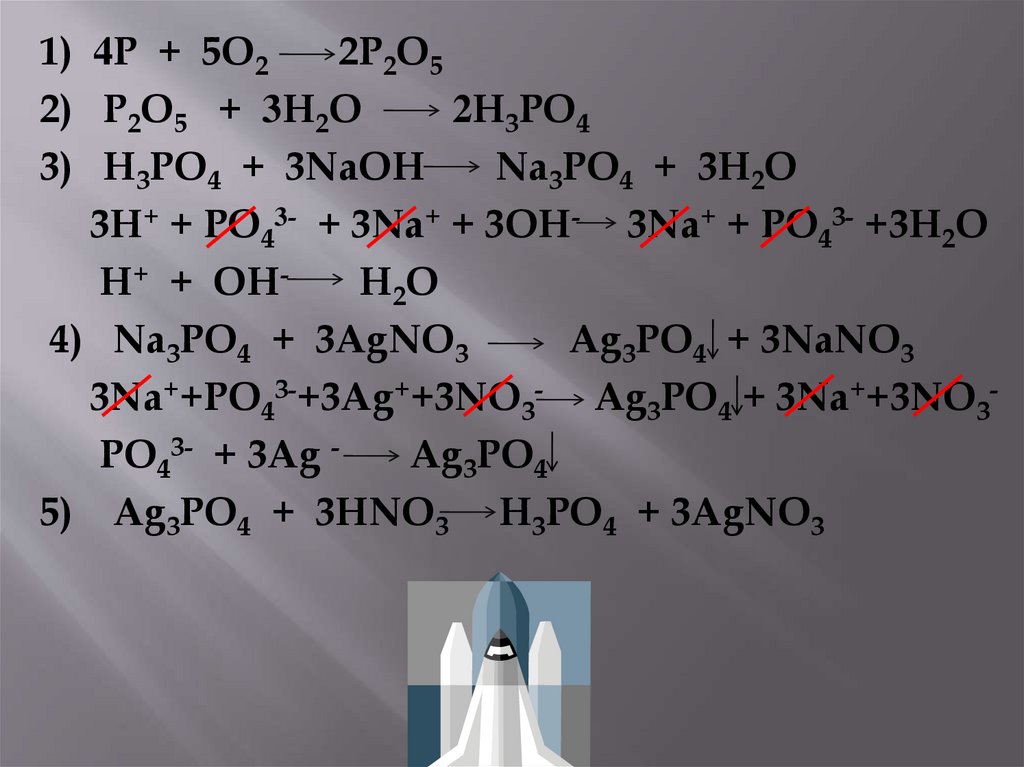
1) 4P + 5O22P2O5
2) P2O5 + 3H2O
2H3PO4
3) H3PO4 + 3NaOH
Na3PO4 + 3H2O
3H+ + PO43- + 3Na+ + 3OH- 3Na+ + PO43- +3H2O
H+ + OHH2O
4) Na3PO4 + 3AgNO3
Ag3PO4 + 3NaNO3
3Na++PO43-+3Ag++3NO3- Ag3PO4 + 3Na++3NO3PO43- + 3Ag Ag3PO4
5) Ag3PO4 + 3HNO3 H3PO4 + 3AgNO3













 Химия
Химия








