Похожие презентации:
Электролитическая диссоциация. Тест по химии для 9 класса (1 вариант)
1. Тест по химии для 9 класса
Тема:«Электролитическая диссоциация»
1 вариант
Химия 9
2.
Среди перечисленных веществ неэлектролитом является1) Соляная кислота
2) гидроксид натрия ( раствор)
3) Углекислый газ
4) Хлорид натрия (раствор)
поглощение
3
3.
Вещества, которые при диссоциации вводном растворе образуют в качестве
катионов только ионы водорода Н+
(гидроксоний-ионы), являются
1) средними солями
2) щелочами
3) кислыми солями
4) кислотами
масляная
кислота
4
4.
Реакция идет до конца врезультате образования
осадка между электролитами
1) гидроксидом калия и нитратом натрия
2) карбонатом натрия и соляной кислотой
3) нитратом меди (II) и гидроксидом натрия
4) Гидроксидом меди (II) и серной кислотой
Ответ: 3
5.
Суммы всех коэффициентов в полномионном и сокращенном ионном
уравнениях реакции хлорида меди (II) с
гидроксидом калия соответственно равны
1) 10 и 3
2) 12 и 3
3) 10 и 4
4) 12 и 4
4) 12 и 4
CuCl2 2 KOH Cu OH 2 2 KCl
Cu 2 2Cl 2 K 2OH Cu OH 2 2 K 2Cl
ñóììà
êîýôôèöèåí
òîâ ðàâíà 12
Cu 2 2OH Cu OH 2
ñóììà
êîýôôèöèåí
òîâ ðàâíà 4
6.
В уравнении реакциивзаимодействия цинка с соляной
кислотой коэффициент перед
формулой восстановителя равен
1) 1
2) 2
3) 3
4) 4
1
Zn 2 HCl ZnCl2 H 2
Zn 0 2 H 2Cl Zn 2 2Cl 2 H
( 2 e )
Zn 0
Zn 2
7.
Сколько различных солей можнополучить, если имеются
следующие вещества: гидроксид
бария, гидроксид калия, серная
кислота, карбонат бария, оксид
бария?
1) 1
2) 2
4
3) 3
4) 4
8.
Тест по химии для 9 классаТема:
«Электролитическая диссоциация»
2 вариант
Химия 9
9.
Слабый электролитомявляется
1) гидроксид натрия
2) вода (дистиллированная)
3) серная кислота
4) хлорид калия
2
10.
Какое уравнениеэлектролитической
диссоциации
гидроксида цинка
написано правильно?
1) Zn(OH) 2 Zn 2 2OH
2) Zn(OH) 2 ZnOH OH Zn
-
2
2OH
-
Zn 2 2OH
3) Zn(OH) 2
4) Zn(OH) 2 ZnOH OH
4
-
Zn
2
2OH
-
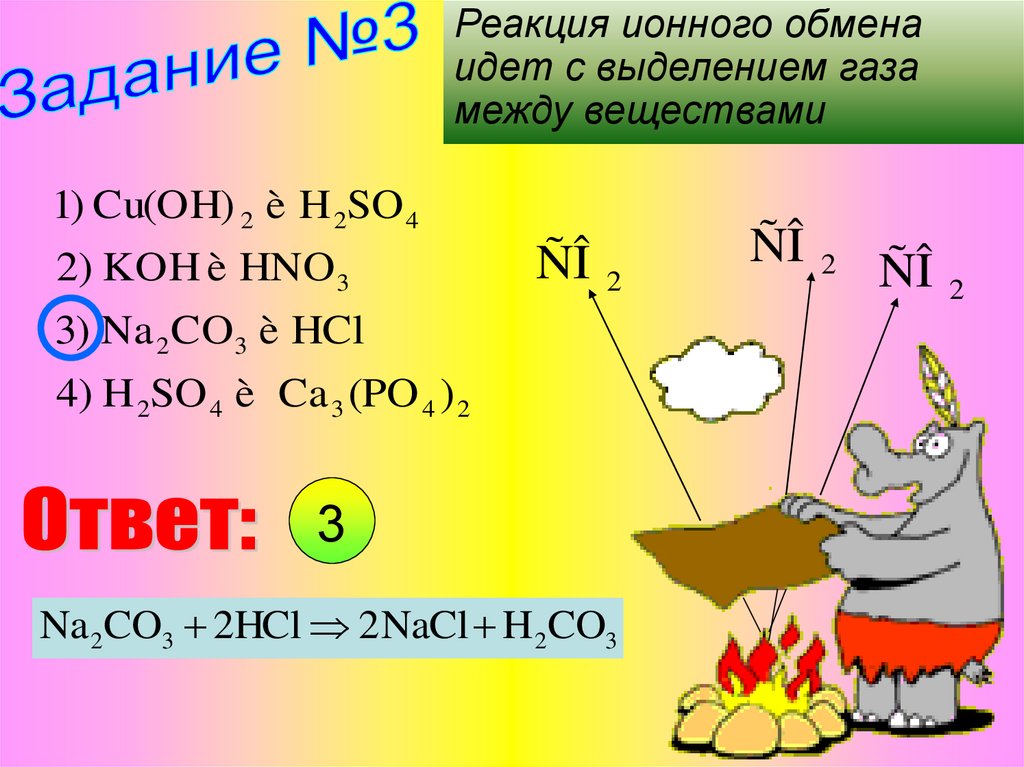
11.
Реакция ионного обменаидет с выделением газа
между веществами
1) Cu(OH) 2 è H 2SO 4
2) KOH è HNO 3
ÑÎ
2
3) Na 2 CO3 è HCl
4) H 2SO 4 è Ca 3 (PO 4 ) 2
3
Na 2CO3 2HCl 2NaCl H 2CO3
ÑÎ
2
ÑÎ
2
12.
Суммы всех коэффициентов вполном ионном и сокращенном
ионном уравнениях реакции между
хлоридом кальция и нитратом
серебра соответственно равны
1) 10 и 3
2) 10 и 6
3) 12 и 3
4) 12 и 6
3
CaCl2 2 AgNO3 Ca NO3 2 2 AgCl
Ca 2 2Cl 2 Ag 2 NO3 Ca 2 2 NO3 2 AgCl
ñóììà
âñå êîýôôèöèåí
òîâ ðàâíà 12
2 Ag 2Cl 2 AgCl
Ag Cl AgCl
ñóììà âñå êîýôôèöèåí
òîâ ðàâíà 3
13.
Коэффициент передформулой восстановителя в
уравнении реакции
Al HCl AlCl3 H 2
1) 1
4) 4
3) 3
2) 2
2
2 Al 6 HCl 2 AlCl3 3H 2
2 Al 6 H 6Cl 2 Al
0
( 3e )
Al Al
0
3
3
6Cl 6 H
14.
Карбонат кальция можно получить реакциейионного обмена при взаимодействии
1) карбоната натрия с гидроксидом кальция
2) сульфата кальция с угольной кислотой
3) хлорида кальция с углекислым газом
4) кальция с оксидом углерода (IV)
1
15. Подгруппа кислорода
Электронная формула атома химического элемента2
2
6
2
4 Укажите химический знак элемента
1s 2s 2 p 3s 3 p .
и формулу высшего оксида.
1) S; SO2
2) S; SO3
3) Se; SeO2
4) Se; SeO3
Ответ: 2
16.
В уравнении реакции горения серы в кислородекоэффициент перед формулой восстановителя равен
1) 1
2) 2
1
3) 3
S O2 SO2
4) 4
17.
С разбавленной серной кислотой могутреагировать оба вещества
1) медь и гидроксид меди (II)
2) железо и гидроксид железа (III)
3) углерод и оксид углерода (IV)
4) сера и сероводород
Ответ: 2
18.
Суммы всех коэффициентов вмолекулярном, полном ионном и
сокращенном ионном уравнениях
реакции разбавленной серной кислоты
с цинком соответственно равны
1) 5; 6;4
2) 5; 7;5
3) 4; 6;4
4) 4; 7;5
Zn H 2 SO4 ZnSO4 H 2
1 1 1 1 4
2
2
Zn 2 H SO4 Zn 2 SO4 H 2
1 2 1 1 1 1 7
Zn 2 H Zn 2 H 2
1 2 1 1 5
19.
С помощью какого иона можнообнаружить сульфат-ион?
1) Í
Ответ: 4
2) ÎÍ
-
3) Àg
4) Âà
2
20.
Масса пиритаFeS2,требующегося для
получения 245 г серной
кислоты, равна
1) 120 г
2) 150 г
3) 245 г
4) 300г
21.
ВАРИАНТ 2Электронная формула атома химического элемента
1s 2 2s 2 2 p 6 3s 2 3 p 4 Укажите химический знак элемента
и формулу высшего оксида.
1) RO2
3) RO3
2) R2O3
4) R2O7
Ответ: 3
22.
В уравнении реакции горения сероводорода визбытке кислорода коэффициент перед
формулой восстановителя равен
1) 1
2) 2
3) 3
4) 4
23.
С разбавленной серной кислотой могутреагировать оба вещества
1)серебро и нитрат серебра
2) цинк и гидроксид цинка
3)медь и гидроксид меди (ll)
4)сера и сероводород
Zn H 2 SO4 ZnSO4 H 2
Zn ÎÍ 2 H 2 SO4 ZnSO4 2H 2Î
24.
Суммы всех коэффициентов вмолекулярном, полном ионном и
сокращенном ионном уравнениях
реакции серной кислоты с гидроксидом
бария соответственно равны
1) 5; 9;3
2) 5; 9;9
3) 4; 10;3
4) 4; 10;9
H 2 SO4 Ba OH 2 BaSO4 2 H 2O
1 1 1 2 5
2 H SO4 Ba 2OH BaSO4 2 H 2O
2 1 1 2 1 2 9
25.
С помощью какого иона можно обнаружитьсульфат-ион?
1) ÎÍ
-
2) Í
3) Âà
2
4) Àg
Ответ: 3
26.
Масса пирита FeS2,требующегося дляполучения 11,2 л (н.у.) оксида серы, равна
1) 20 г.
х, г
2) 30 г.
3) 40 г.
4) 60 г.
11,2 л
4 FeS2 11O2 2 Fe2O3 8SO2
480 г
8*22, 4 л
x, ã
11,2 ë
11,2ë 480ã
; õ
; õ 30 ã
480 ã 8 22,4 ë
8 22,4ë

























 Химия
Химия








