Похожие презентации:
Неметаллы. Уменьшение радиусов атомов
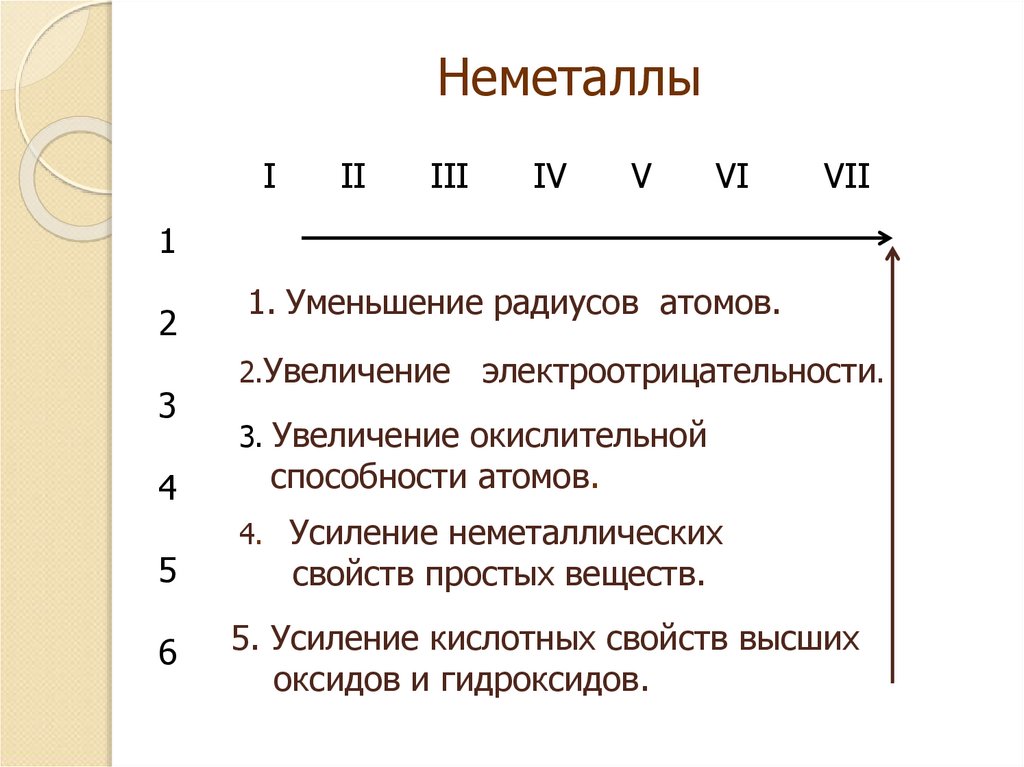
1. Неметаллы
III
III
IV
V
VI
VII
1
2
3
4
5
6
1. Уменьшение радиусов атомов.
2.Увеличение
электроотрицательности.
3. Увеличение окислительной
способности атомов.
4. Усиление неметаллических
свойств простых веществ.
5. Усиление кислотных свойств высших
оксидов и гидроксидов.
2. VII A группа (галогены)
элементПорядковый
номер
Номер
периода
Группа
подгруппа
Ar
F
9
2
VIIA
19
Cl
17
3
VIIA
35,5
Br
35
4
VIIA
80
5
VIIA
127
I
53
3. VII A группа (галогены)
IF
II
III
IV
V
VI
VII
1
2
Cl
3
Br
4
I
5
6
1. Сходство: 7 валентных электронов
на внешнем слое.
2. Валентность:
а) у фтора – только I
б) у Cl, Br, I – I, III, V, VII
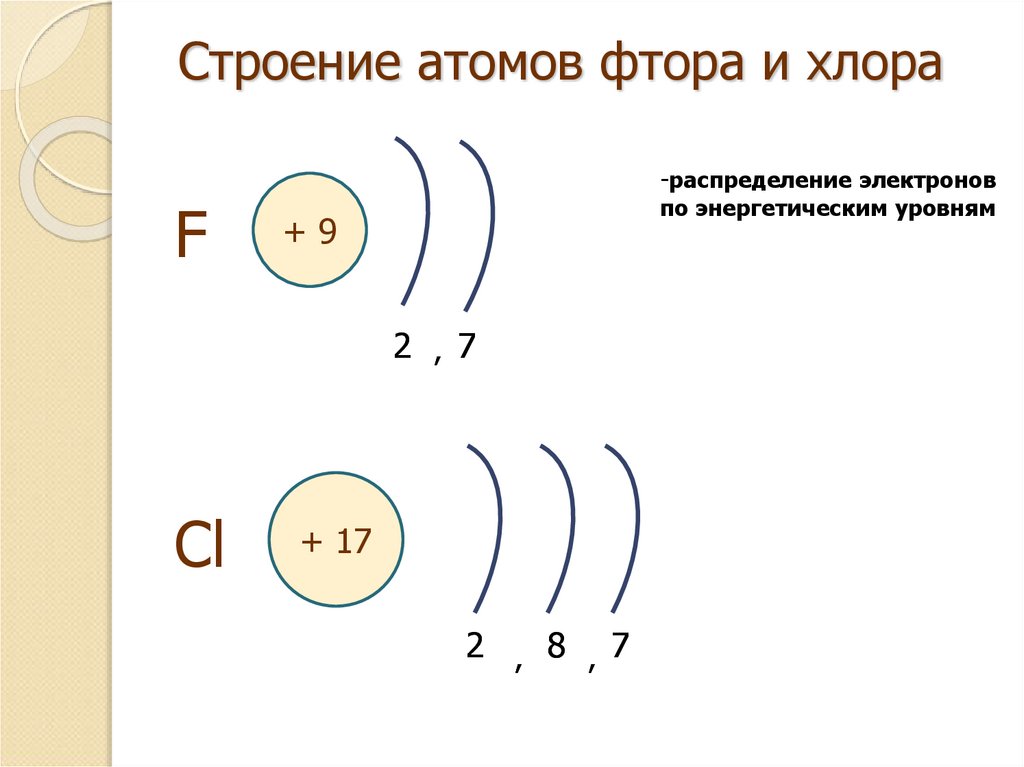
4. Строение атомов фтора и хлора
-распределение электроновF
по энергетическим уровням
+9
2 , 7
Cl
+ 17
2 , 8 , 7
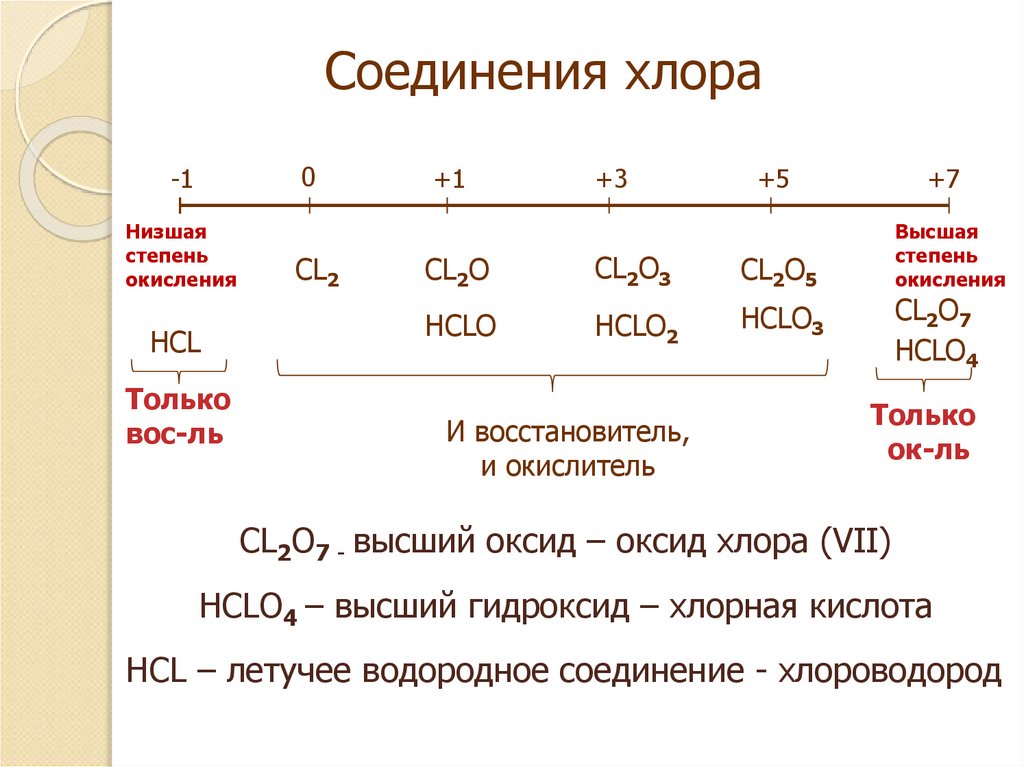
5. Соединения хлора
0-1
Низшая
степень
окисления
HCL
Только
вос-ль
CL2
+1
+3
+5
CL2O
CL2O3
CL2O5
HCLO
HCLO2
HCLO3
И восстановитель,
и окислитель
+7
Высшая
степень
окисления
CL2O7
HCLO4
Только
ок-ль
CL2O7 - высший оксид – оксид хлора (VII)
HCLO4 – высший гидроксид – хлорная кислота
HCL – летучее водородное соединение - хлороводород
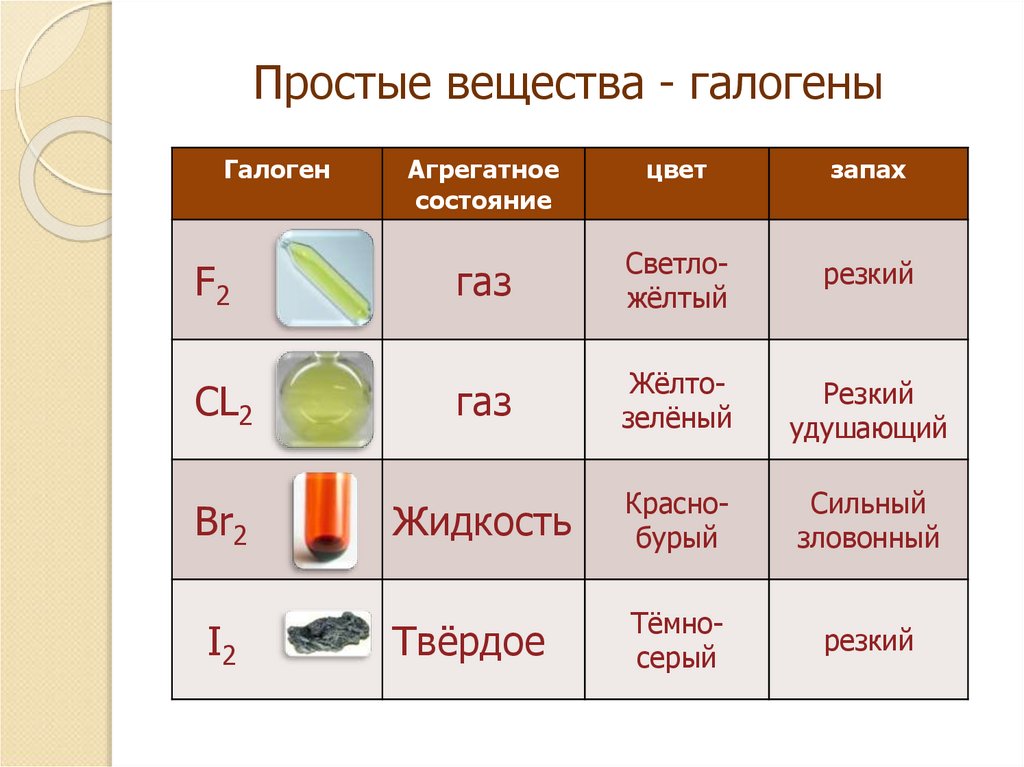
6. Простые вещества - галогены
ГалогенF2
CL2
Br2
I2
Агрегатное
состояние
цвет
запах
газ
Светложёлтый
резкий
газ
Жёлтозелёный
Резкий
удушающий
Жидкость
Краснобурый
Сильный
зловонный
Твёрдое
Тёмносерый
резкий
7. Домашнее задание
§ 29 № 9.5; № 9.7; № 9.19*(Хомченко)
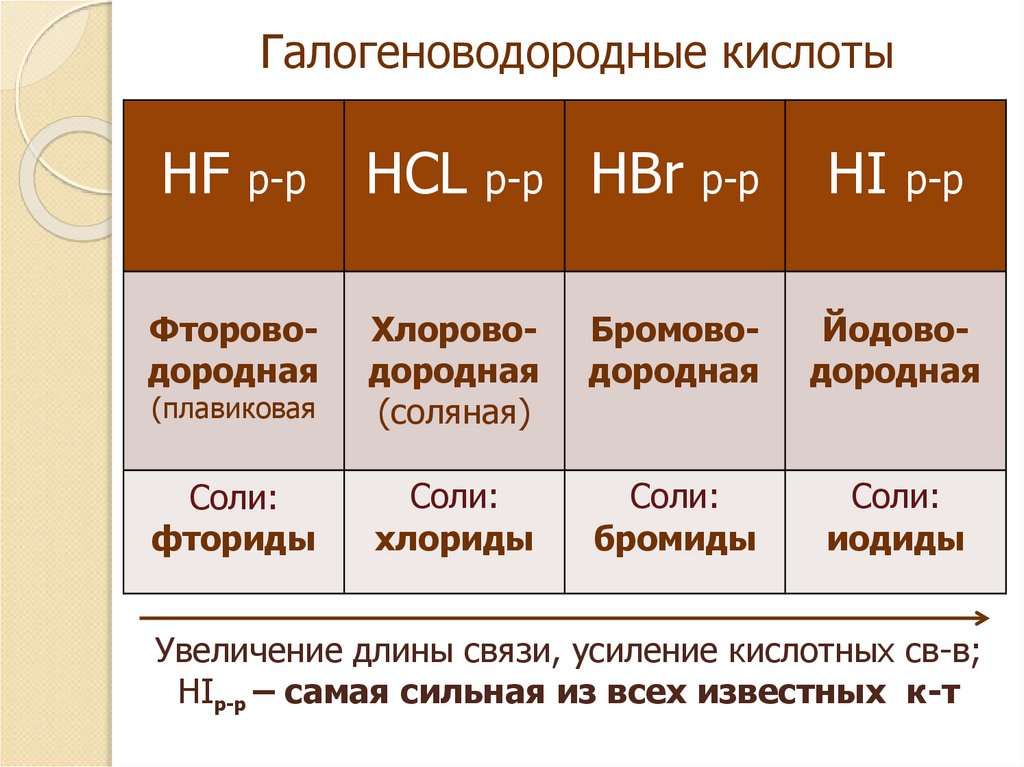
8. Галогеноводородные кислоты
HFр-р
HCL
р-р
HBr
р-р
HI
р-р
Фтороводородная
(плавиковая
Хлороводородная
(соляная)
Бромоводородная
Йодоводородная
Соли:
фториды
Соли:
хлориды
Соли:
бромиды
Соли:
иодиды
Увеличение длины связи, усиление кислотных св-в;
HIр-р – самая сильная из всех известных к-т
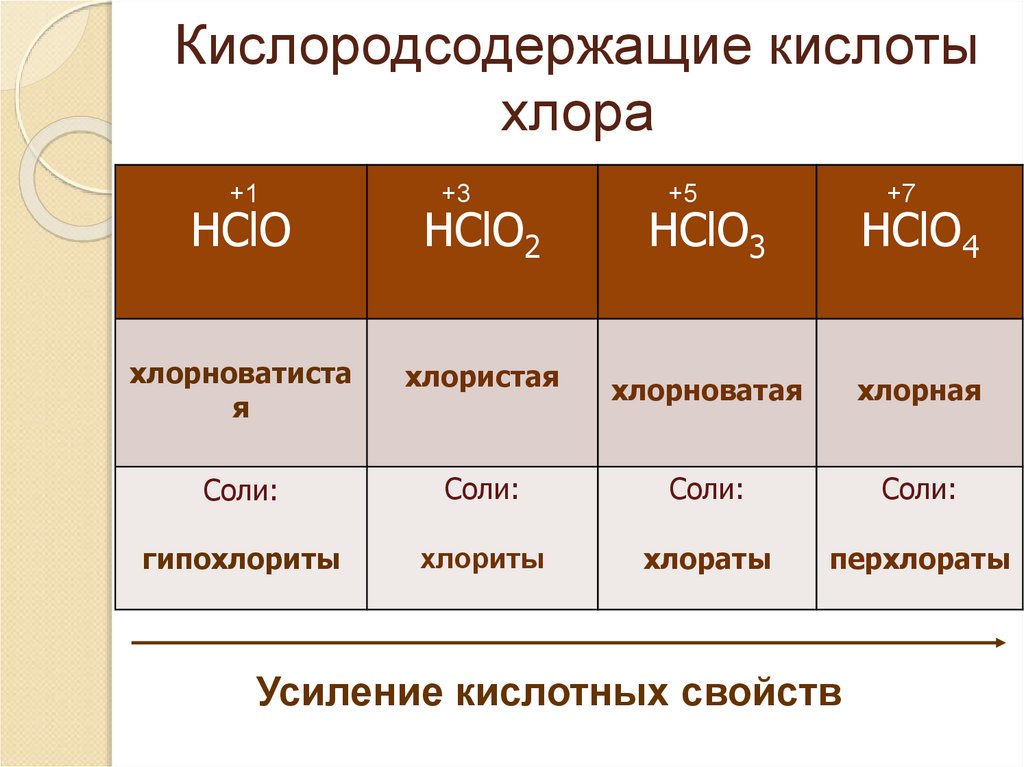
9. Кислородсодержащие кислоты хлора
+1+3
+5
+7
HClO
HClO2
HClO3
HClO4
хлорноватиста
я
хлористая
хлорноватая
хлорная
Соли:
Соли:
Соли:
Соли:
гипохлориты
хлориты
хлораты
перхлораты
Усиление кислотных свойств
10. Химические свойства хлора
1. Взаимодействие с неметаллами:o
o
+1 -1
H2 + Cl2 = 2HCl
-é
вос-ль
+é
ок-ль
O2 + Cl2 =хлор не горит в кислороде
2. Взаимодействие с металлами:
o
o
+2
-1
Cu + Cl2 = CuCl2
-é
вос-ль
+é
ок-ль
11. Химические свойства хлора
3. Взаимодействие с водой:Cl2 + H2O = HCl + HClO
4. Взаимодействие с солями:
Cl2 + 2NaBr = Br2 + 2NaCl
Получение брома
Br2 + NaCl = реакция не идёт
Более активный галоген может вытеснить менее
активный из его соли
12. 5. Взаимодействие сo щёлочами:
+1-1
0
Cl2 + 2NaOH = NaCl + NaClO + H2O
хол. р-р
-1
0
+5
3Cl2 + 6NaOH = 5NaCl+NaClO3 +3H2O
гор. р-р
Реакция самоокисления и самовосстановлениядиспропорционирования







 Химия
Химия








