Похожие презентации:
общая характеристика галогенов
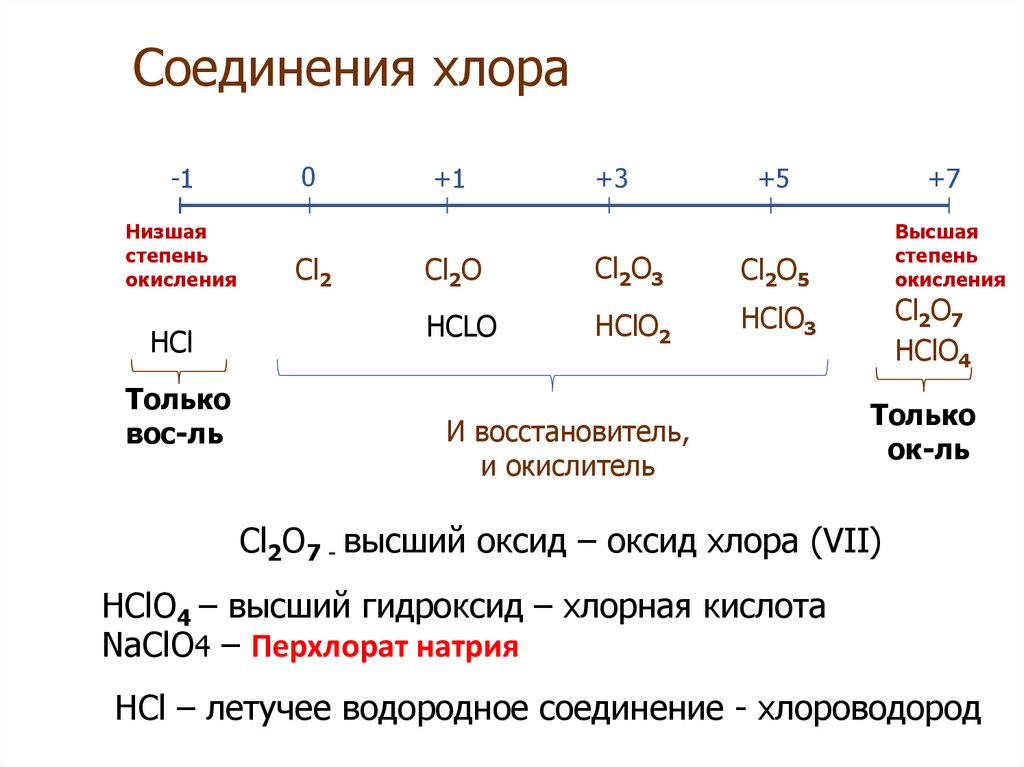
1. Соединения хлора
-1Низшая
степень
окисления
HCl
Только
вос-ль
0
Cl2
+1
+3
+5
+7
Высшая
степень
окисления
Cl2O
Cl2O3
Cl2O5
HCLO
HClO2
HClO3
И восстановитель,
и окислитель
Cl2O7
HClO4
Только
ок-ль
Cl2O7 - высший оксид – оксид хлора (VII)
HClO4 – высший гидроксид – хлорная кислота
NaClO4 – Перхлорат натрия
HCl – летучее водородное соединение - хлороводород
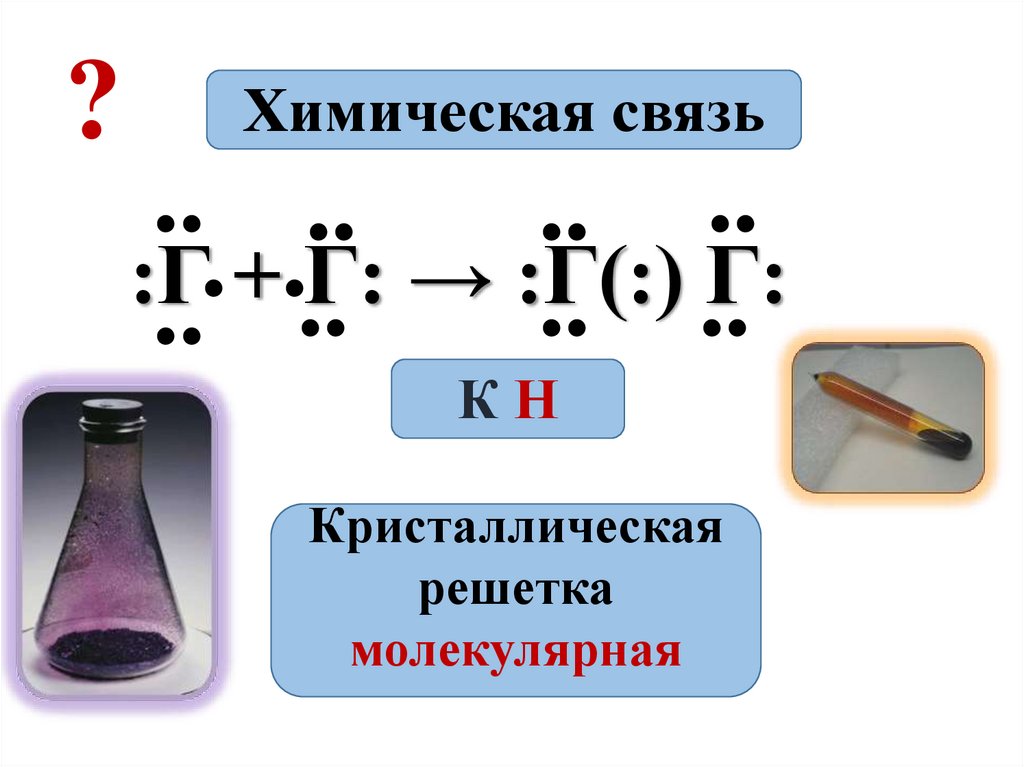
2.
?Химическая связь
.. ..
.. ..
.
.
:Г
+
Г:
→
:Г(:)
Г:
.. ..
.. ..
КН
Кристаллическая
решетка
молекулярная
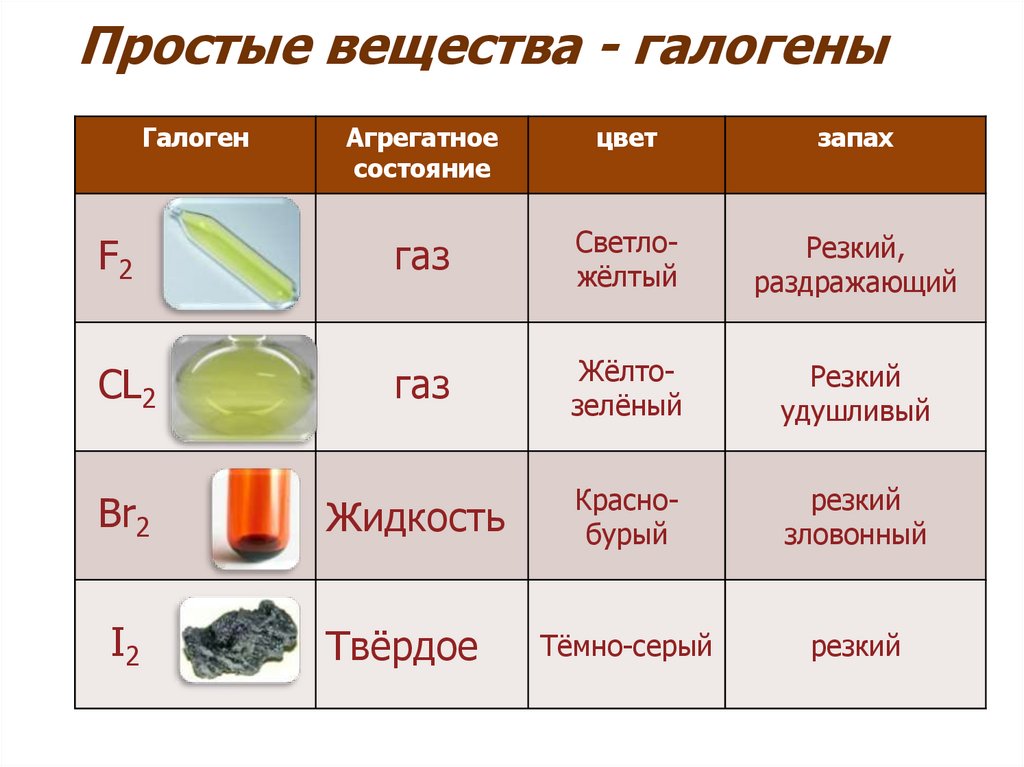
3. Простые вещества - галогены
ГалогенАгрегатное
состояние
цвет
запах
F2
газ
Светложёлтый
Резкий,
раздражающий
CL2
газ
Жёлтозелёный
Резкий
удушливый
Br2
Жидкость
Краснобурый
резкий
зловонный
I2
Твёрдое
Тёмно-серый
резкий
4.
Химические свойства галогенов1.Взаимодействие с металлами
+1
-1
2 Na0 + CI20 = 2 NaCI
CI20 окислитель
Получаются соли:
фториды,хлориды,бромиды,иодиды.
5. Химические свойства
Сильные окислители (+е)1. Взаимодействуют с металлами:
2Na + Cl2 = 2NaCl
Zn + Br2 =
Fe + Cl2 =
Al + I2 =
6.
+2-1
+3
-1
Кто окислитель?
7.
2.Взаимодействие с водородом+1 -1
Н20 + Г20 = 2Н Г
+1 -1
Н20 + F20 = 2Н F + Q
Н20 + CI20 = 2Н CI + Q
Н20 + Br20 = 2НBr
Н20 + I20 = 2Н I - Q
8. Химические свойства
2. Взаимодействуют с неметаллами:2S + Cl2 → S2Cl2 Возможно также получение и
других соединений серы с хлором: SCl2, SCl4.
2P + 3Cl2 = 2PCl3
2P + 5Cl2 = 2PCl5
Si + 2F2 = SiF4.
С кислородом не реагируют!
9.
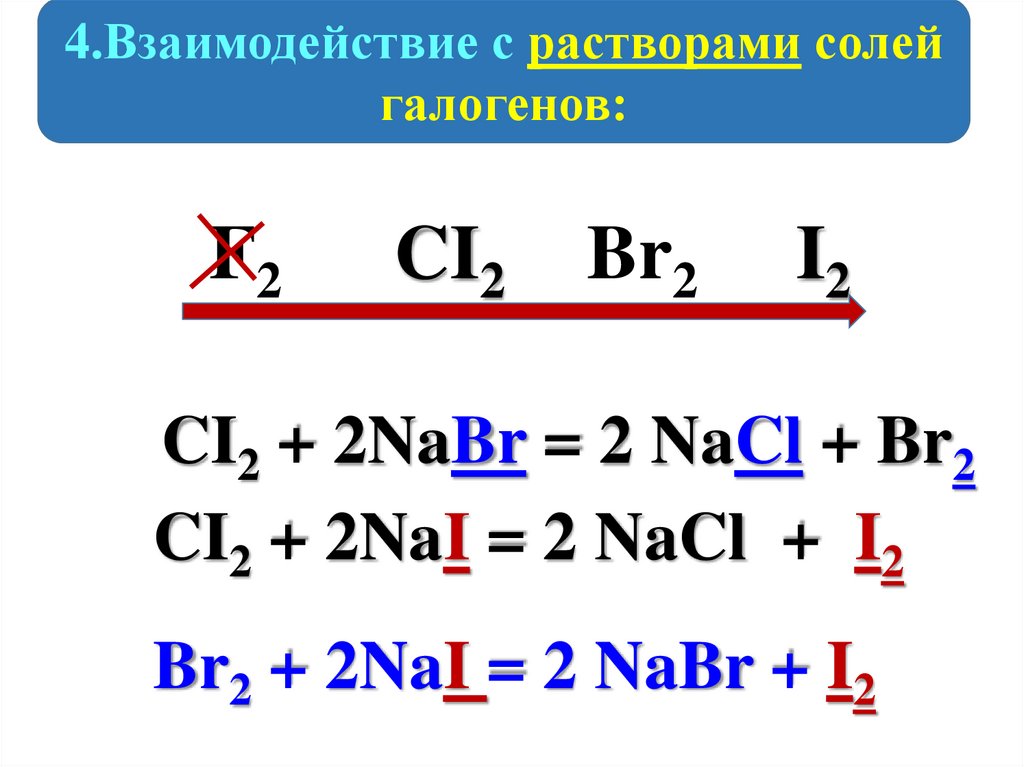
4.Взаимодействие с растворами солейгалогенов:
F2
CI2
Br2
I2
CI2 + 2NaBr = 2 NaCl + Br2
CI2 + 2NaI = 2 NaCl + I2
Br2 + 2NaI = 2 NaBr + I2
10. Химические свойства
Взаимодействуют со сложными веществами допишите возможныеуравнения реакций
а) с растворами солей
Cl2 + 2КF =
Cl2 + КBr =
Br2 + КI =
Br2 + КCl =
Окислительные свойства вниз по группе уменьшаются
11.
3.Взаимодействие с водойCI2 + H2O = HCI + HCIO
Соляная
кислота
Хлорноватистая
кислота
2F2 + 2Н2 О = 4НF + О2
плавиковая кислота
12. Химические свойства
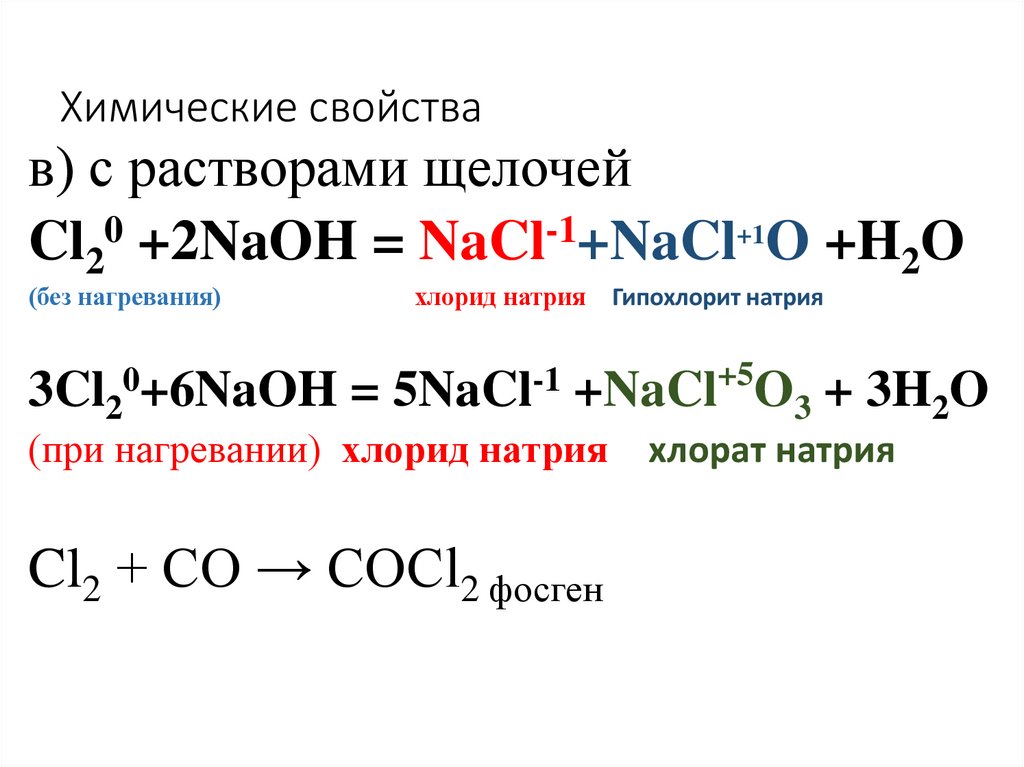
в) с растворами щелочейCl20 +2NaOH = NaCl-1+NaCl+1O +H2O
(без нагревания)
хлорид натрия
Гипохлорит натрия
+5
0
-1
3Cl2 +6NaOH = 5NaCl +NaCl O3 + 3H2O
(при нагревании) хлорид натрия
Cl2 + CO → COCl2 фосген
хлорат натрия
13.
1. В промышленности: электролиз расплава илираствора хлорида натрия
2NaCl
2Na + Cl2
2NaCl + 2H2O H2 + Cl2 + 2NaOH
2. В лаборатории:
4 HСl + MnO2
16 HСl + 2KMnO4
MnCl2 + Cl2 + 2H2O
2KСl + 2MnCl2 + 5Cl2 + 8H2O
14.
15.
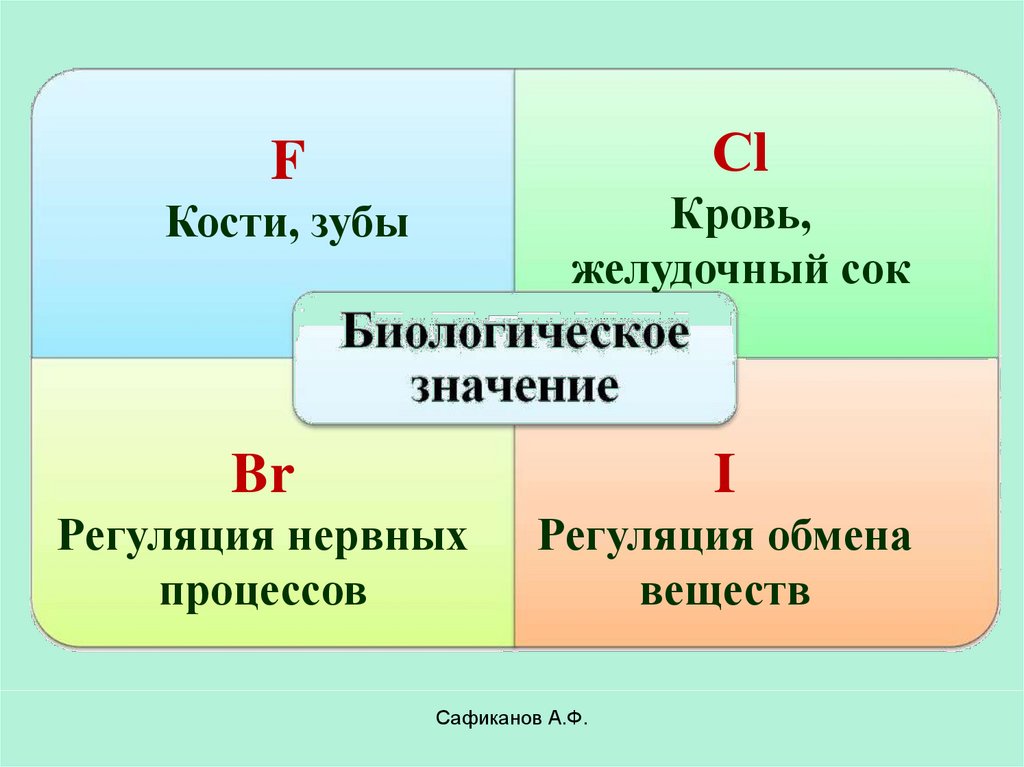
СlF
Кости, зубы
Кровь,
желудочный сок
Br
I
Регуляция нервных
процессов
Регуляция обмена
веществ
Сафиканов А.Ф.
16.
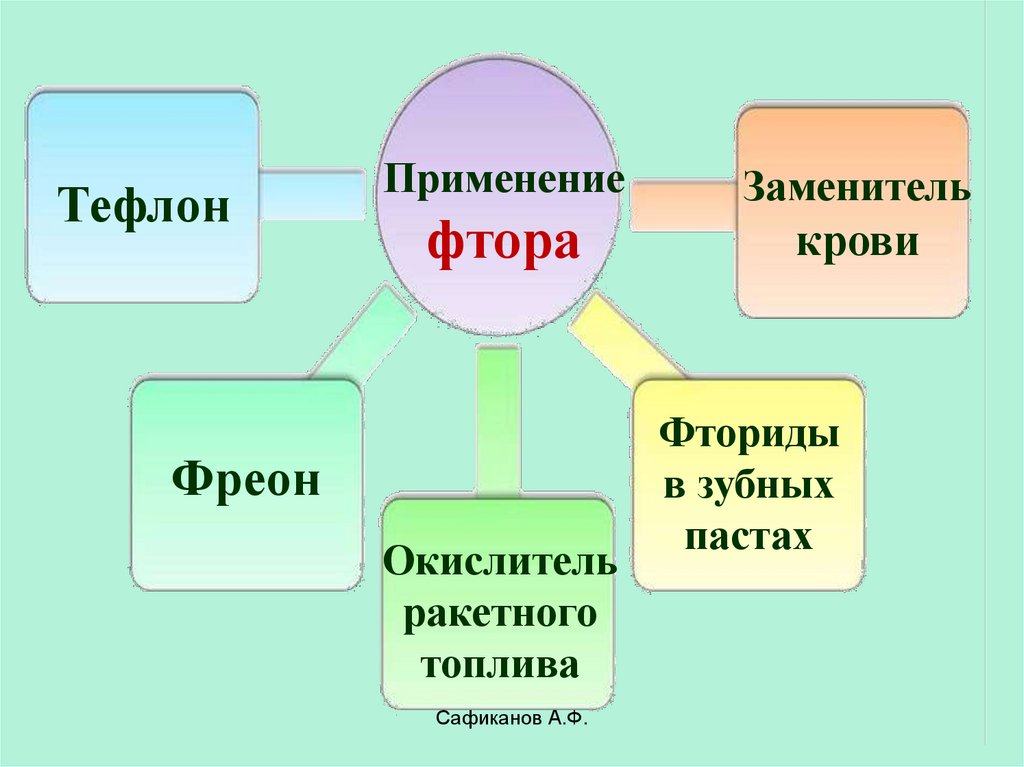
ТефлонПрименение
фтора
Фреон
Окислитель
ракетного
топлива
Сафиканов А.Ф.
Заменитель
крови
Фториды
в зубных
пастах


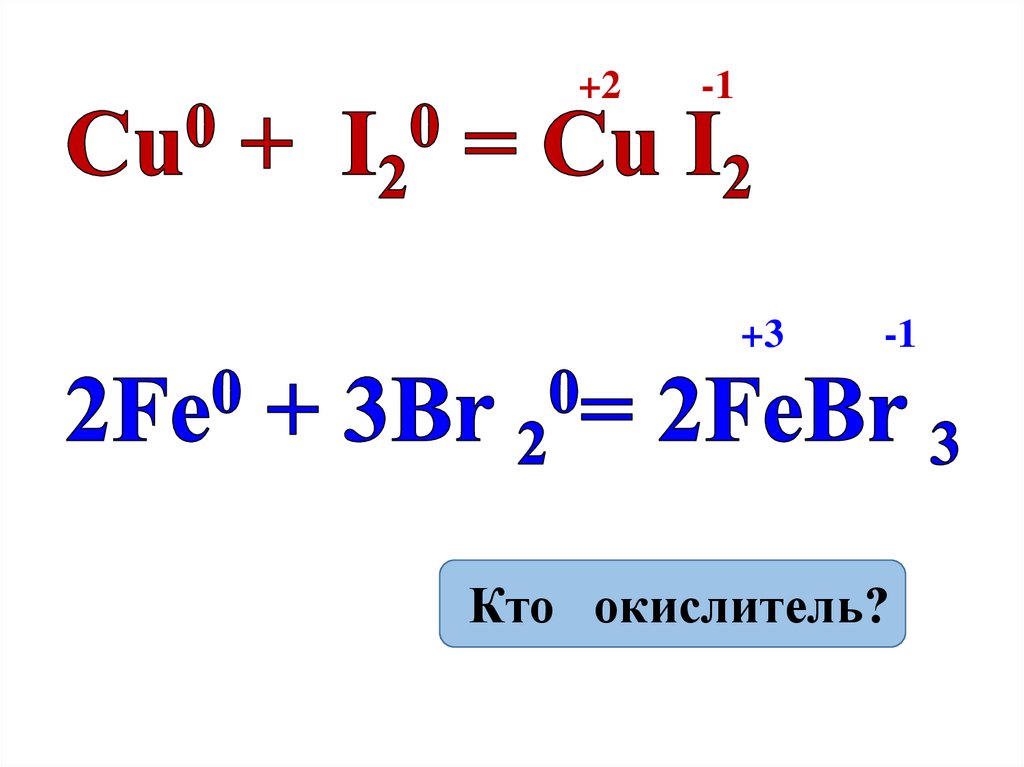






 Химия
Химия








