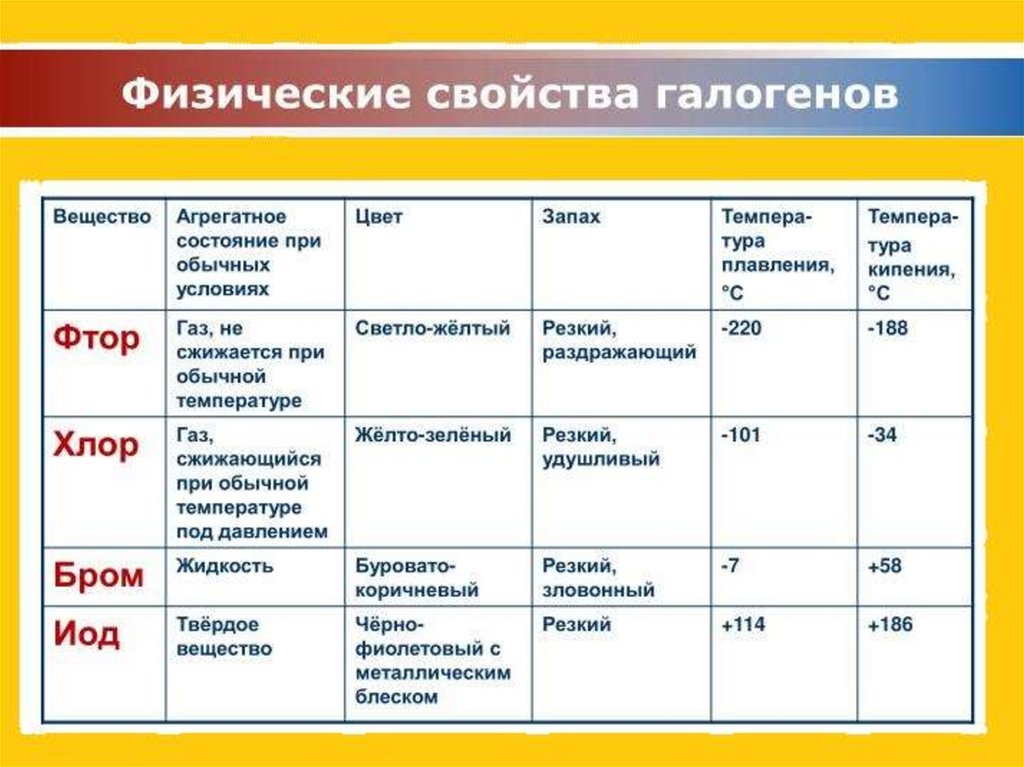
Похожие презентации:
Общая характеристика галогенов. Химические свойства на примере хлора (9 класс)
1. Химия 9 класс урок № 18 Дата 08.11.2024г
Тема урокаОбщая характеристика галогенов
Химические свойства на примере хлора
2.
• К элементам VII группы, главной подгруппы относятсяфтор F, хлор Cl, бром Br, иод I, астат At
• Общее название - галогены (греч. «солеобразующие») большинство их соединений с металлами представляют собой
типичные соли (KCl, NaCl и т.д.).
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
•Общая характеристика галогеновГалогены – это естественная группа
элементов , расположенных в главной
подгруппе 7 группы.
Фтор (F), хлор(Cl), бром (Br), йод (I), астат
(At)
Галогены имеют степень окисления
+1,+3,+5,+7, -1
У фтора только -1
В природе наиболее распространён- хлор.
Астат получен искусственным путём.
18.
Электронные формулыF 1S22S22P5
2
S
P
5
CI 1S22S22P63S23P5
Br …4S24P5
I
…5S25P5
Вывод: галогены - р - элементы
На внешнем энергетическом
уровне 7 электронов, один из них
неспаренный .
19.
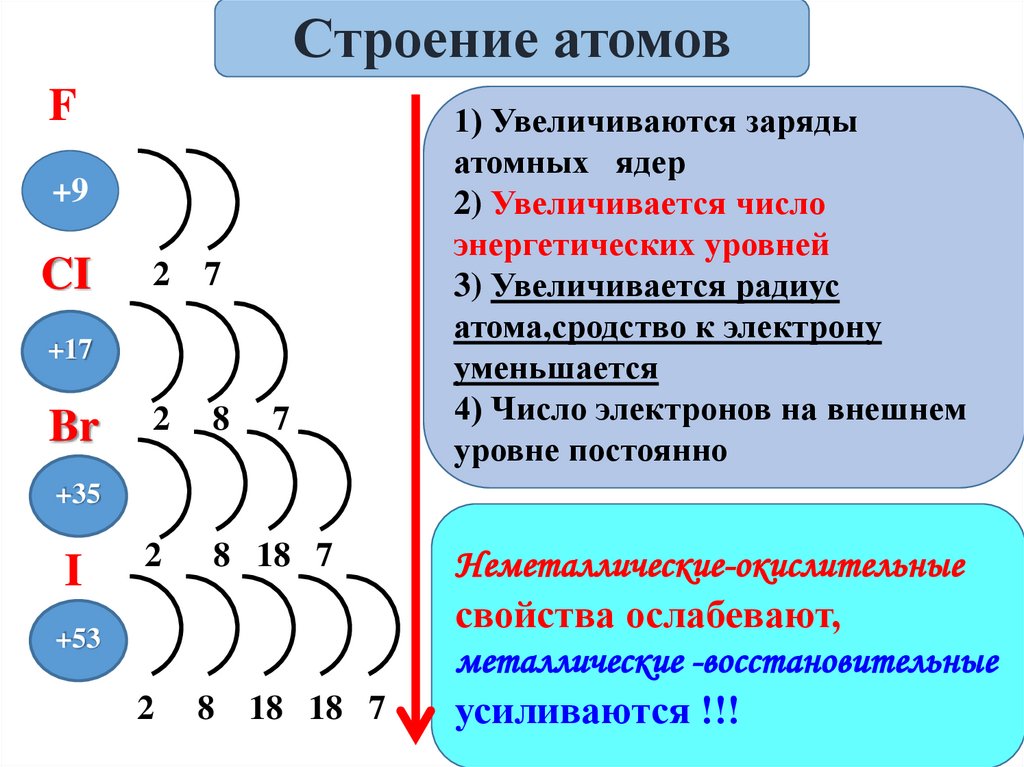
Строение атомовF
+9
CI
2
7
2
8
2
8 18 7
2
8
+17
Br
7
1) Увеличиваются заряды
атомных ядер
2) Увеличивается число
энергетических уровней
3) Увеличивается радиус
атома,сродство к электрону
уменьшается
4) Число электронов на внешнем
уровне постоянно
+35
I
+53
18 18 7
Неметаллические-окислительные
свойства ослабевают,
металлические -восстановительные
усиливаются !!!
20.
Определите степени окисленияатомов галогенов в веществах :
0
-1
-1
+5
+7
+3
-1
-1
+1
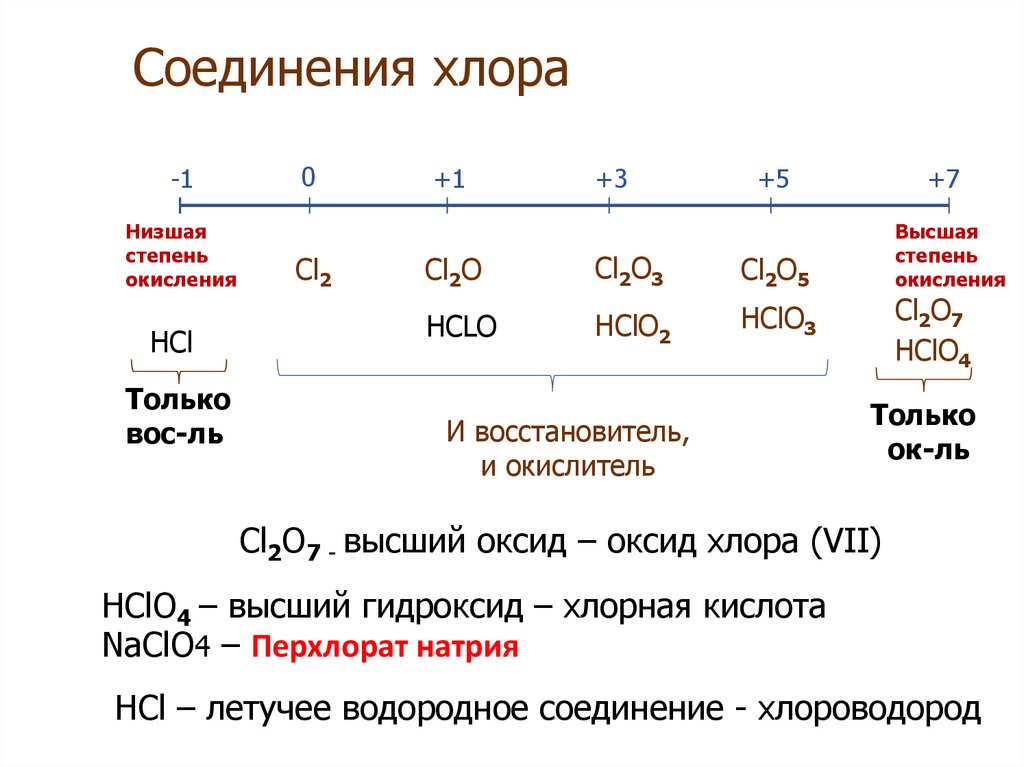
21. Соединения хлора
-1Низшая
степень
окисления
HCl
Только
вос-ль
0
Cl2
+1
+3
+5
+7
Высшая
степень
окисления
Cl2O
Cl2O3
Cl2O5
HCLO
HClO2
HClO3
И восстановитель,
и окислитель
Cl2O7
HClO4
Только
ок-ль
Cl2O7 - высший оксид – оксид хлора (VII)
HClO4 – высший гидроксид – хлорная кислота
NaClO4 – Перхлорат натрия
HCl – летучее водородное соединение - хлороводород
22.
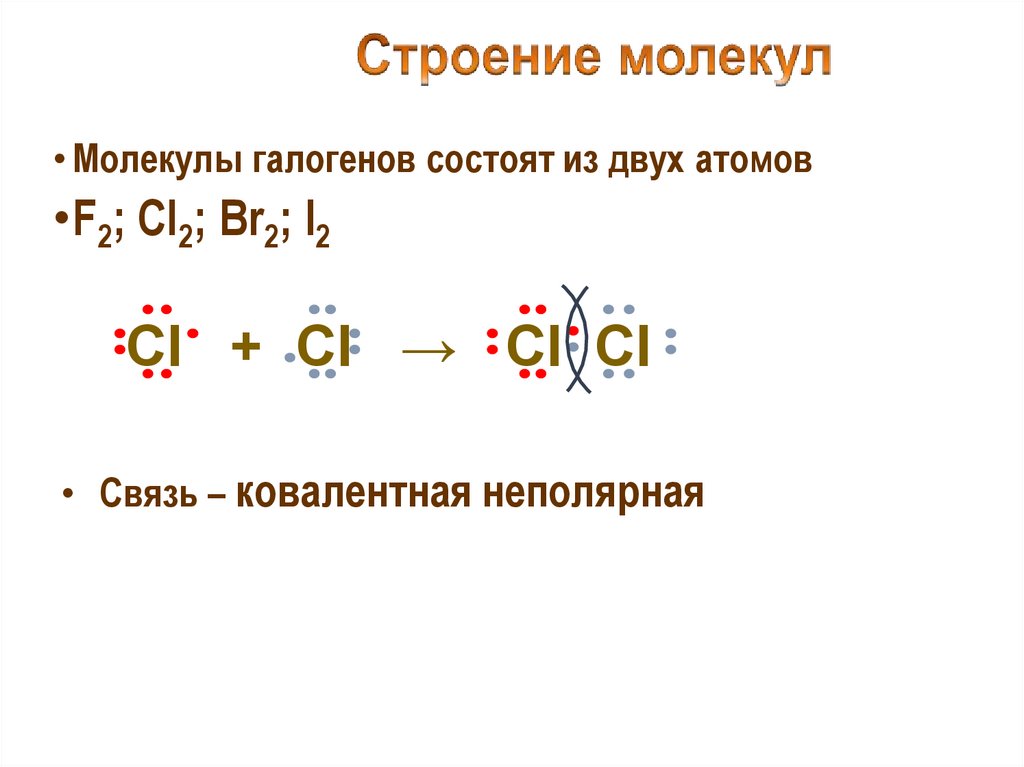
• Молекулы галогенов состоят из двух атомов•F2; Cl2; Br2; I2
Cl + Cl → Cl Cl
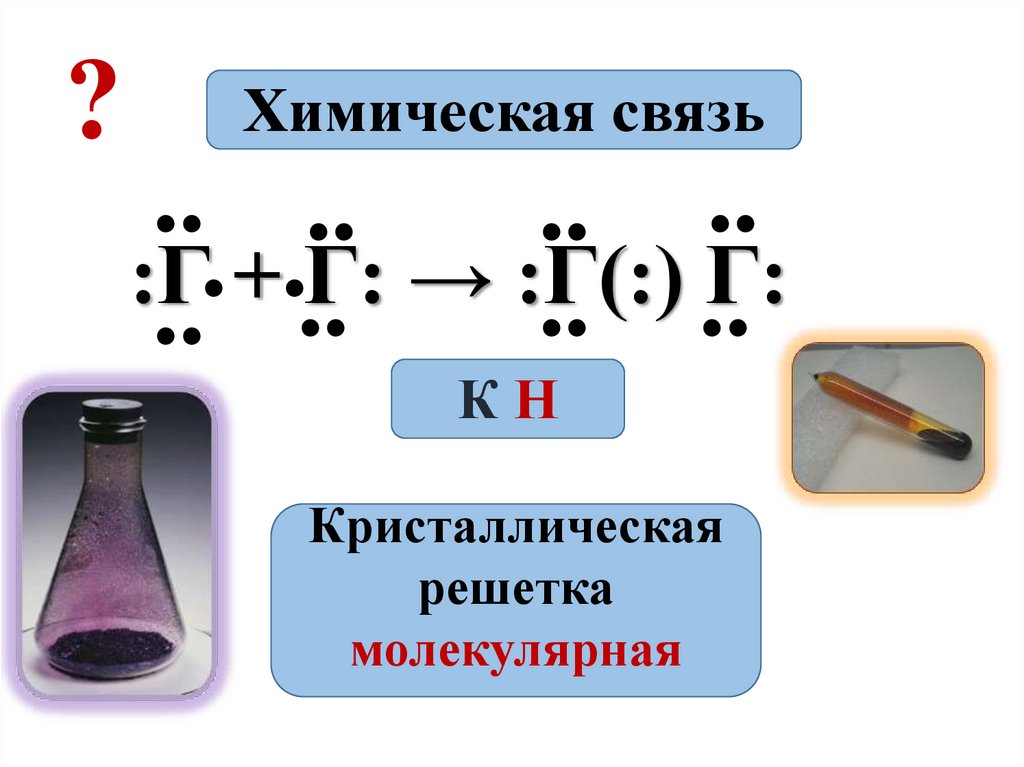
• Связь – ковалентная неполярная
23.
?Химическая связь
.. ..
.. ..
.
.
:Г
+
Г:
→
:Г(:)
Г:
.. ..
.. ..
КН
Кристаллическая
решетка
молекулярная
24.
25.
26.
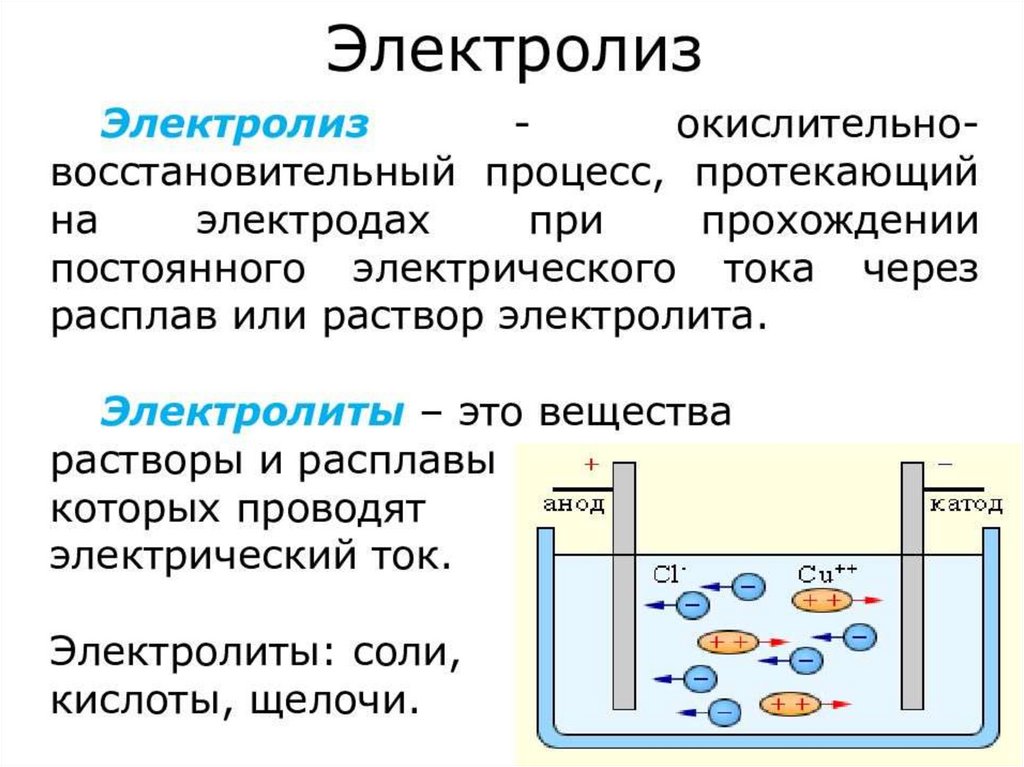
27. ПОЛУЧЕНИЕ ГАЛОГЕНОВ
• 1. Электролиз растворов и расплавов галогенидов:• 2NaCl + 2H2O = Cl2+ H2+ 2NaOH
• 2KF = 2K + F2 (единственный способ полученияя F2
• видео решение задачи на получение галогенов методом электролиза
https://rutube.ru/video/45b0747fda2768b97abd5bb34686fe83/?r=wd
• 2. Окисление галогенводородов:
• 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O – Лабораторный способ
получения хлора
• 14HBr+K2Cr2O7=2KBr+2CrBr3+3Br2+7H2O
• MnO2 + 4HHal = MnHal2 + Hal2 + 2 H2O– Лабораторный - (Для получения
хлора, брома, иода) . Hal в химии — это общее обозначение
галогенов
• 3. Промышленный способ – окисление хлором (для брома и йода):
• 2KBr+Cl2=2KCl+Br2
• 2KI + Cl2=2KCl + I2
28.
29.
Химические свойства галогенов1.Взаимодействие с металлами
+1
-1
2 Na0 + CI20 = 2 NaCI
CI20 окислитель
Получаются соли:
фториды,хлориды,бромиды,иодиды.
30. Химические свойства
Сильные окислители (+е)1. Взаимодействуют с металлами:
2Na + Cl2 = 2NaCl
Zn + Br2 =
Fe + Cl2 =
Al + I2 =
31.
+2-1
+3
-1
Кто окислитель?
32. Химические свойства
2. Взаимодействуют с неметаллами:2S + Cl2 → S2Cl2 Возможно также получение и
других соединений серы с хлором: SCl2, SCl4.
2P + 3Cl2 = 2PCl3
2P + 5Cl2 = 2PCl5
Si + 2F2 = SiF4.
С кислородом не реагируют!
33.
2.Взаимодействие с водородом+1 -1
Н20 + Г20 = 2Н Г
+1 -1
Н20 + F20 = 2Н F + Q
Н20 + CI20 = 2Н CI + Q
Н20 + Br20 = 2НBr
Н20 + I20 = 2Н I - Q
34.
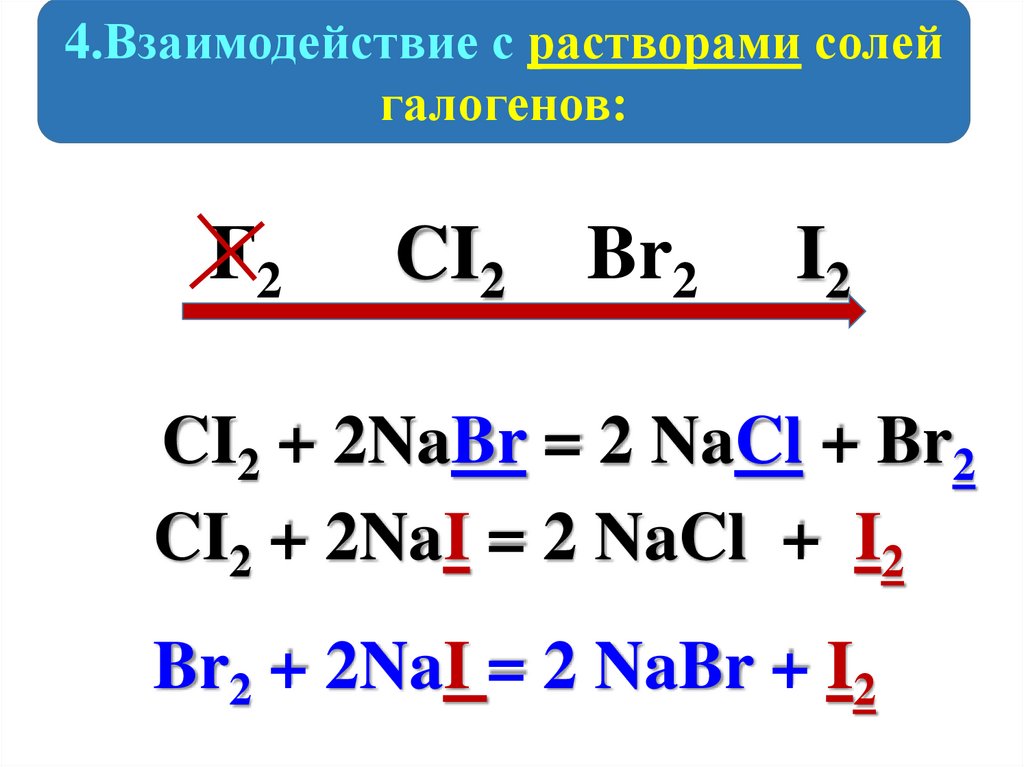
4.Взаимодействие с растворами солейгалогенов:
F2
CI2
Br2
I2
CI2 + 2NaBr = 2 NaCl + Br2
CI2 + 2NaI = 2 NaCl + I2
Br2 + 2NaI = 2 NaBr + I2
35. Химические свойства
Взаимодействуют со сложными веществами допишите возможныеуравнения реакций
а) с растворами солей
Cl2 + 2КF =
Cl2 + КBr =
Br2 + КI =
Br2 + КCl =
Окислительные свойства вниз по группе уменьшаются
36.
3.Взаимодействие с водойCI2 + H2O = HCI + HCIO
Соляная
кислота
Хлорноватистая
кислота
2F2 + 2Н2 О = 4НF + О2
плавиковая кислота
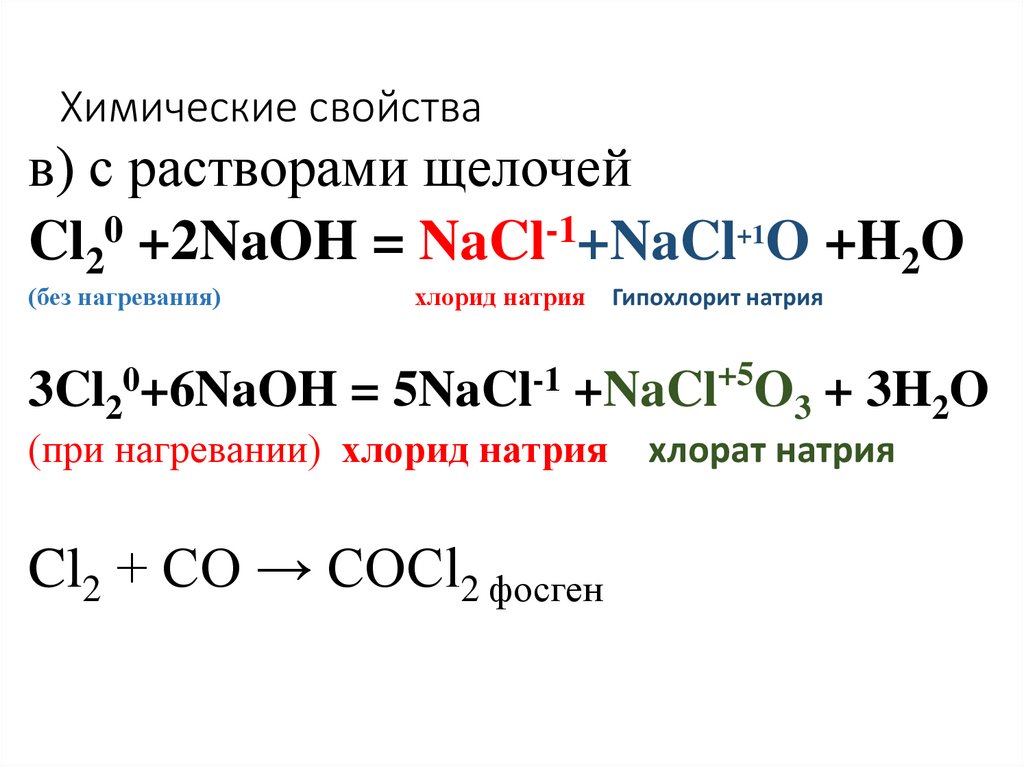
37. Химические свойства
в) с растворами щелочейCl20 +2NaOH = NaCl-1+NaCl+1O +H2O
(без нагревания)
хлорид натрия
Гипохлорит натрия
+5
0
-1
3Cl2 +6NaOH = 5NaCl +NaCl O3 + 3H2O
(при нагревании) хлорид натрия
Cl2 + CO → COCl2 фосген
хлорат натрия
38. Химические свойства
• Рассмотрим свойства галогенов на примере хлора:• 1.Взаимодействие с металлами
• 2K + Cl2→2KCl
Mg + Cl2→MgCl2
• 2.Реакции с неметаллами
• H2 + Cl2 → 2HCl
• 3.Взаимодействие со щелочами на холоде
• 2NaOH + Cl2 → NaCl + NaClO + H2O
• 4.Взаимодействие со щелочами при нагревании
• 6NaOH + 3Cl2 → 5NaCl + NaClO3 + 3H2O
• 5.Вытеснение менее активных галогенов из галогенидов
• 2KBr + Cl2 → 2KCl + Br2
• 6. С водой
• H2O + Cl2 ↔ HCl + HClO (хлорная вода)
39. Качественные реакции на галогенид-ионы
Качественные реакции на галогенидионыКачественные реакции на хлориды, бромиды и
йодиды -образование нерастворимых
галогенидов серебра:
NaCl + AgNO3 → AgCl↓ + NaNO3
белый творожистый осадок
NaBr + AgNO3 → AgBr↓ + NaNO3
желтоватый творожистый осадок
NaI + AgNO3 → AgI↓ + NaNO3
желтый творожистый осадок
40.
41.
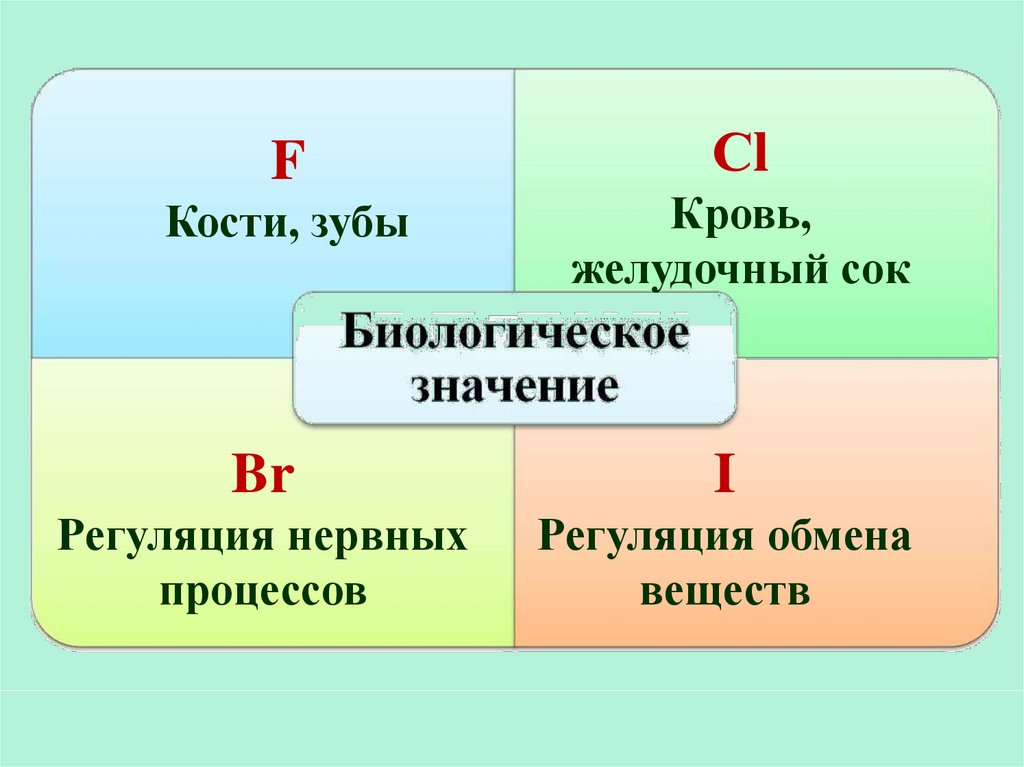
FСl
Кости, зубы
Кровь,
желудочный сок
Br
I
Регуляция нервных
процессов
Регуляция обмена
веществ
42.
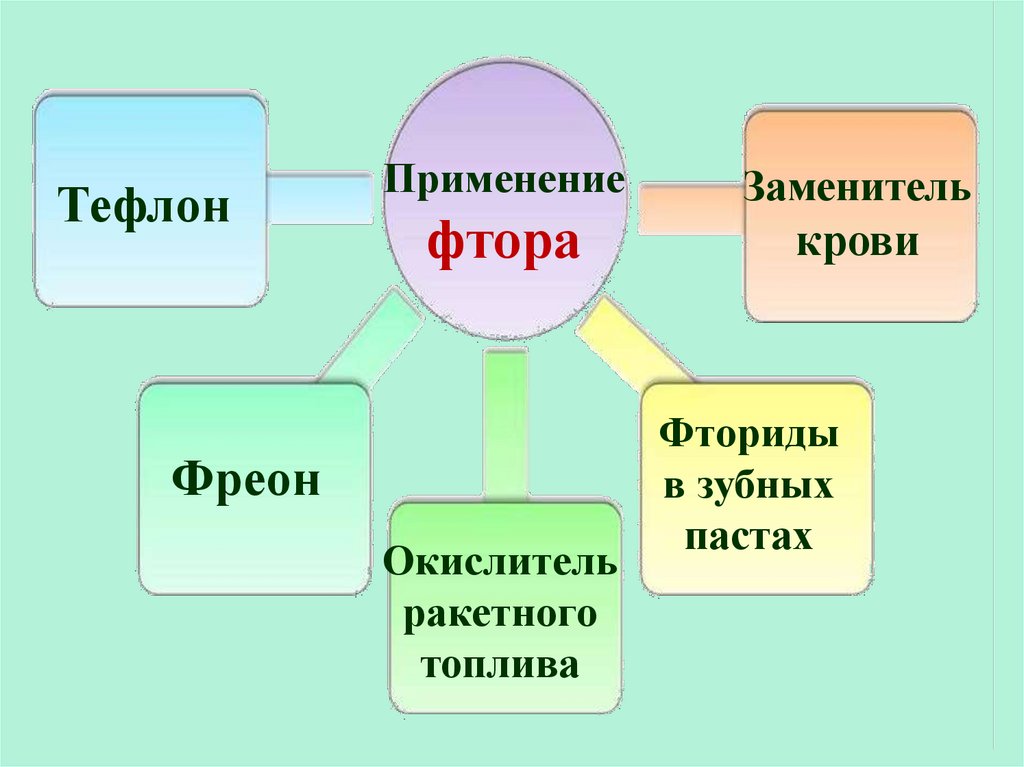
ТефлонПрименение
фтора
Фреон
Окислитель
ракетного
топлива
Заменитель
крови
Фториды
в зубных
пастах
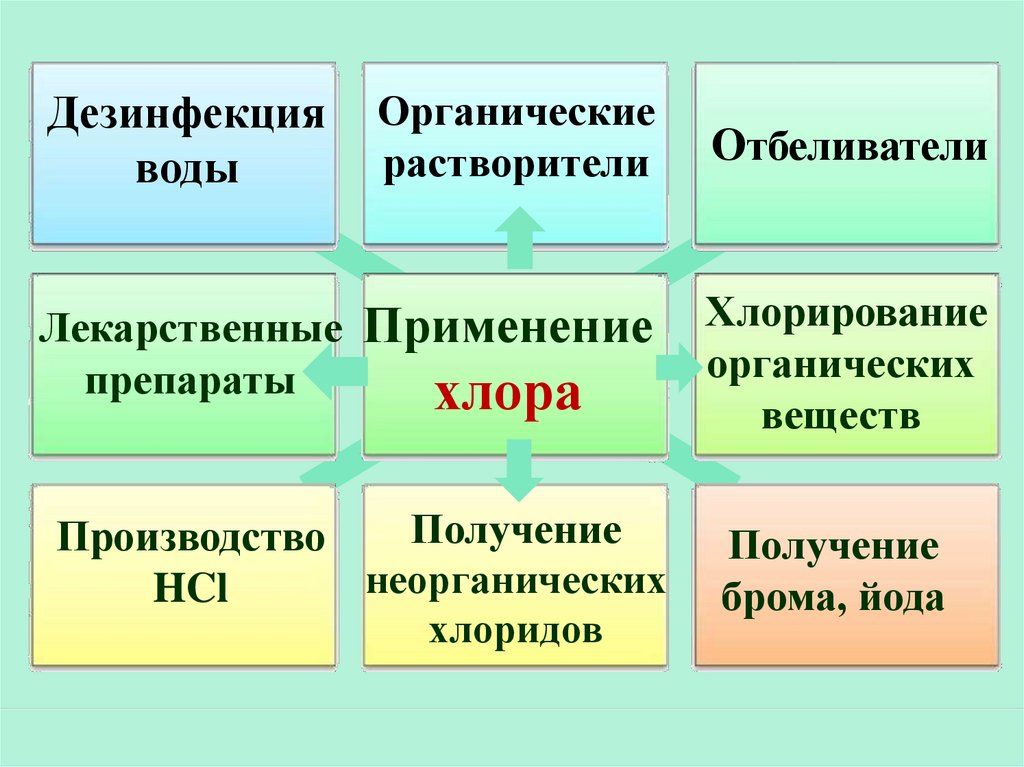
43.
Органическиерастворители
Отбеливатели
Лекарственные Применение
препараты
хлора
Хлорирование
органических
веществ
Получение
Производство
неорганических
HCl
хлоридов
Получение
брома, йода
Дезинфекция
воды
44.
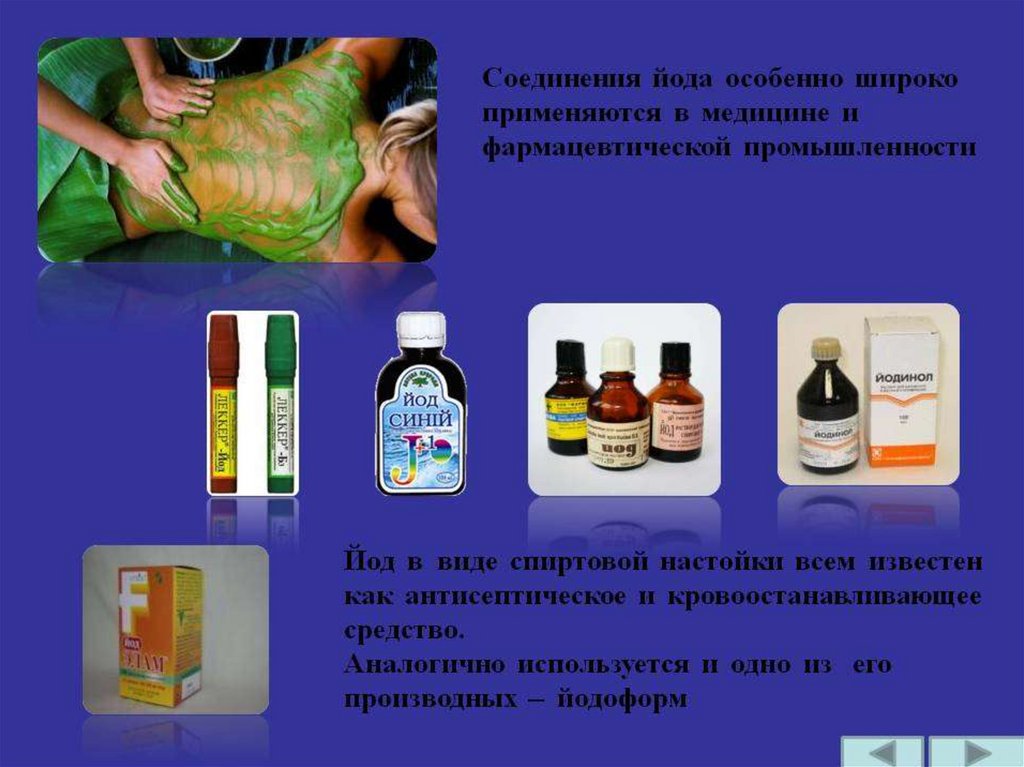
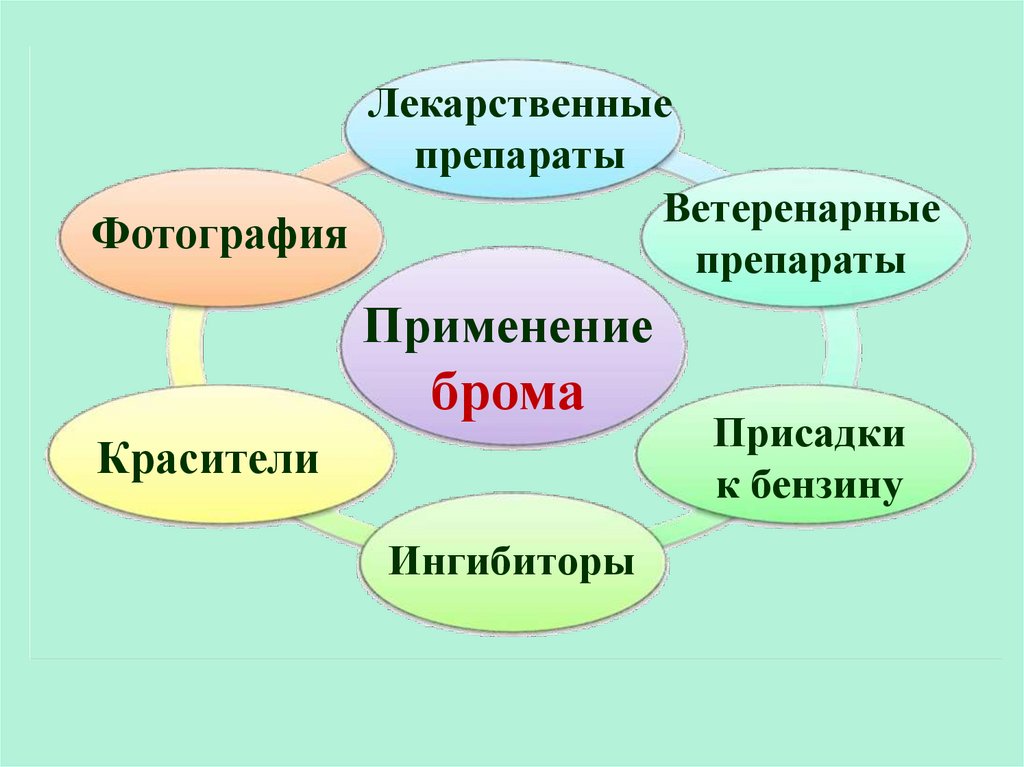
Лекарственныепрепараты
Ветеренарные
Фотография
препараты
Применение
брома
Красители
Ингибиторы
Присадки
к бензину
45.
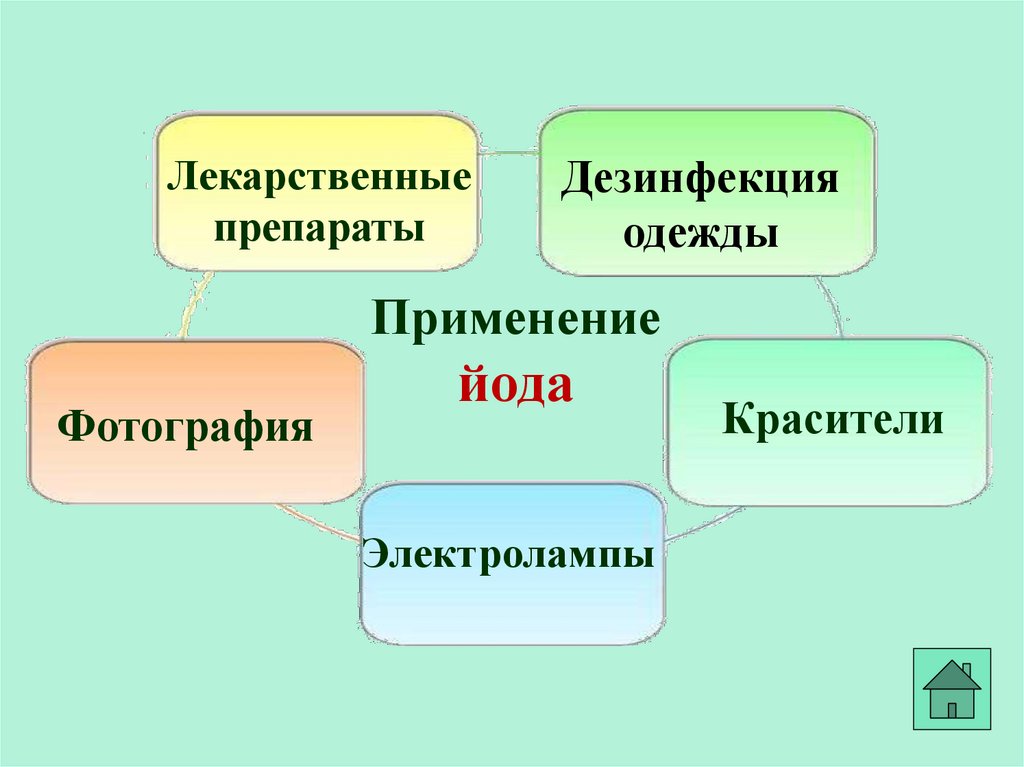
Лекарственныепрепараты
Дезинфекция
одежды
Применение
Фотография
йода
Электролампы
Красители
46. Закрепление материала
• 1. Расскажите о нахождении галогенов в природе?• 2. Какова роль этих элементов ? Где они применяются ?
• С помощью какого вещества можно определить наличие галогенионов в растворах?
• Назовите химические свойства галогенов.
• Упр. №6 (б) стр.67
47.
Домашнее задание:§ 11 выучить,
Упр. №6(а) на стр.67
По желанию задание 9
на стр.67























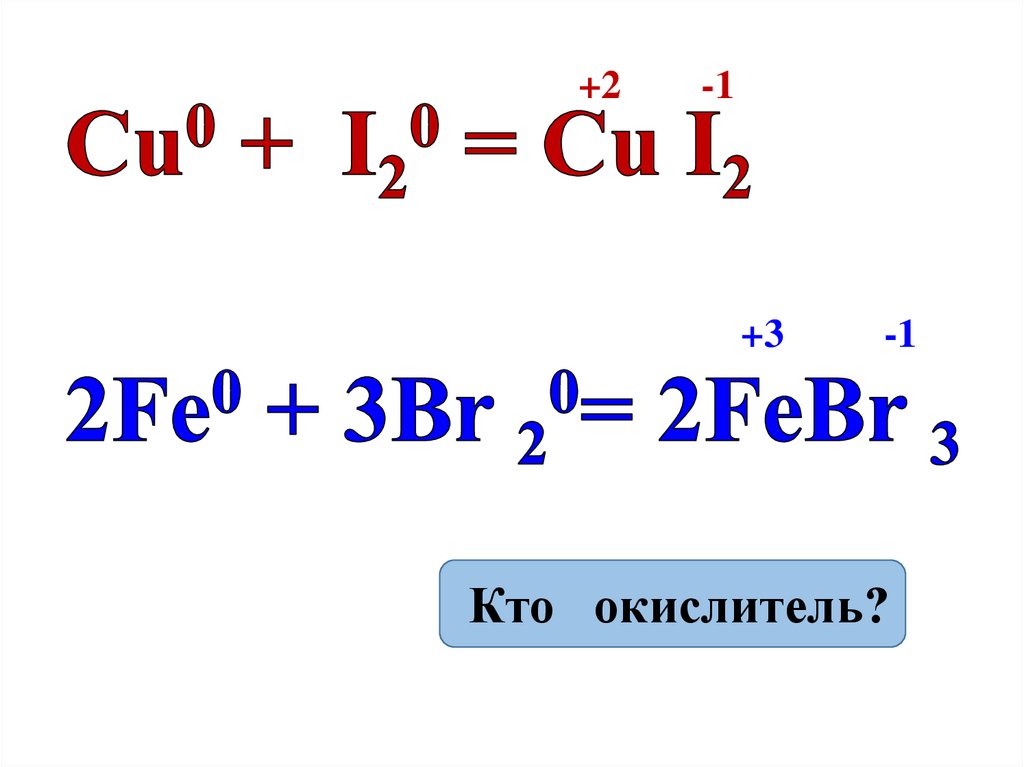









 Химия
Химия








