Похожие презентации:
Неорганическая химия. Гетерогенные равновесия. Часть 1
1. Неорганическая химия, часть 1
Кубанский государственный университетБуков Николай Николаевич
Неорганическая химия, часть 1
Факультет - химии и высоких технологий
Направление подготовки – 04.03.01 Химия (ОДО)
Курс - первый
Семестр - первый
2.
Гетерогенные равновесия. Понятие о фазе, независимом компоненте, числе степенейсвободы. Основной закон гетерогенного равновесия (правило фаз Гиббса). Диаграммы
состояния, фазовая диаграмма воды. Диаграммы состав свойства для процесса
кристаллизации в двухкомпонентных системах различного вида. Твердые растворы.
Жидкие растворы. Способы выражения состава раствора. Растворимость. Энергетика
процессов растворения, влияние энтальпийного и энтропийного факторов. Идеальные
растворы. Закон Рауля. Кипение и замерзание растворов. Определение молекулярной
массы в эбулиоскопическом и криоскопическом методе. Осмос. Осмотическое давление.
Отклонения растворов от идеальности. Активность. Коэффициент активности.
Электролитическая диссоциация. Изотонический коэффициент. Теория Дебая – Хюккеля
для растворов электролитов. Сильные и слабые электролиты. Диссоциация слабых
электролитов. Константа и степень диссоциации. Закон разбавления Оствальда.
Равновесие между раствором электролита и осадком. Произведение растворимости.
Условие выпадения осадка. Солевой эффект. Диссоциация воды. Водородный показатель.
Расчет pH растворов кислот и оснований. Гидролиз солей, расчет рН растворов
гидролизующихся солей, условия протекания «необратимого» гидролиза. Буферные
растворы, расчет рН, буферная емкость. Основные положения протолитической теории
Бренстеда-Лоури, применение к реакциям нейтрализации, диссоциации, гидролиза,
протекающим в водных растворах; сопряженные пары кислот и оснований. Применение
теории Бренстеда-Лоури к неводным растворам. Теория Льюиса. Основные понятия
теории Пирсона, жесткие и мягкие кислоты и основания, применение теории к реакциям
комплексообразования, объяснение устойчивости комплексов.
3.
4.
5.
Р-р NaCl 0,6%,Р-р C12H22O11 6%,
6.
7.
8.
9.
10.
0,111.
Возвращаясь к электролитам рассмотрим небольшой демонстрационный опыт12.
Электролиты — это вещества, растворы или расплавы которыхпроводят электрический ток.
К электролитам относятся кислоты, основания и соли.
Вещества, не проводящие электрического тока в растворенном или
расплавленном состоянии, называют неэлектролитами. К ним
относятся многие органические вещества, например: сахара,
спирты и др.
Способность растворов электролитов проводить электрический ток
объясняют тем, что молекулы электролитов при растворении
распадаются на электрически положительно и отрицательно
заряженные частицы — ионы. Величина заряда иона численно
равна валентности атома или группы атомов, образующих ион.
Положительно заряженные ионы называют катионами,
отрицательно заряженные—анионами. Катионы образуют атомы
водорода Н+, металлов: К+, Na+, Са2+, Fe3+ и некоторые группы
атомов, например группа аммония NH+4; анионы образуют атомы и
группы атомов, являющиеся кислотными остатками, например Cl—,
NO—3, SO2—4, CO2—3.
Термин Электролит введен в науку Фарадеем.
13.
Оба закона Фарадея можно привести к общей формуле: m = (q / F) ∙ (μ/z).14.
15.
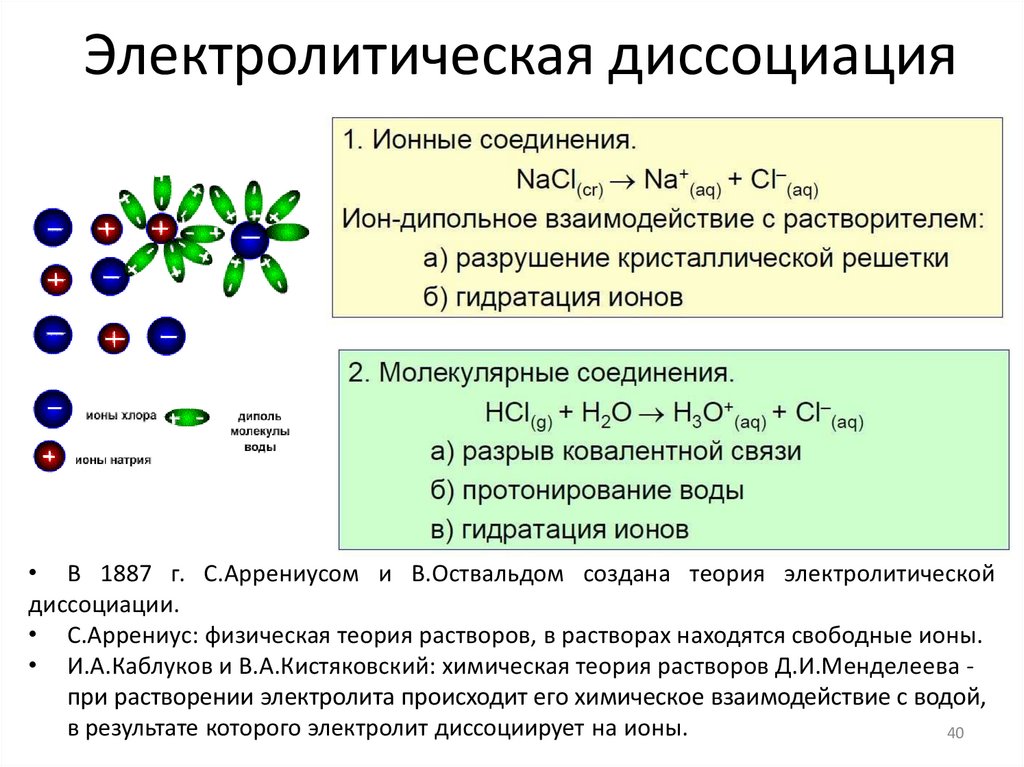
16. Электролитическая диссоциация
• В 1887 г. С.Аррениусом и В.Оствальдом создана теория электролитическойдиссоциации.
• С.Аррениус: физическая теория растворов, в растворах находятся свободные ионы.
• И.А.Каблуков и В.А.Кистяковский: химическая теория растворов Д.И.Менделеева при растворении электролита происходит его химическое взаимодействие с водой,
в результате которого электролит диссоциирует на ионы.
40
17.
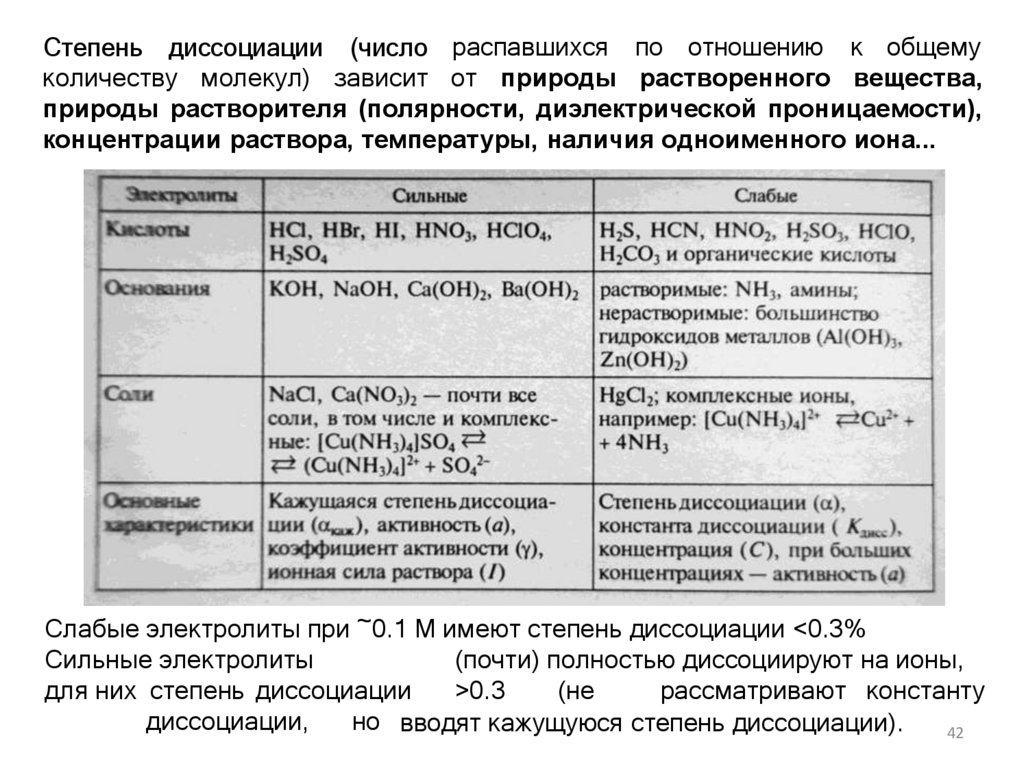
Степень диссоциации (число распавшихся по отношению к общемуколичеству молекул) зависит от природы растворенного вещества,
природы растворителя (полярности, диэлектрической проницаемости),
концентрации раствора, температуры, наличия одноименного иона...
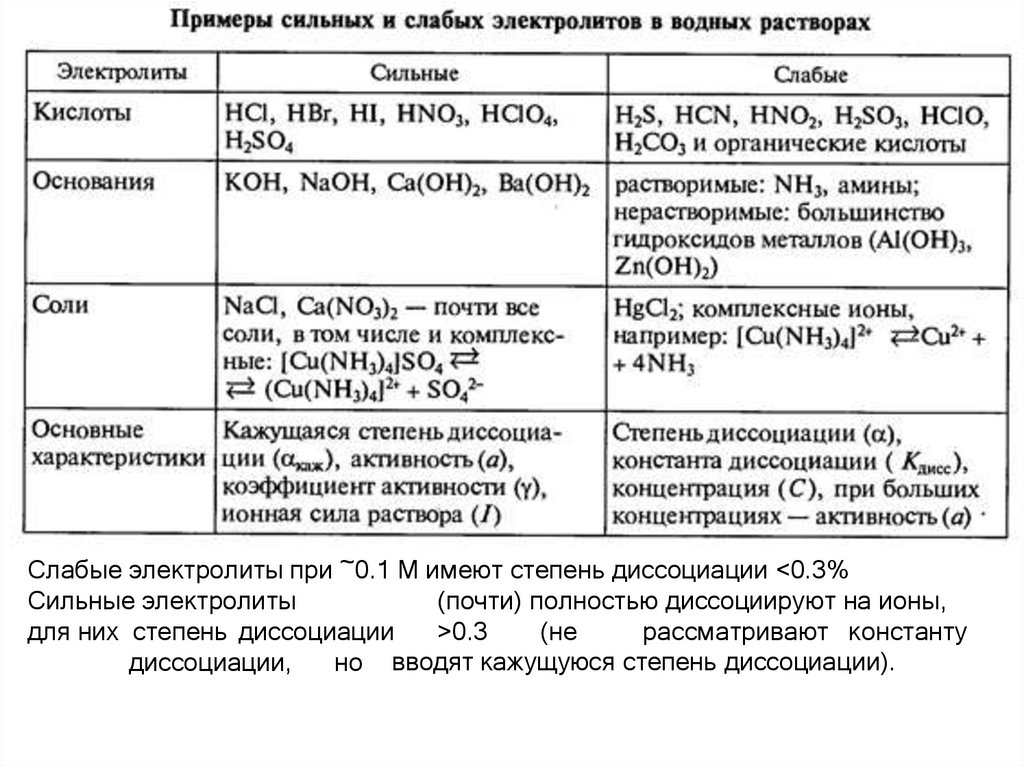
18. Сильные и слабые электролиты
4119.
Слабые электролиты при ~0.1 М имеют степень диссоциации <0.3%Сильные электролиты
(почти) полностью диссоциируют на ионы,
для них степень диссоциации
>0.3
(не
рассматривают константу
диссоциации,
но вводят кажущуюся степень диссоциации).
20.
21.
22.
23.
24.
Акти́вность компонентов раствора — эффективная (кажущаяся) концентрациякомпонентов с учётом различных взаимодействий между ними в растворе, то есть с
учётом отклонения поведения системы от модели идеального раствора.
Активность отличается от общей концентрации на некоторую величину.
Отношение активности (α) к общей концентрации вещества в растворе (с)
называется коэффициентом активности (γ): γ = α/с.
В свою очередь активность равна молярной концентрации, умноженной на
коэффициент активности: α = c γ.
Коэффициент активности (как и изотонический коэффициент) служит мерой
отклонения поведения раствора (или компонента раствора) от идеального.
25.
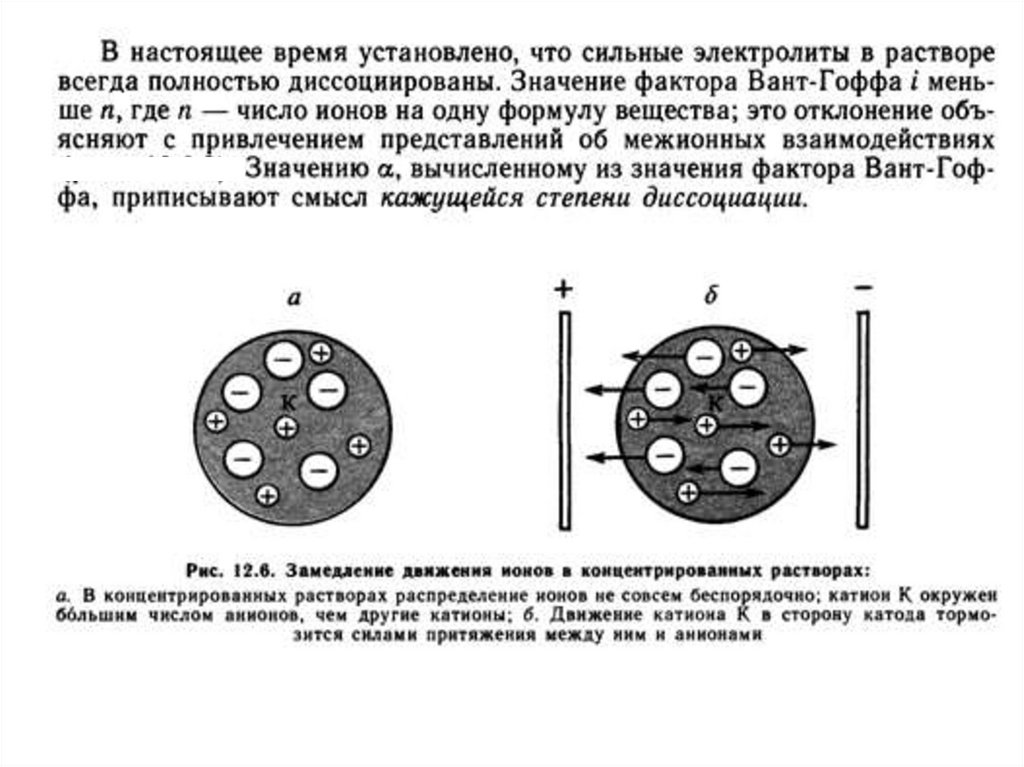
26. Сильные электролиты
- ионная сила раствора (сильные электролиты)
— мера
«интенсивности
электрического
поля»,
создаваемого
ионами
в
растворе,
полусумма
произведений из концентрации всех ионов в растворе на
квадрат их заряда. В теории сильных следует
рассматривать не концентрации, а активности, в теории
Дебая - Хюккеля существует связь между коэффициентом
активности иона и ионной силой раствора:
где γ — коэффициент активности, А — постоянная, не
зависящая от заряда иона и ионной силы раствора, но
зависящая от температуры и диэлектрической
вода
–
82,
постоянной
растворителя:
ацетонитрил
– 37,
диметилсульфоксид
– 47,
диметилформамид – 37, этиловый спирт – 26, аммиак 25, ацетон – 22…
43
27.
✔•Для сильных электролитов важно, чтобы ионы «чувствовали»
притяжение или отталкивание друг от друга в существенно
меньшей степени, чем в пустоте (вакууме), что облегчает
растворение и должно, в свою очередь, зависеть от
диэлектрической проницаемости растворителя.
•Ионая
сила –
обобщенный параметр,
описывающий «среднее» поле от уже растворенных ионов.
• В теории Дебая – Хюккеля не учитывается химическая
природа растворителя, хотя во многих других теориях
координирующая
способность молекул растворителя
является ключевым парметром, и это выражается
«акцепторными» и «донорными» числами конкретного
растворителя, что позволяет предсказать их растворяющую
способность по отношению к тем или иным классам
растворяемых веществ.
28. Константа диссоциации (слабые электролиты)
4529.
Закон разведения Оствальда.В слабых электролитах величина α << 1. Поэтому значением α можно пренебречь и
величину (1-α) принять равной 1. Тогда K=Cα2, т.е. степень диссоциации слабых
электролитов обратно пропорциональна квадратному корню из концентрации.
Таким образом, закон разбавления Оствальда формулируется следующим образом:
степень диссоциации электролита при разбавлении раствора увеличивается.
30.
31.
32.
При прибавлении в раствор слабой кислоты или основания соли, содержащейодноимённый анион или катион для кислоты или основания соответственно, то
согласно принципу Ле-Шателье, следует ожидать смещения равновесия диссоциации
влево, т.е. в сторону уменьшения степени диссоциации. Так, если к раствору
уксусной кислоты добавить немного ацетата натрия, то добавленные ацетат-ионы
смещают равновесие диссоциации кислоты
СН3СООН ↔ CH3COO – + H+
влево и степень диссоциации уксусной кислоты уменьшается.
Об этом свидетельствуют приведенные ниже данные:
[СН3СООNa], моль/л
0,0
0,001
0,002
α СН3СООН, %
4,1
1,5
0,84
0,005
0,35
0,010
0,18
0,020
0,09
Подавление диссоциации под влиянием одноимённого иона называется “репрессией
ионизации”. С репрессией ионизации связаны многие процессы, имеющие
практическое значение. Так, её используют для уменьшения растворимости тех или
иных соединений.
33.
34.
35. Произведение растворимости
4636.
37.
следовательно38.
39.
40.
41.
42.
43.
44.
Из уравнения для ПР видно, что при увеличении концентрации катионов осадкауменьшается концентрация анионов (и наоборот), поскольку при возрастаний
концентрации ионов Мm+ или An- увеличивается вероятность встречи между
ними.
При этом скорость осаждения увеличивается по сравнению со скоростью реакции
растворения осадка, и поэтому концентрация других разновидностей ионов в
растворе уменьшается.
По значениям ПР можно сравнивать растворимость различных веществ.
Например, из значений ПР для CaF2 (4,0∙10-11) и BaF2 (1,7∙10-6) можно заключить,
что фторид кальция хуже растворим, чем фторид бария.
Численные значения произведения растворимостей приведены в справочниках (cм.
приложение). Пользуясь ими, можно вычислить растворимость
малорастворимого электролита в системе: раствор - осадок.
При этом растворимость (S) малорастворимого соединения - это концентрация
его ионов в растворе над осадком.
45.
ПРИМЕР Произведения растворимости AgCl и Ag2CО3 равны соответственно1,6∙10-10 и 6,2∙10-12 при 250С. Какая соль более растворима?
Решение: Определим молярные концентрации ионов в насыщенных водных
растворах. AgCl = Ag++ClЕсли с1 моль AgCl перешло в раствор, то [Ag+] = [С1-] = с1.
и ПР(АgС1) = [Ag+] [С1-] =c12 Следовательно:
Для второй соли: Ag2CО3= 2Ag++ CO32Если растворилось с2 моль Ag2CО3, то:
[Ag+]=2с2; [СO32-]=с2; ПР (Ag2CО3) = [Ag+]2∙[СО32-] = (2c2)2∙c2 = 4c23;
и
При сравнении С1 и С2 видно, что растворимость карбоната серебра в 10 раз выше
растворимости хлорида серебра, хотя ПРAgCl>ПРAg2C03 и, казалось бы,
растворимость АgС1 должна быть выше.
Расчет показывает, что качественное сравнение растворимостей по величине ПР
возможно лишь для веществ, образующих в растворах одинаковое суммарное число
ионов.
Например: ПРAgCl=1,6∙10-10; ПРAgI= l,0∙10-16; с(AgCl)>с(AgI); ПРAg2CO3=6,2∙10-12;
ПРAg2CrO4=2,0∙10-12; с(Ag2CO3)>c(Ag2CrO4).
46.
47.
48.
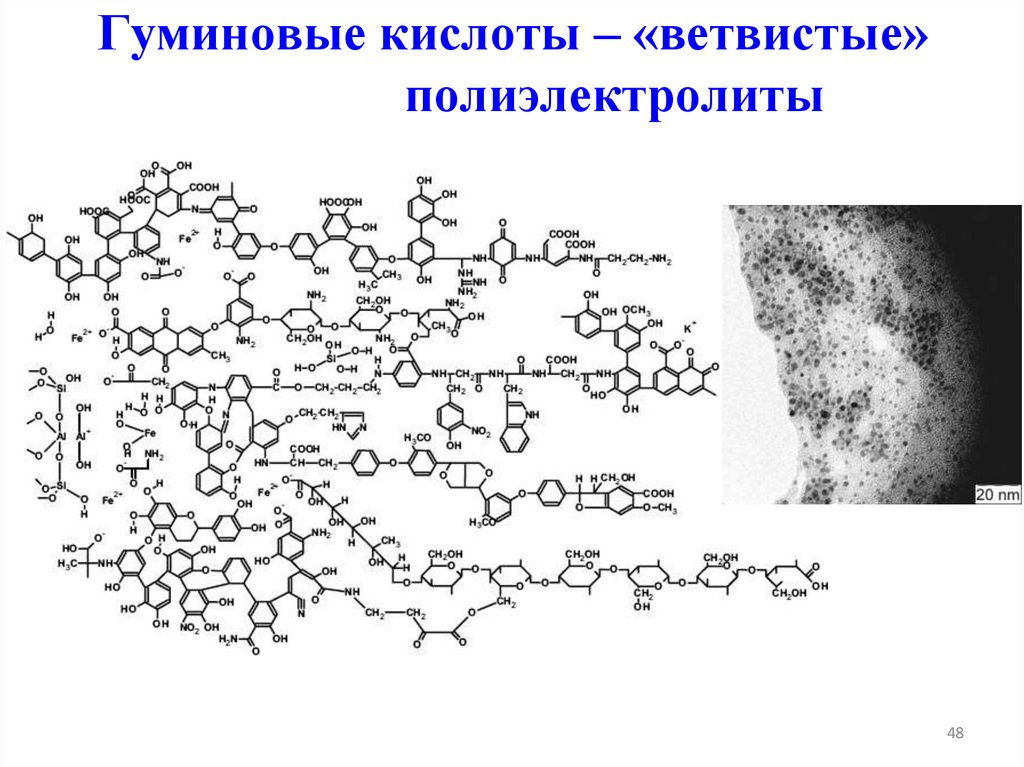
✔• Природные
полиэлектролиты
–
важнейший
класс
электролитов. Если они имеют высокомолекулярную
природу, то вряд ли смогут образовать истинный раствор,
однако будут активно взаимодействивать с окружающими
растворами за счет электростатических сил и координации с
ионами.
• Искусственные полиэлектролиты используются для создания
ион-обменных смол, которые применяются для очистки воды
как недорогая альтернатива дистилляции.
49. Гидроксилапатит
ОрбитРеклама не врёт
47
50. Гуминовые кислоты – «ветвистые» полиэлектролиты
4851.
52. Основное
• Раствор – гомогенная фаза переменного состава,формирующаяся при растворении вещества в растворителе,
при этом растворяемое вещество и растворитель могут быть
одной из возможных комбинаций жидких, газообразных или
твердофазных веществ.
• Растворы – одно из ключевых понятий химии, биологии,
технологии, поскольку, как правило, их использование
позволяет существенно ускорить протекание химических (и
биологических) процессов.
• Модели описания растворов многообразны, но отличаются
для сильных и слабых электролитов. Алхимический принцип
«подобное растворяется в подобном» имеет вполне реальные
физико – химические предпосылки.
• Свойства
растворов
определяются
концентрацией
растворенного вещества, а также химической природой
компонентов.
53.
54.
55. Степень диссоциации (число
распавшихся по отношению к общемуколичеству молекул) зависит от природы растворенного вещества,
природы растворителя (полярности, диэлектрической проницаемости),
концентрации раствора, температуры, наличия одноименного иона...
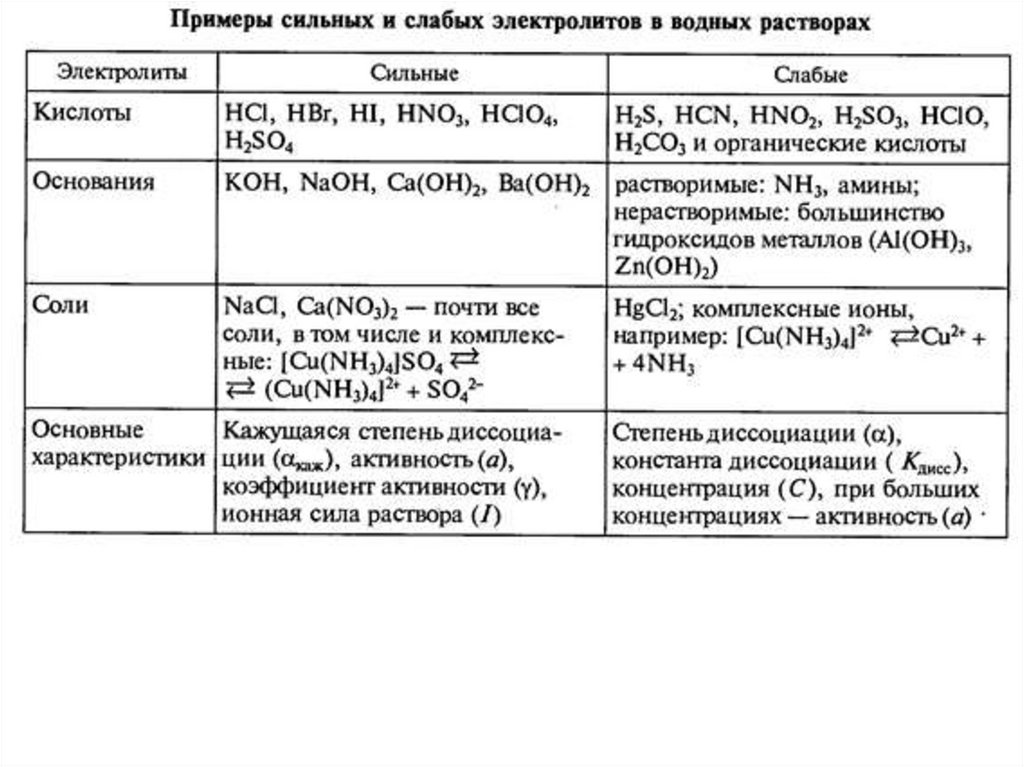
Слабые электролиты при ~0.1 М имеют степень диссоциации <0.3%
Сильные электролиты
(почти) полностью диссоциируют на ионы,
для них степень диссоциации
>0.3
(не
рассматривают константу
диссоциации,
но вводят кажущуюся степень диссоциации).
42



















































 Химия
Химия








