Похожие презентации:
Ароматические углеводороды. Арены. 10 класс
1. Ароматические углеводороды
Арены10 класс
2. Какие углеводороды называются ароматическими?
Ароматическиеуглеводороды (арены) –
это углеводороды с
общей формулой
СnH2n-6 , где n 6 в
молекулах которых
имеется хотя бы одно
бензольное кольцо.
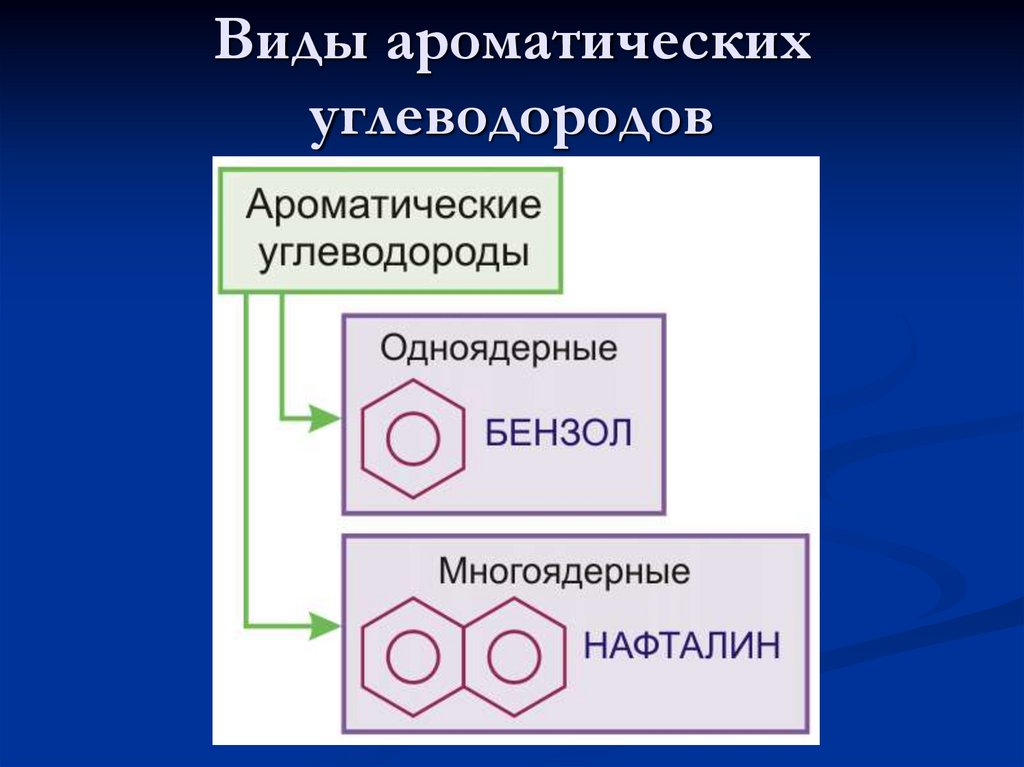
3. Виды ароматических углеводородов
4. Майкл Фарадей (1791–1867)
Английский физик и химик,член Лондонского королевского
общества. Один из основателей
количественной электрохимии.
В 1823 г. впервые получил жидкие хлор, сероводород, оксид
углерода(IV), аммиак, оксид
азота(IV). В 1825 г. открыл бензол, изучил его физические и
некоторые химические свойства. Положил начало исследованиям каучука. В 1833–1836 гг.
установил количественные
законы электролиза.
5. Фридрих Август Кекуле 1829 - 1896
Немецкий химик-органик.Предложил структурную
формулу молекулы бензола.
С целью проверки гипотезы о
равноценности всех шести
атомов водорода в молекуле
бензола получил его галоген-,
нитро-, амино-, и карбоксипроизводные. Открыл
перегруппировку диазоамино- в
азоаминобензол, синтезировал
трифенилметан и антрахинон.
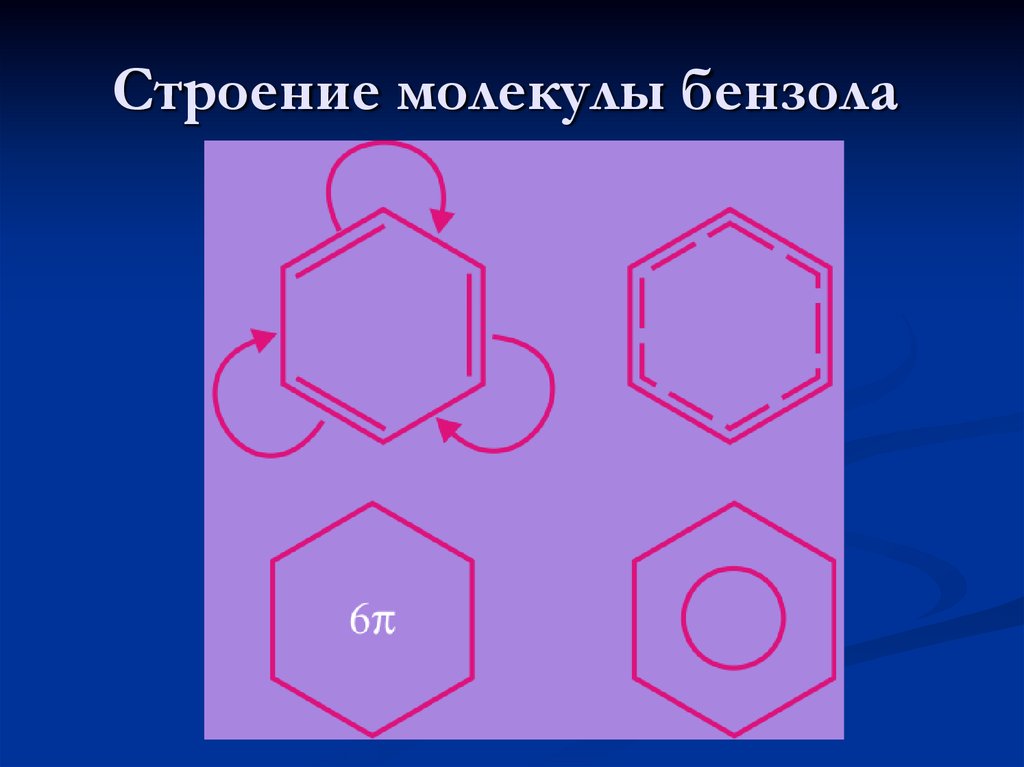
6. Строение молекулы бензола
7. Модель молекулы бензола
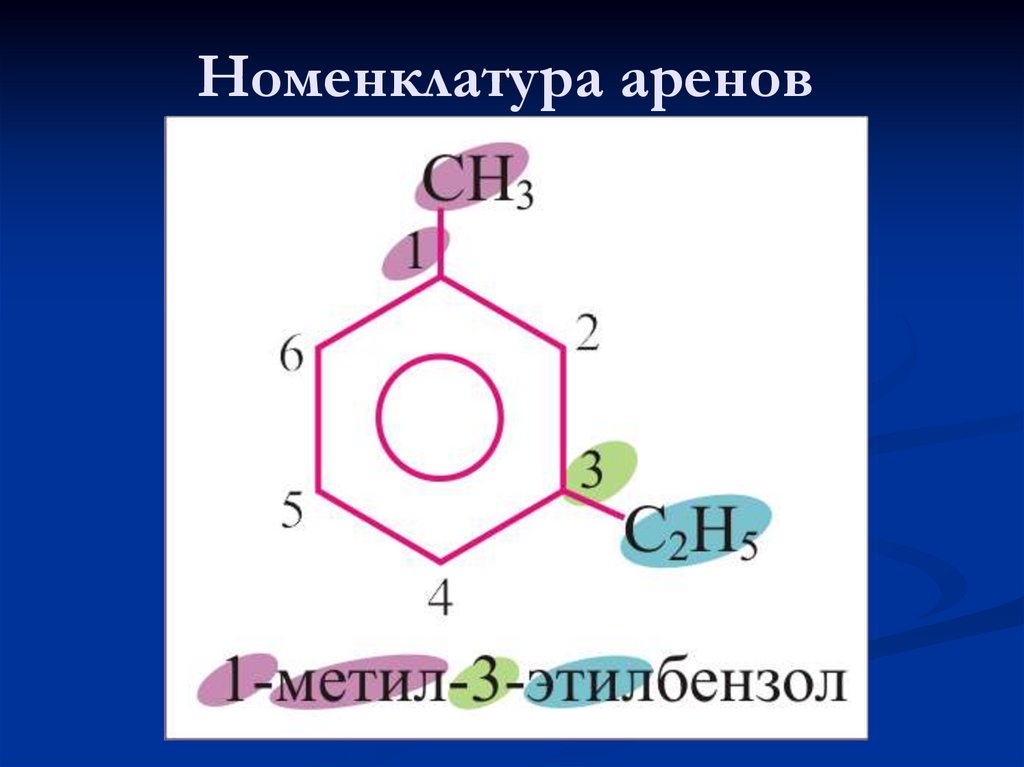
8. Номенклатура аренов
9. Гомологи бензола
10.
11.
Способы полученияаренов
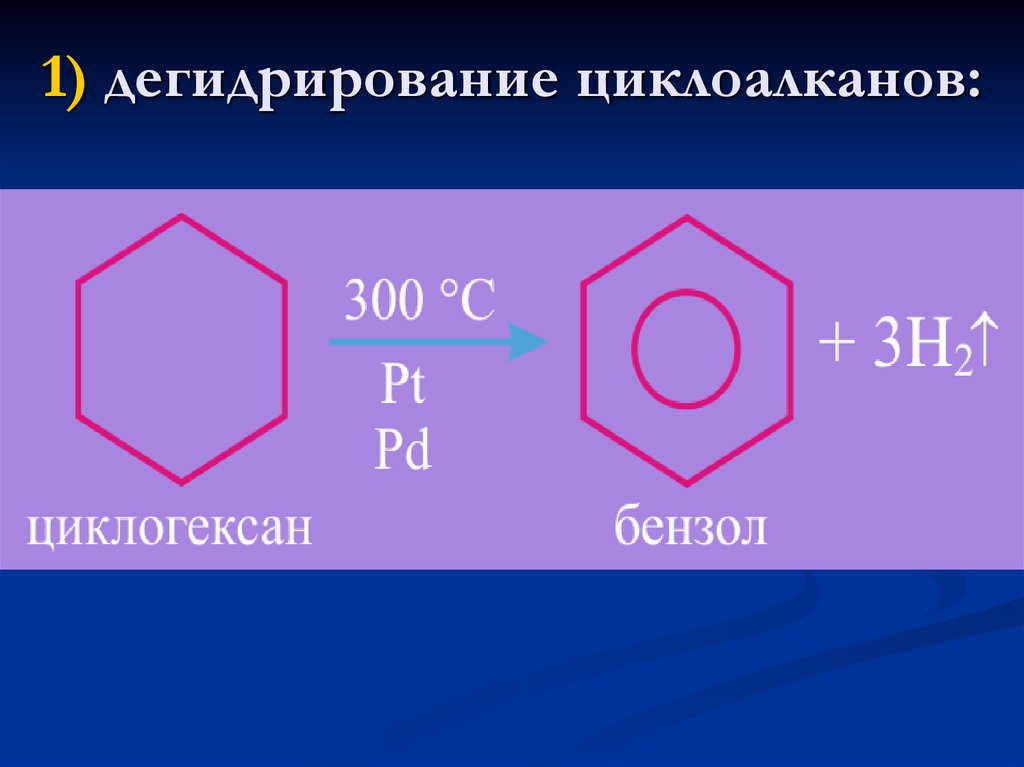
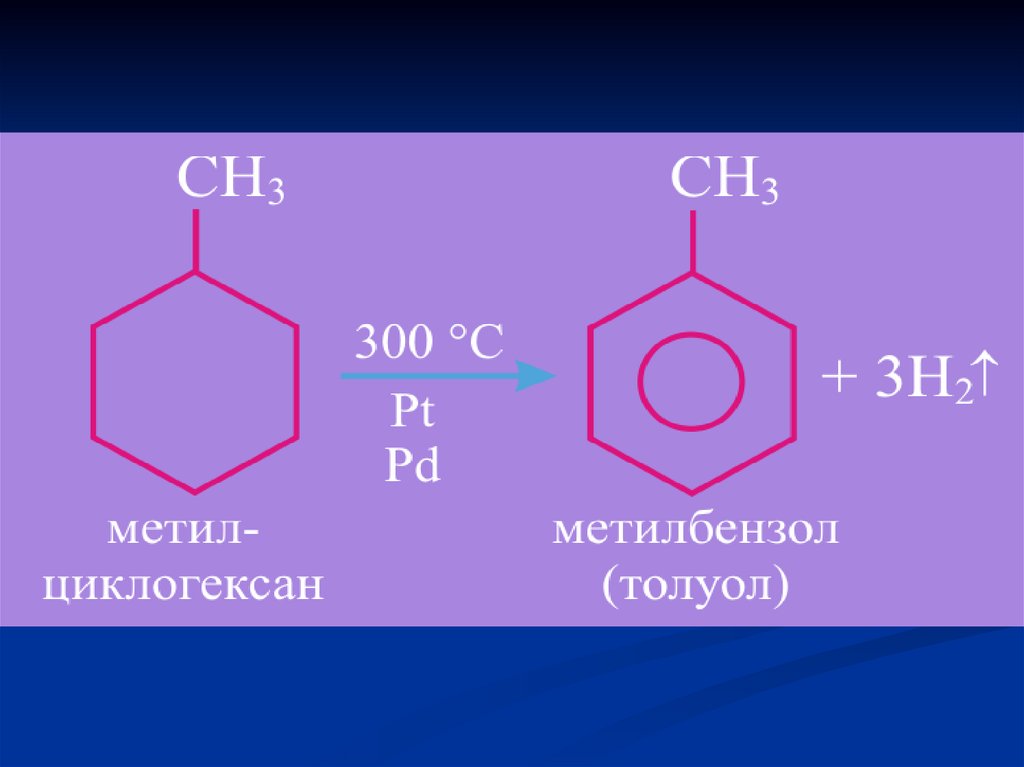
12. 1) дегидрирование циклоалканов:
13.
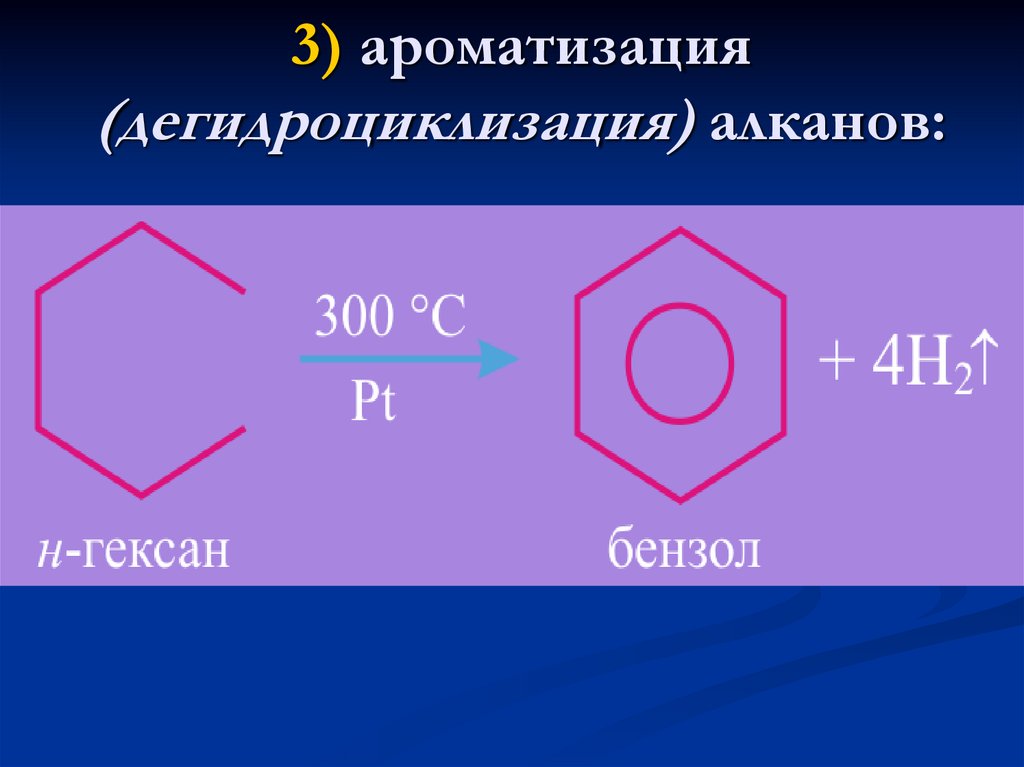
14. 3) ароматизация (дегидроциклизация) алканов:
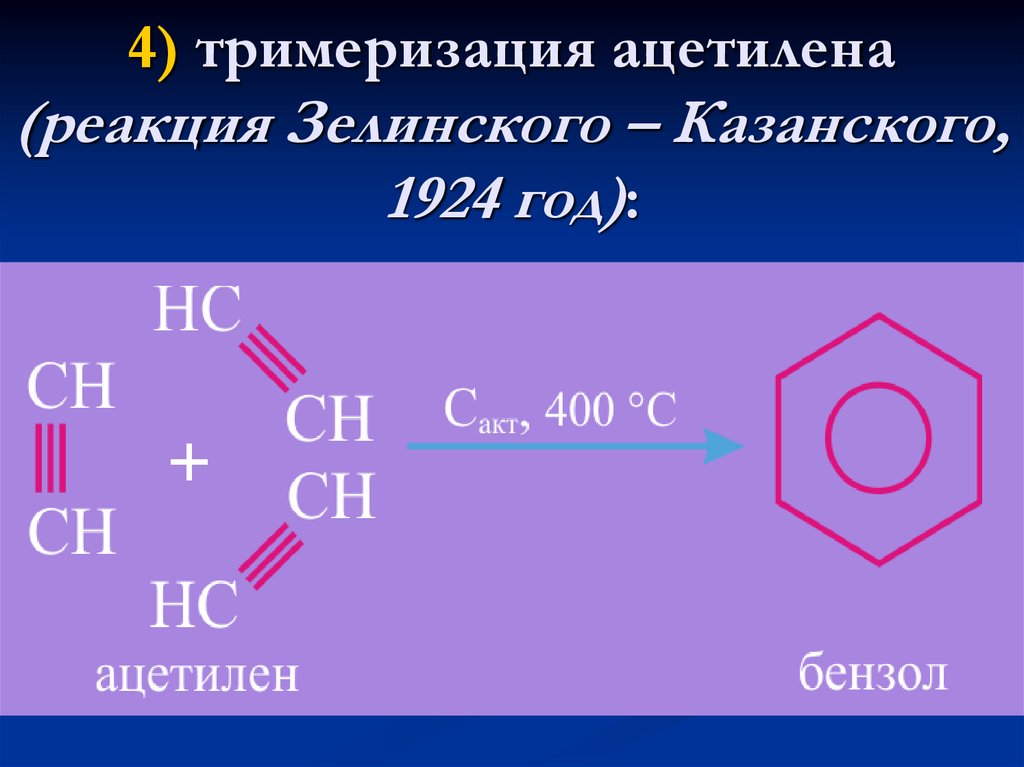
15. 4) тримеризация ацетилена (реакция Зелинского – Казанского, 1924 год):
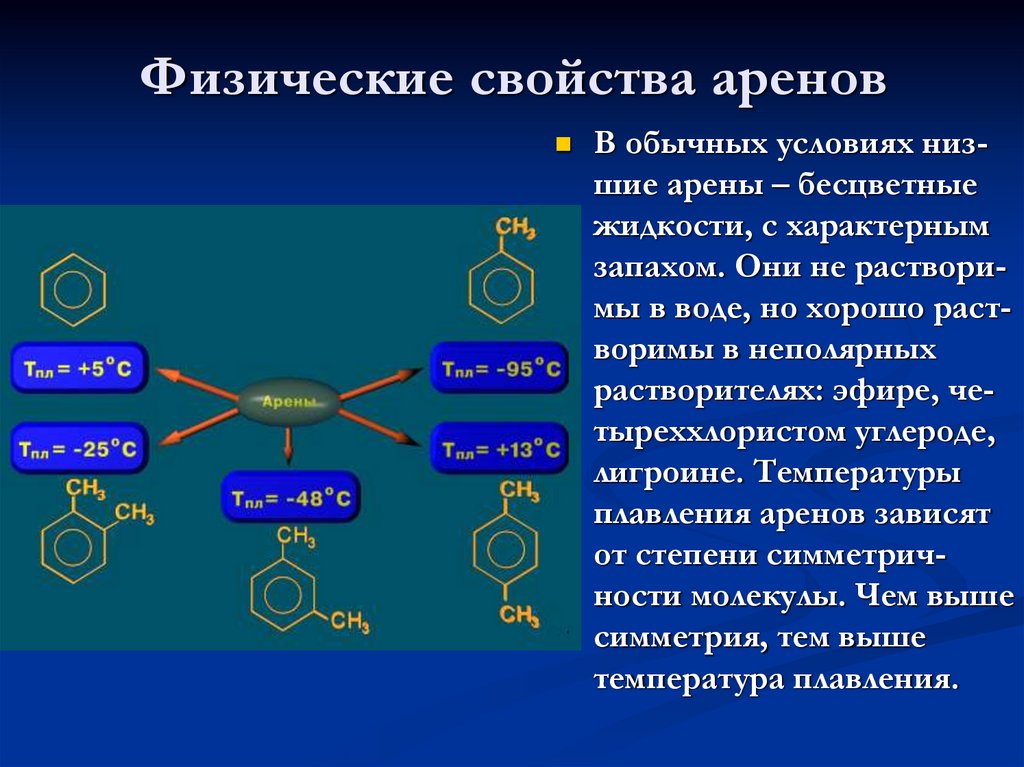
+16. Физические свойства аренов
В обычных условиях низшие арены – бесцветныежидкости, с характерным
запахом. Они не растворимы в воде, но хорошо растворимы в неполярных
растворителях: эфире, четыреххлористом углероде,
лигроине. Температуры
плавления аренов зависят
от степени симметричности молекулы. Чем выше
симметрия, тем выше
температура плавления.
17. Химические свойства аренов
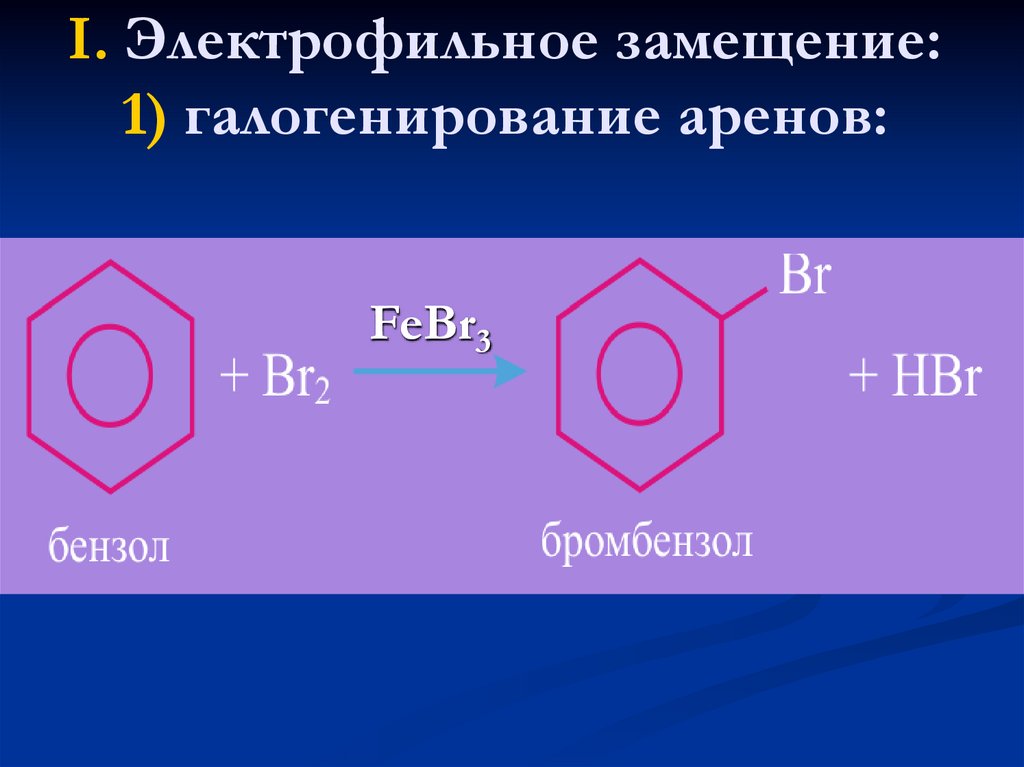
18. I. Электрофильное замещение: 1) галогенирование аренов:
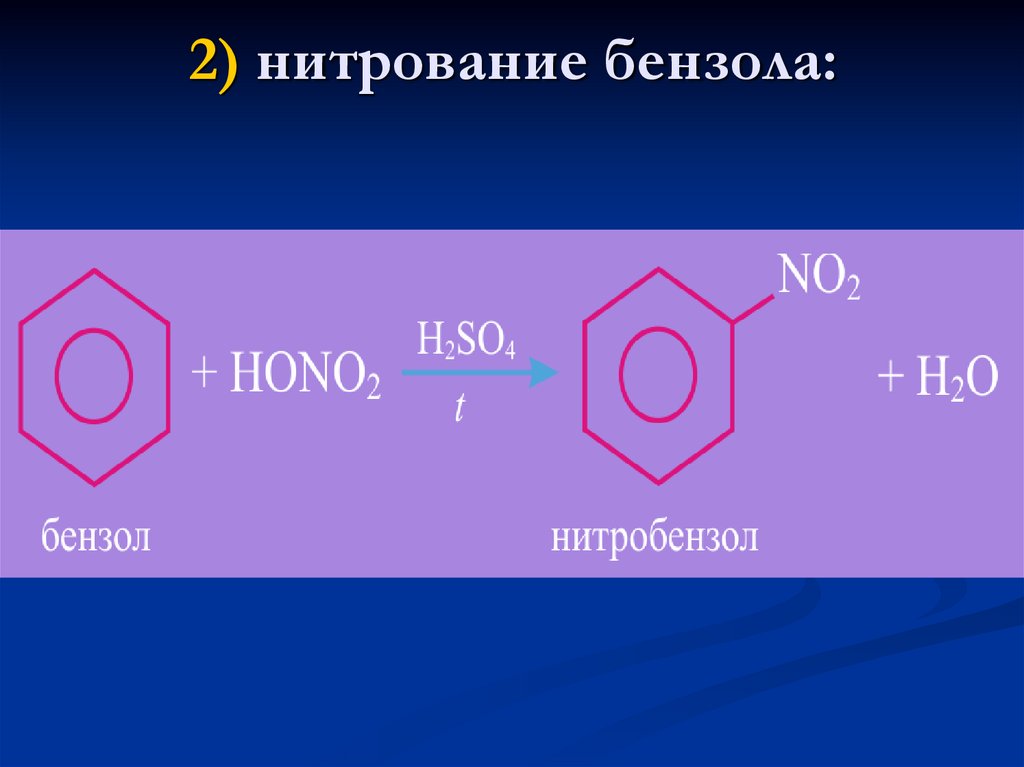
FeBr319. 2) нитрование бензола:
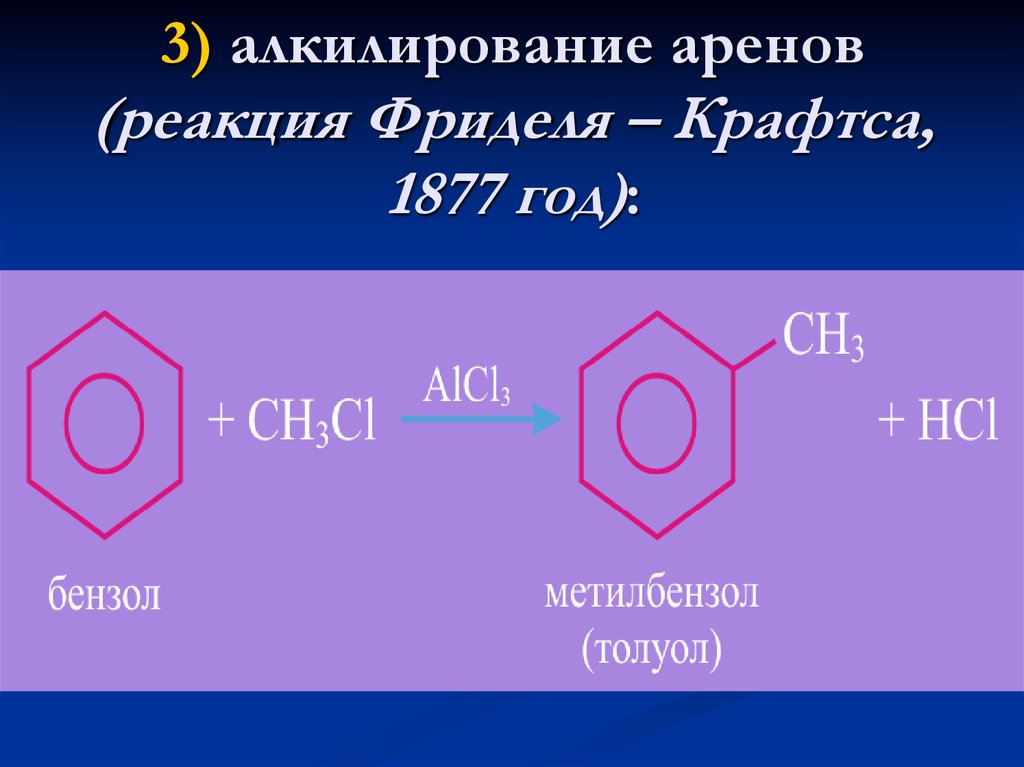
20. 3) алкилирование аренов (реакция Фриделя – Крафтса, 1877 год):
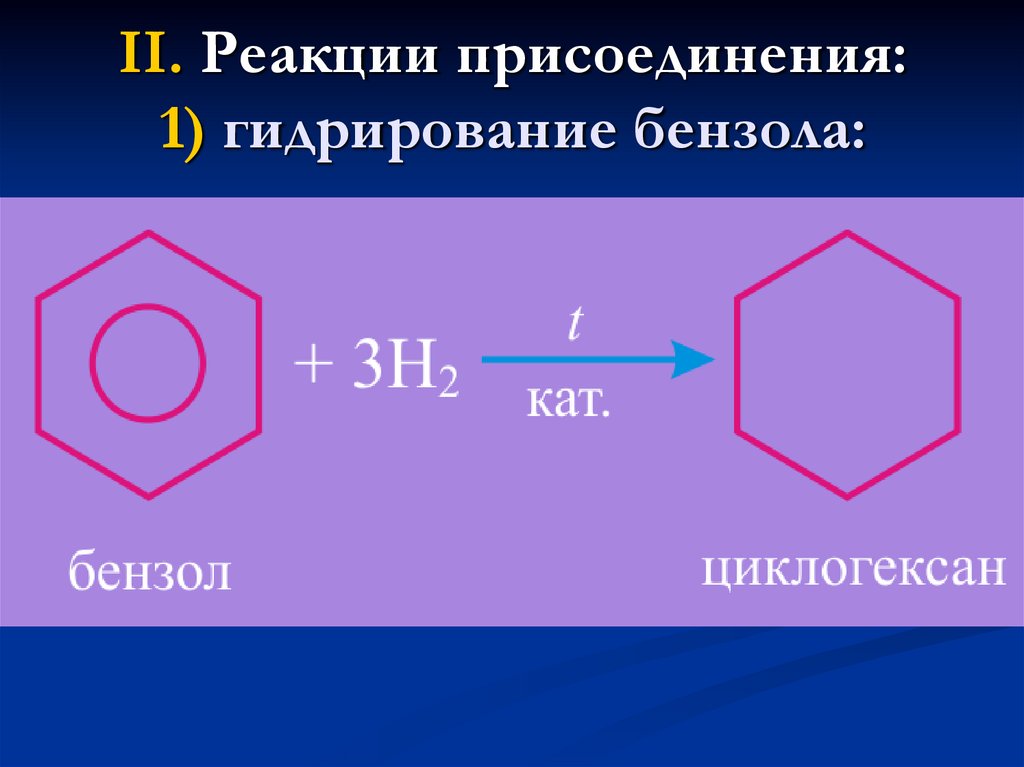
21. II. Реакции присоединения: 1) гидрирование бензола:
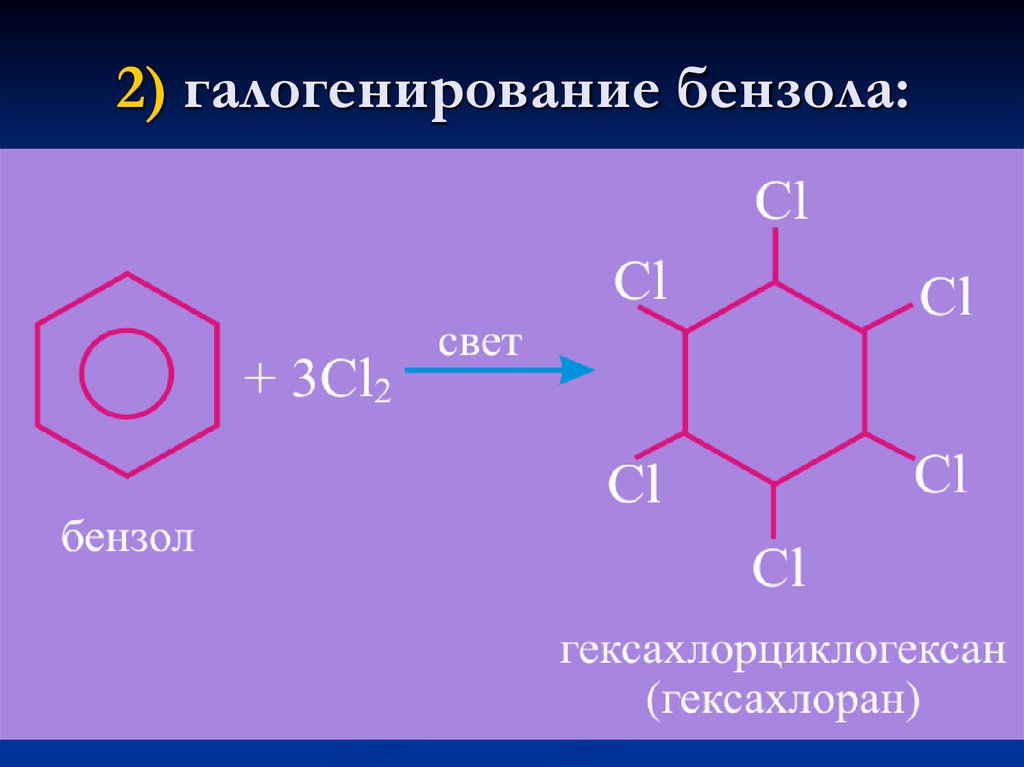
22. 2) галогенирование бензола:
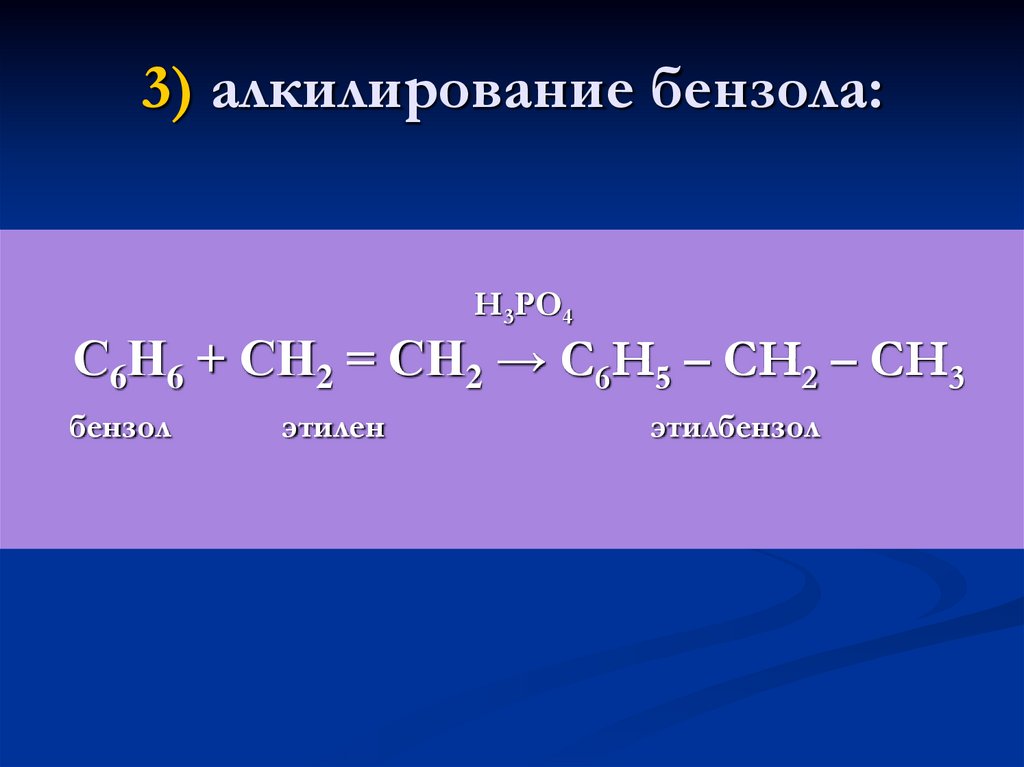
23. 3) алкилирование бензола:
Н3РО4С6Н6 + СН2 = СН2 → С6Н5 – СН2 – СН3
бензол
этилен
этилбензол
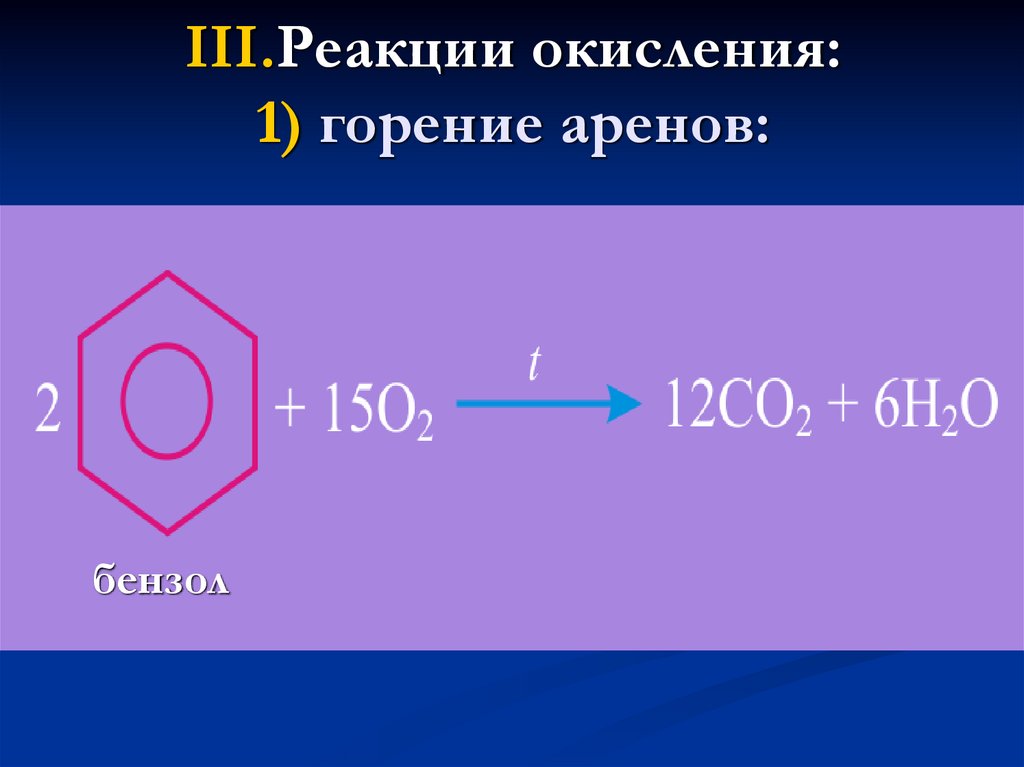
24. III.Реакции окисления: 1) горение аренов:
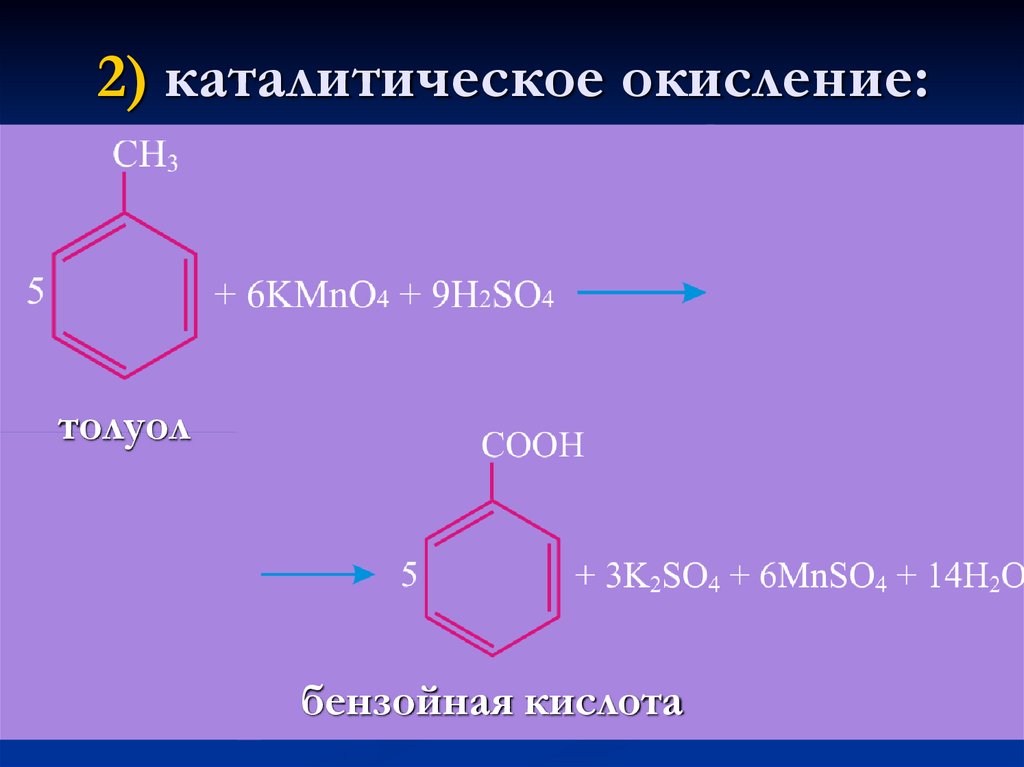
бензол25. 2) каталитическое окисление:
толуолбензойная кислота









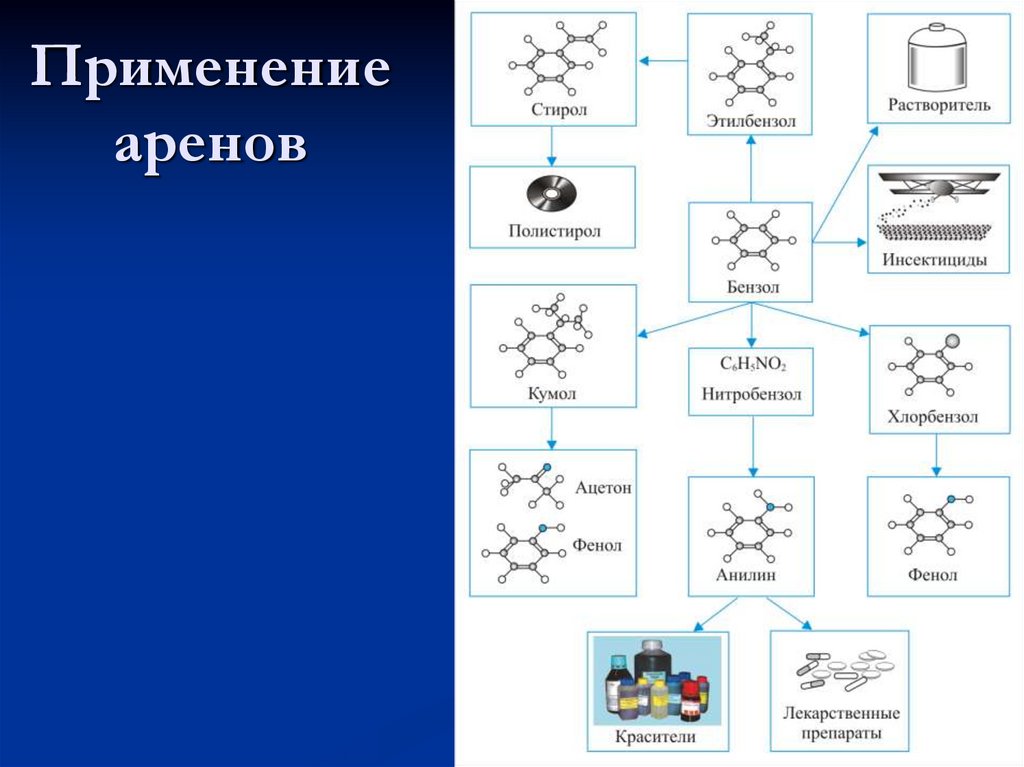
 Химия
Химия








