Похожие презентации:
Ароматические углеводороды (арены)
1.
Тема лекции №3:«Ароматические углеводороды (арены)»
2.
План1. Определение и внешние признаки класса. Классификация,
номенклатура и изомерия.
2. Способы получения.
3. Физические свойства.
4. Химические свойства.
5. Применение.
3.
1. Ароматические углеводороды (арены) –это циклические углеводороды, содержащие в
составе молекулы бензольный цикл.
Общая формула: СnН2n-6
4.
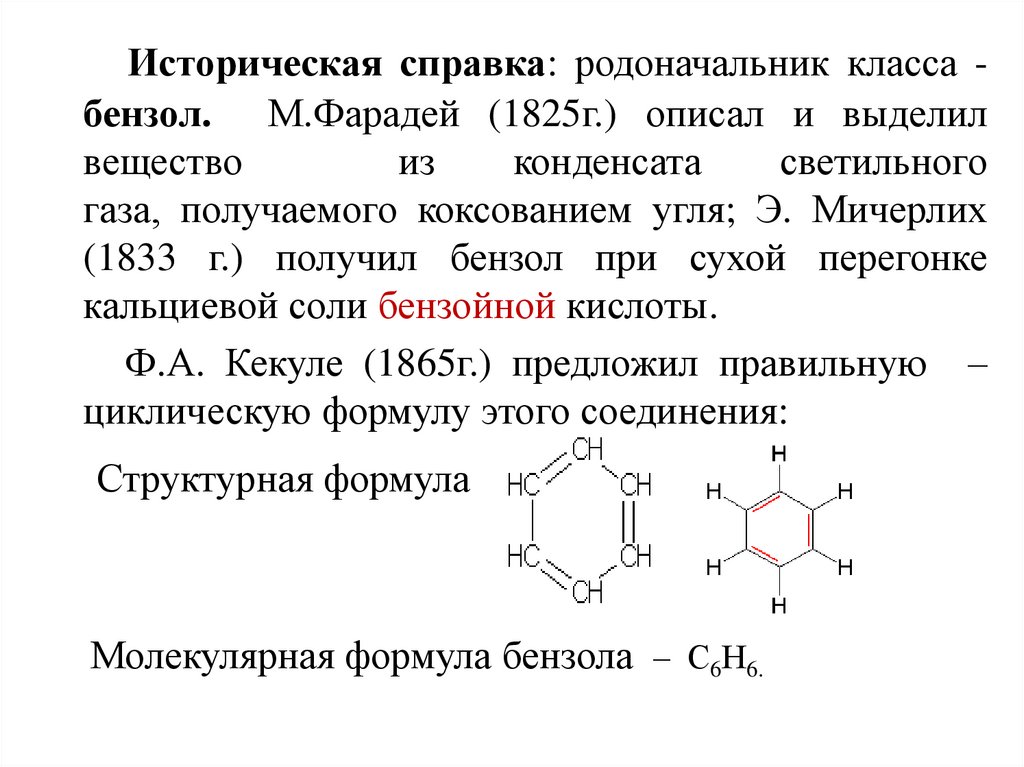
Историческая справка: родоначальник класса бензол. М.Фарадей (1825г.) описал и выделилвещество
из
конденсата
светильного
газа, получаемого коксованием угля; Э. Мичерлих
(1833 г.) получил бензол при сухой перегонке
кальциевой соли бензойной кислоты.
Ф.А. Кекуле (1865г.) предложил правильную –
циклическую формулу этого соединения:
Структурная формула
Молекулярная формула бензола – С6Н6.
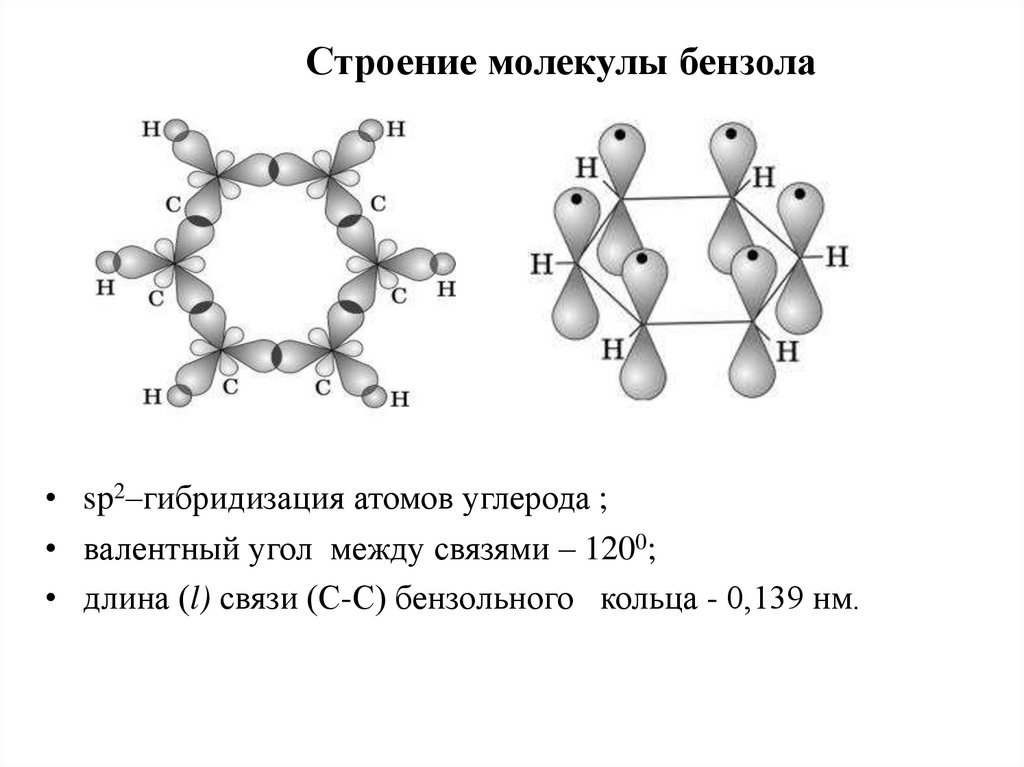
5.
Строение молекулы бензола• sp2–гибридизация атомов углерода ;
• валентный угол между связями – 1200;
• длина (l) связи (С-С) бензольного кольца - 0,139 нм.
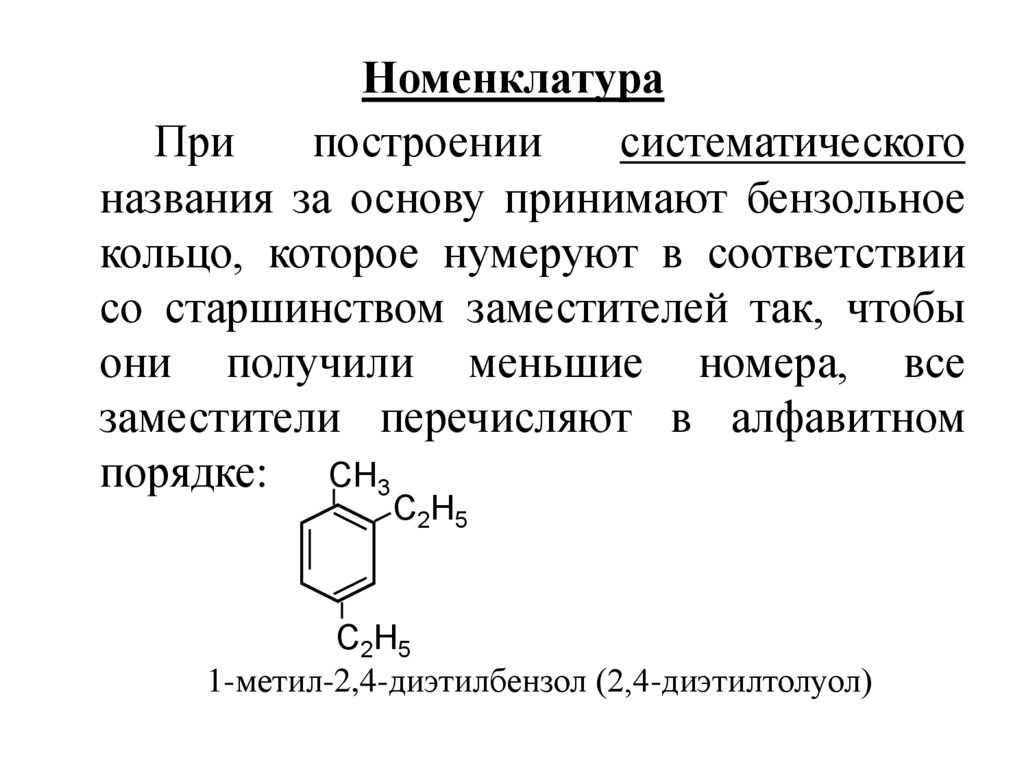
6. Номенклатура
Припостроении
систематического
названия за основу принимают бензольное
кольцо, которое нумеруют в соответствии
со старшинством заместителей так, чтобы
они получили меньшие номера, все
заместители перечисляют в алфавитном
порядке: СН3
С2Н5
С2Н5
1-метил-2,4-диэтилбензол (2,4-диэтилтолуол)
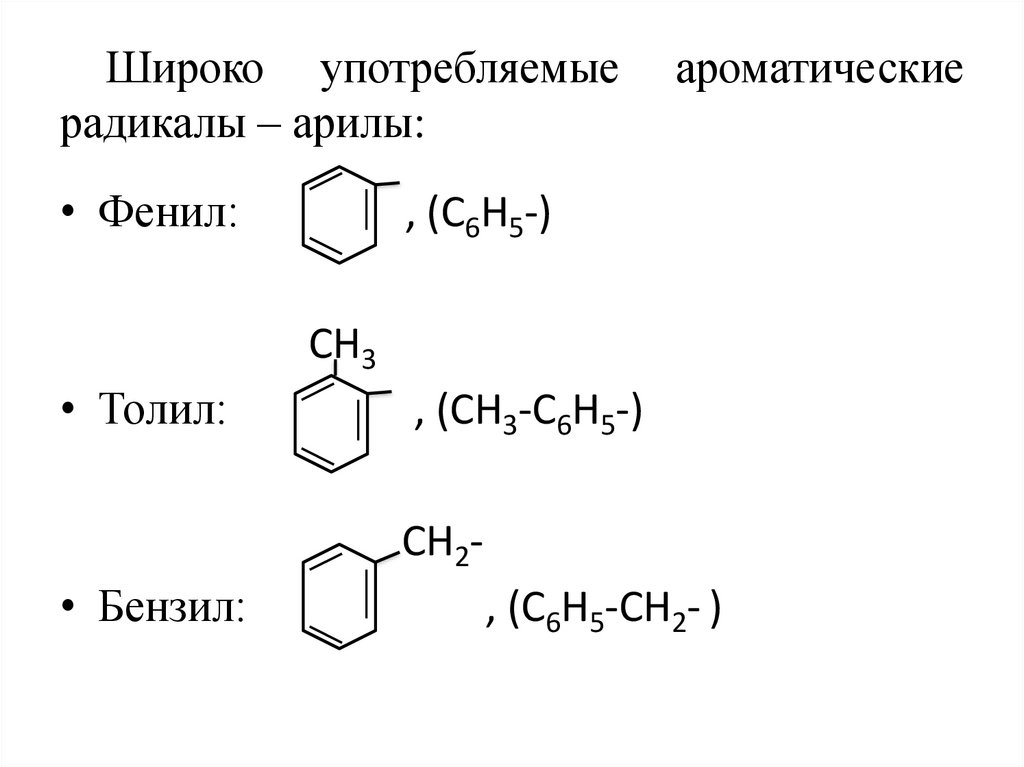
7. Широко употребляемые ароматические радикалы – арилы:
Широко употребляемыерадикалы – арилы:
• Фенил:
ароматические
, (С6Н5-)
СН3
• Толил:
, (СН3-С6Н5-)
СН2-
• Бензил:
, (С6Н5-СН2- )
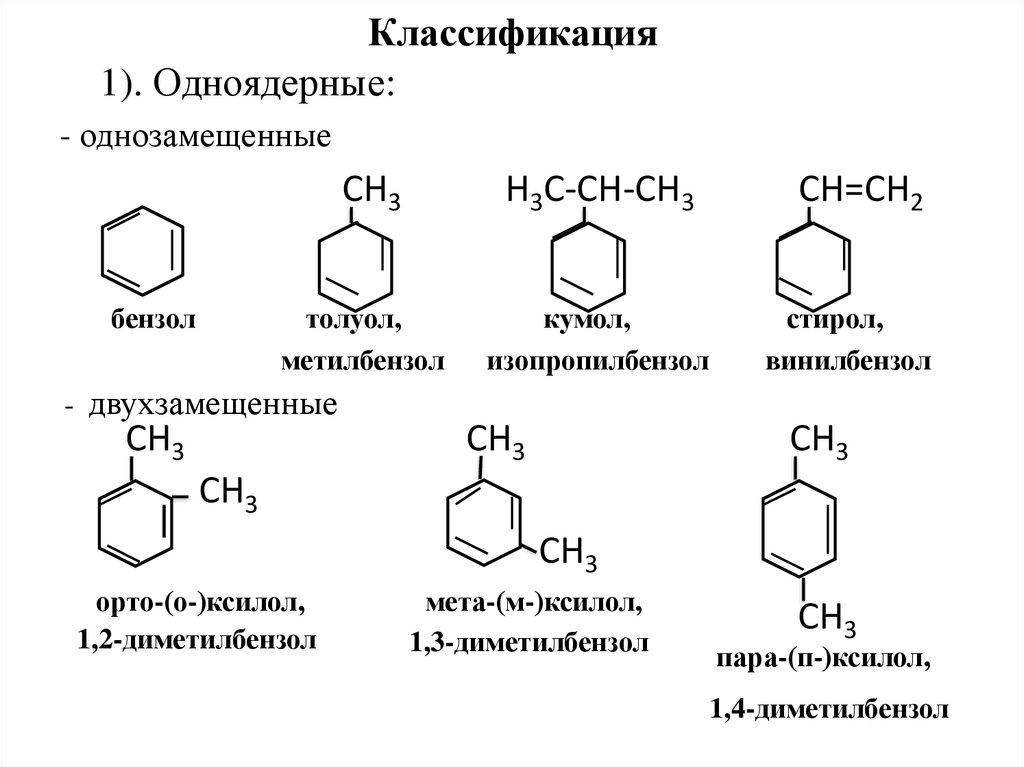
8. Классификация
1). Одноядерные:- однозамещенные
бензол
СН3
H3C-CH-CH3
CH=CH2
толуол,
метилбензол
кумол,
изопропилбензол
стирол,
винилбензол
- двухзамещенные
СН3
СН3
СН3
СН3
СН3
орто-(о-)ксилол,
1,2-диметилбензол
мета-(м-)ксилол,
1,3-диметилбензол
СН3
пара-(п-)ксилол,
1,4-диметилбензол
9.
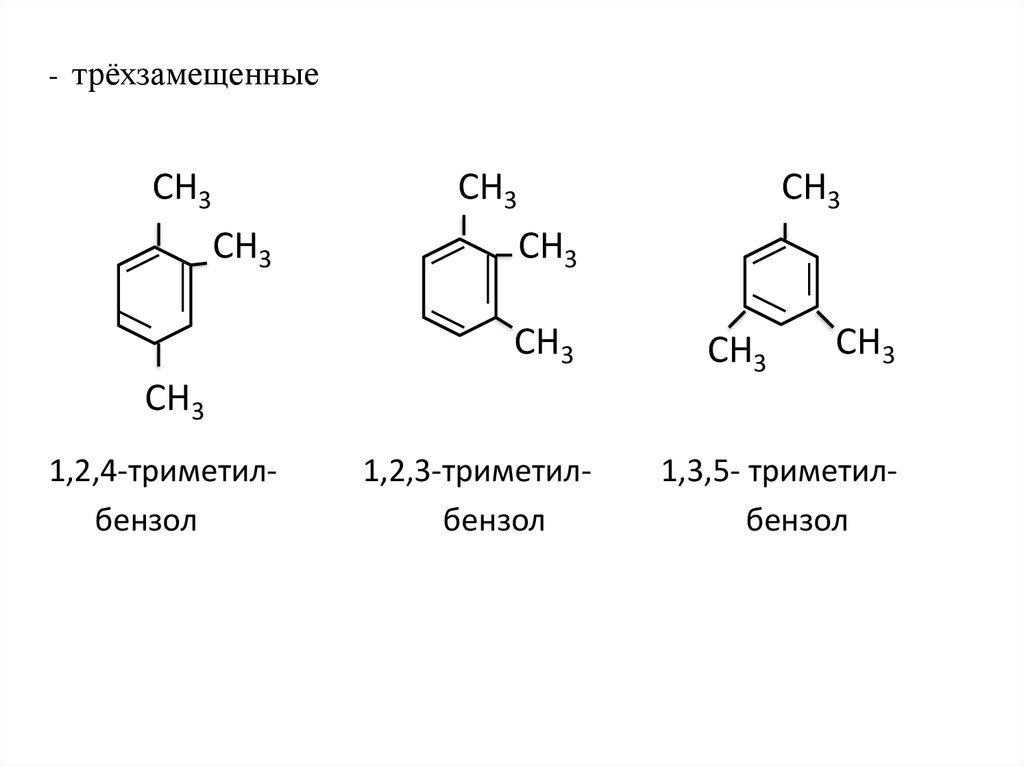
- трёхзамещенныеСН3
СН3
СН3
СН3
СН3
СН3
СН3
СН3
СН3
1,2,4-триметилбензол
1,2,3-триметилбензол
1,3,5- триметилбензол
10.
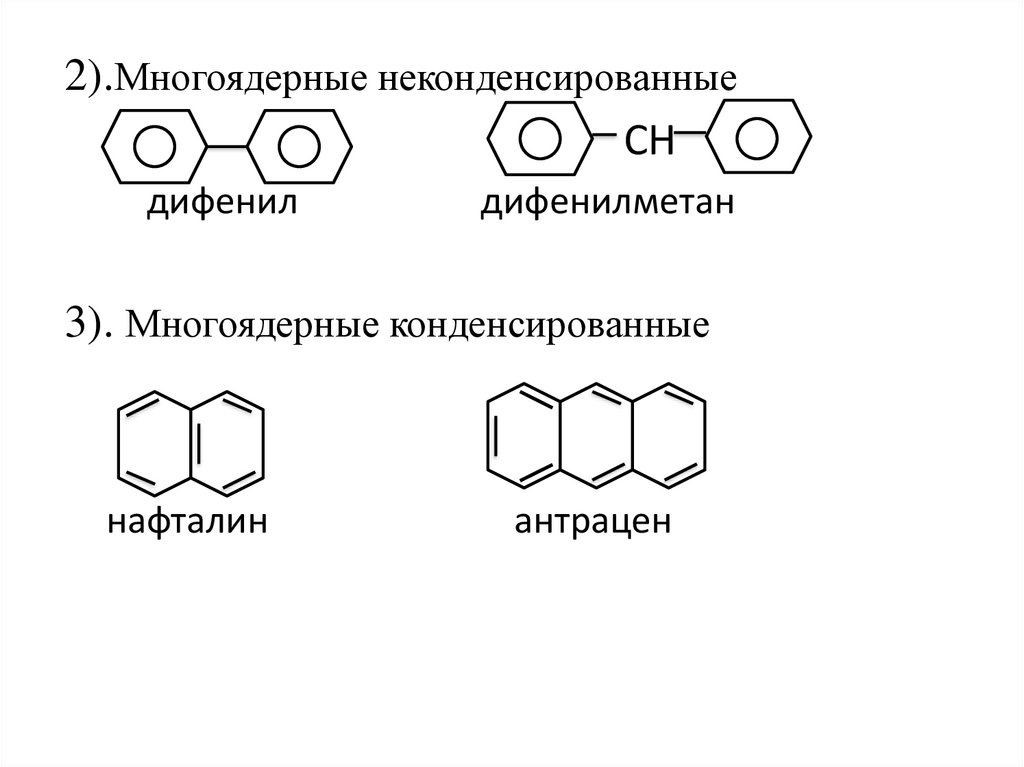
2).Многоядерные неконденсированныеСН
дифенил
дифенилметан
3). Многоядерные конденсированные
нафталин
антрацен
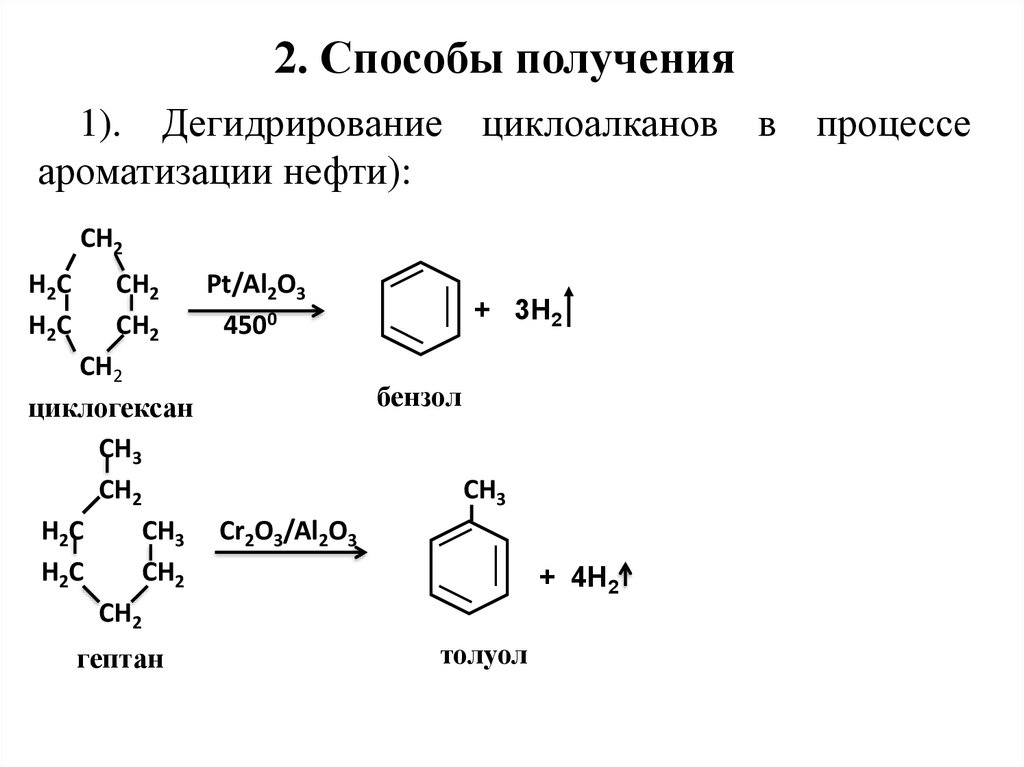
11. 2. Способы получения
1). Дегидрирование циклоалканов в процессеароматизации нефти):
СН2
Н2С
Н2С
СН2
СН2
Pt/Al2O3
4500
+ 3Н2
СН2
бензол
циклогексан
СН3
СН2
CH3
Н2С
СН3 Cr2O3/Al2O3
Н2С
СН2
+ 4Н2
СН2
толуол
гептан
12.
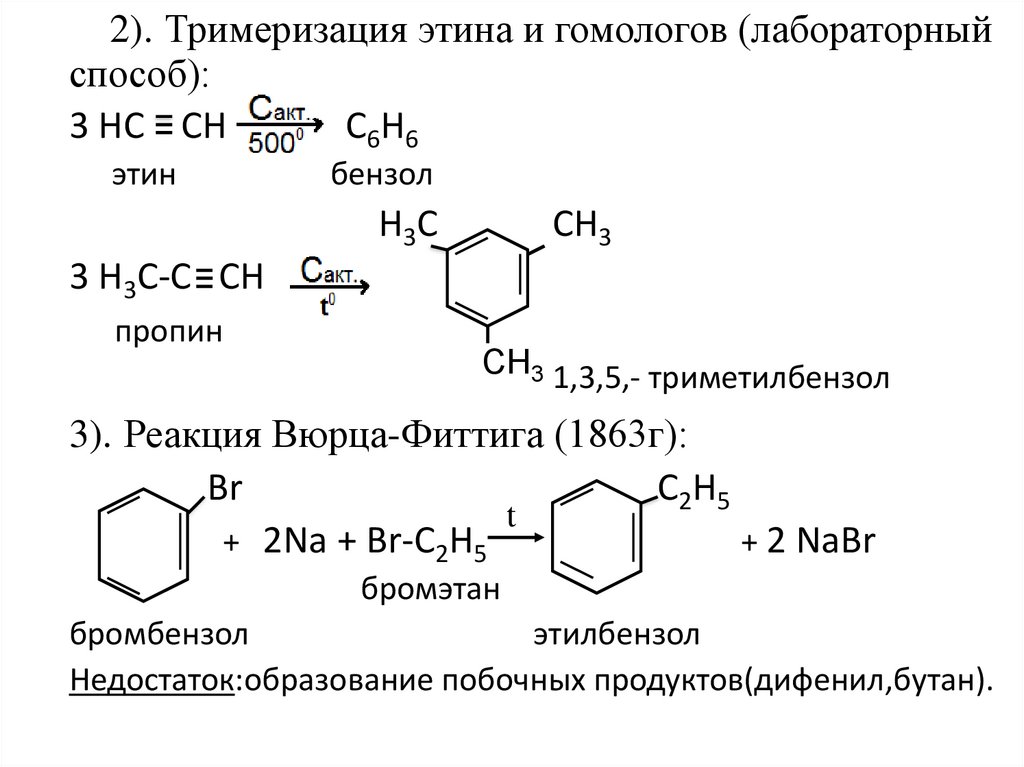
2). Тримеризация этина и гомологов (лабораторныйспособ):
3 НС СН
С6Н6
этин
бензол
Н3С
СН3
3 Н3С-С СН
пропин
СН3 1,3,5,- триметилбензол
3). Реакция Вюрца-Фиттига (1863г):
Br
C2H5
t
+ 2Na + Br-C2H5
+ 2 NaBr
бромэтан
бромбензол
этилбензол
Недостаток:образование побочных продуктов(дифенил,бутан).
13.
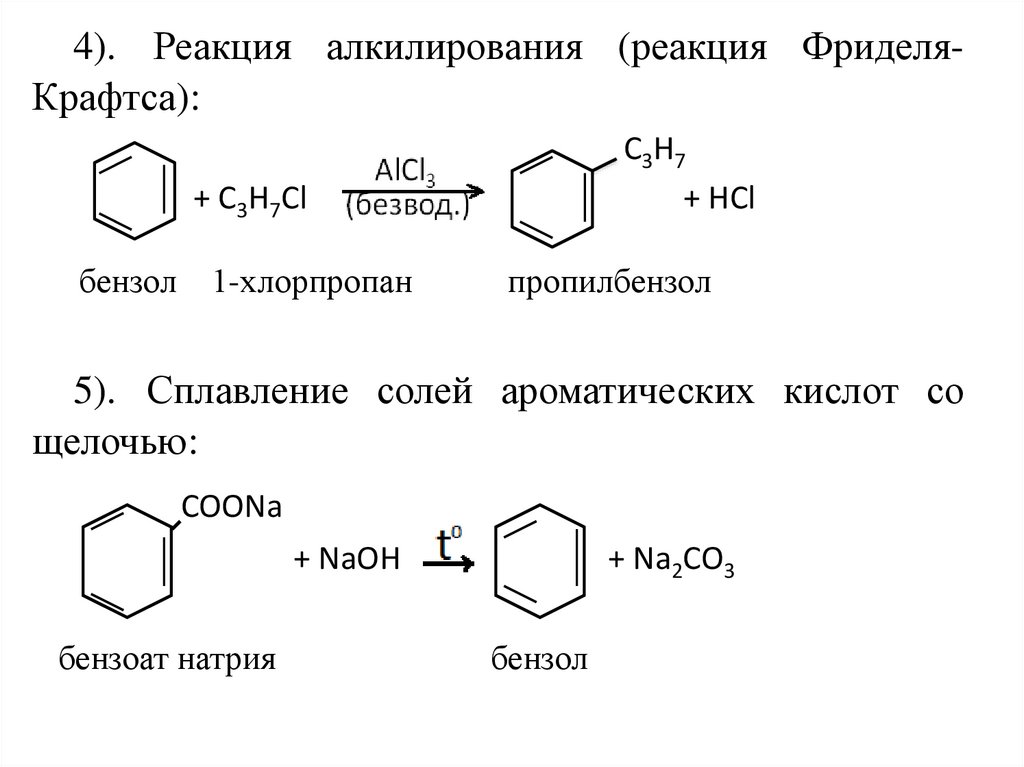
4). Реакция алкилирования (реакция ФриделяКрафтса):С3Н7
+ HCl
+ С3Н7Cl
бензол
1-хлорпропан
пропилбензол
5). Сплавление солей ароматических кислот со
щелочью:
COONa
+ NaOH
бензоат натрия
+ Na2CO3
бензол
14.
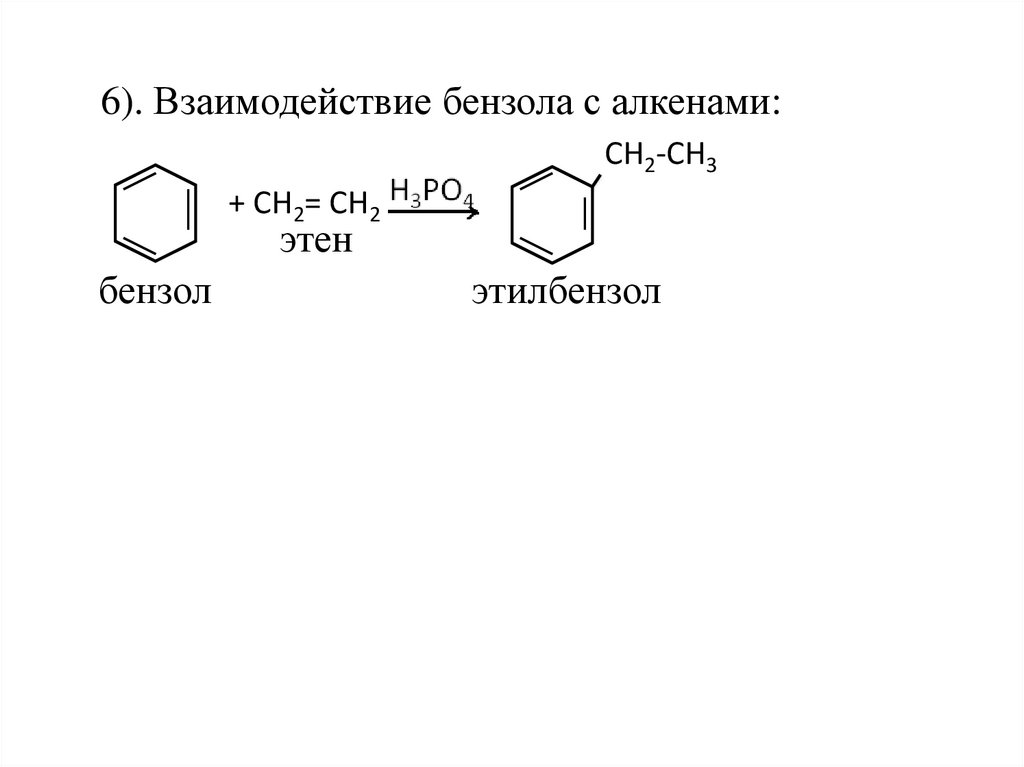
6). Взаимодействие бензола с алкенами:СН2-СН3
+ СН2= СН2
этен
бензол
этилбензол
15. 3. Физические свойства
Большинствоаренов
–
жидкости
с
характерным запахом, не растворимые в воде, но
хорошо
растворяются
в
органических
соединениях.
Плотность бензола 0,879г/мл, tкип=80,10С,
tпл=5,50С
tкип увеличиваются по гомологическому ряду.
Легко воспламеняются и горят ярким, сильно
коптящим пламенем. Пары и жидкости
токсичны!
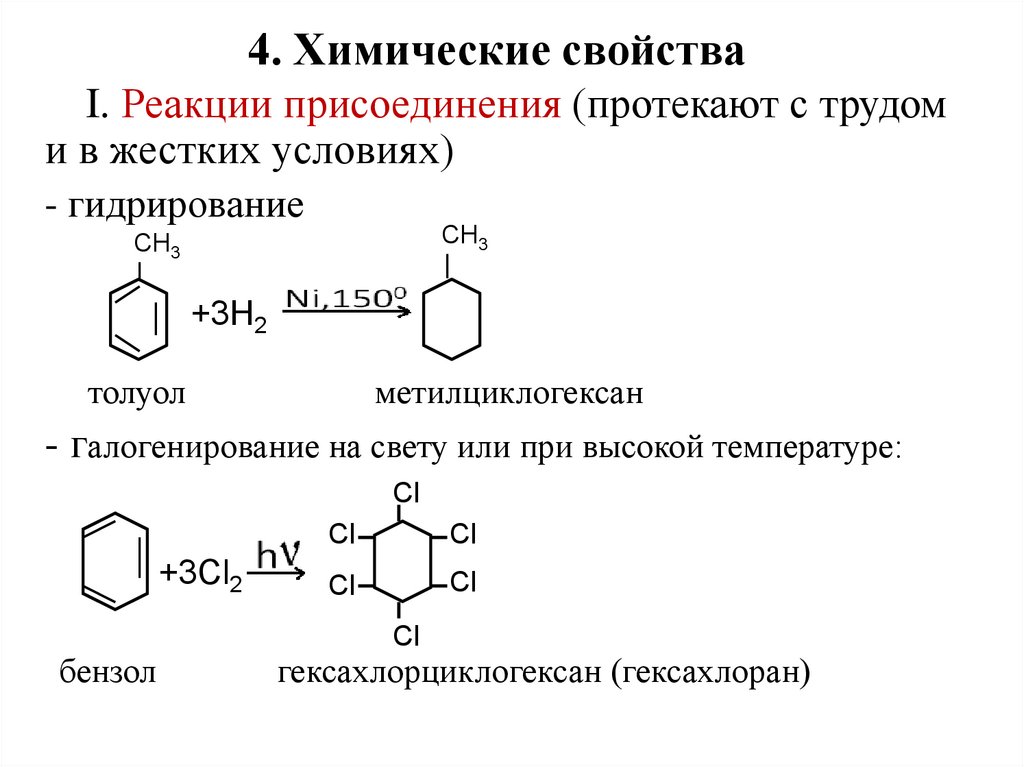
16. 4. Химические свойства
I. Реакции присоединения (протекают с трудоми в жестких условиях)
- гидрирование
СН3
СН3
+3Н2
толуол
метилциклогексан
- галогенирование на свету или при высокой температуре:
Cl
+3Cl2
Cl
Cl
Cl
Cl
Cl
бензол
гексахлорциклогексан (гексахлоран)
17.
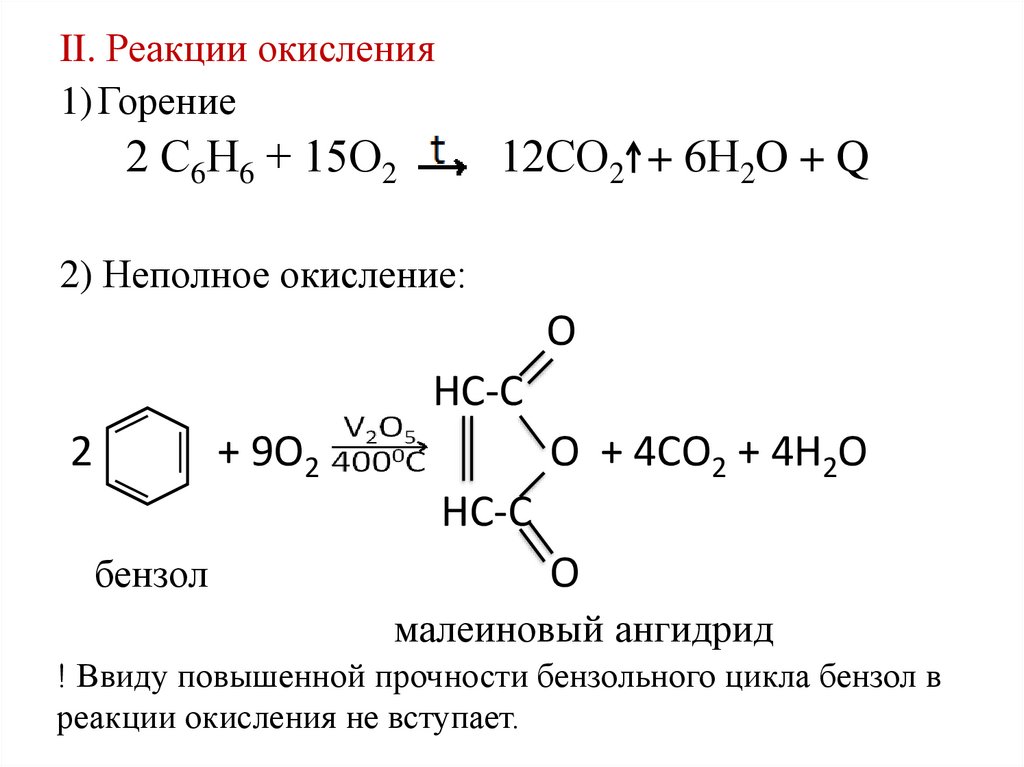
II. Реакции окисления1) Горение
2 С6Н6 + 15О2
12СО2 + 6Н2O + Q
2) Неполное окисление:
О
НС-С
2
+ 9О2
О + 4СО2 + 4Н2О
НС-С
бензол
О
малеиновый ангидрид
! Ввиду повышенной прочности бензольного цикла бензол в
реакции окисления не вступает.
18.
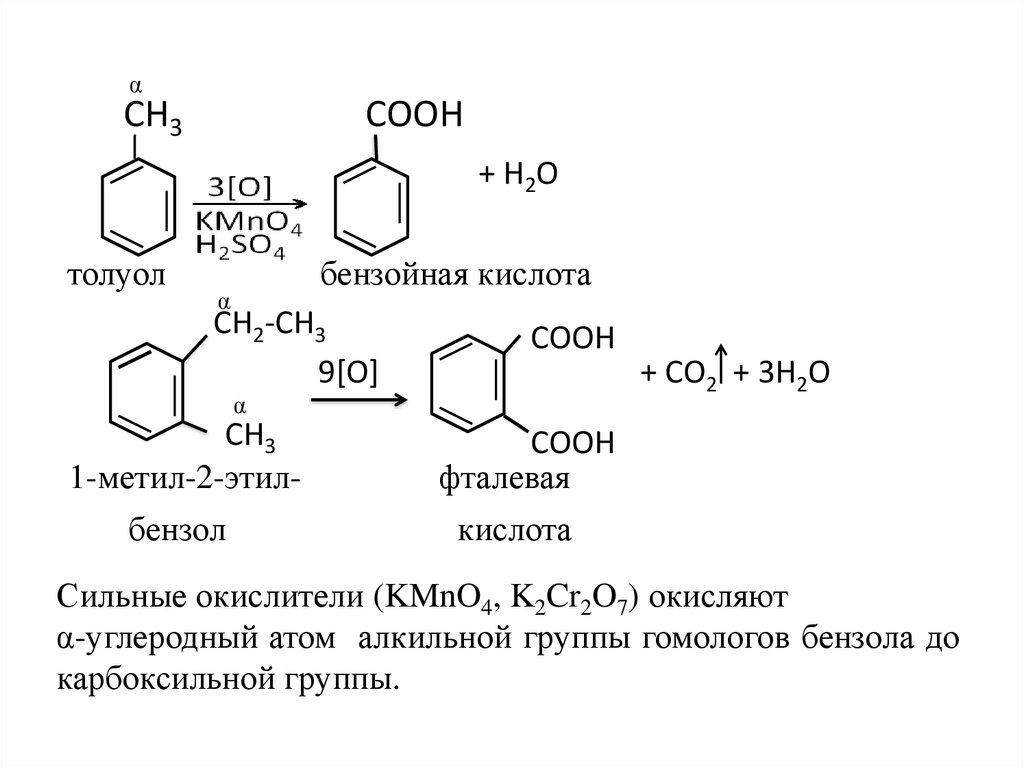
αСН3
СООН
+ Н2О
толуол
бензойная кислота
α
СН2-СН3
9[O]
СООН
α
СН3
1-метил-2-этил-
СООН
фталевая
бензол
кислота
+ СО2 + 3Н2О
Сильные окислители (KMnO4, K2Cr2O7) окисляют
α-углеродный атом алкильной группы гомологов бензола до
карбоксильной группы.
19.
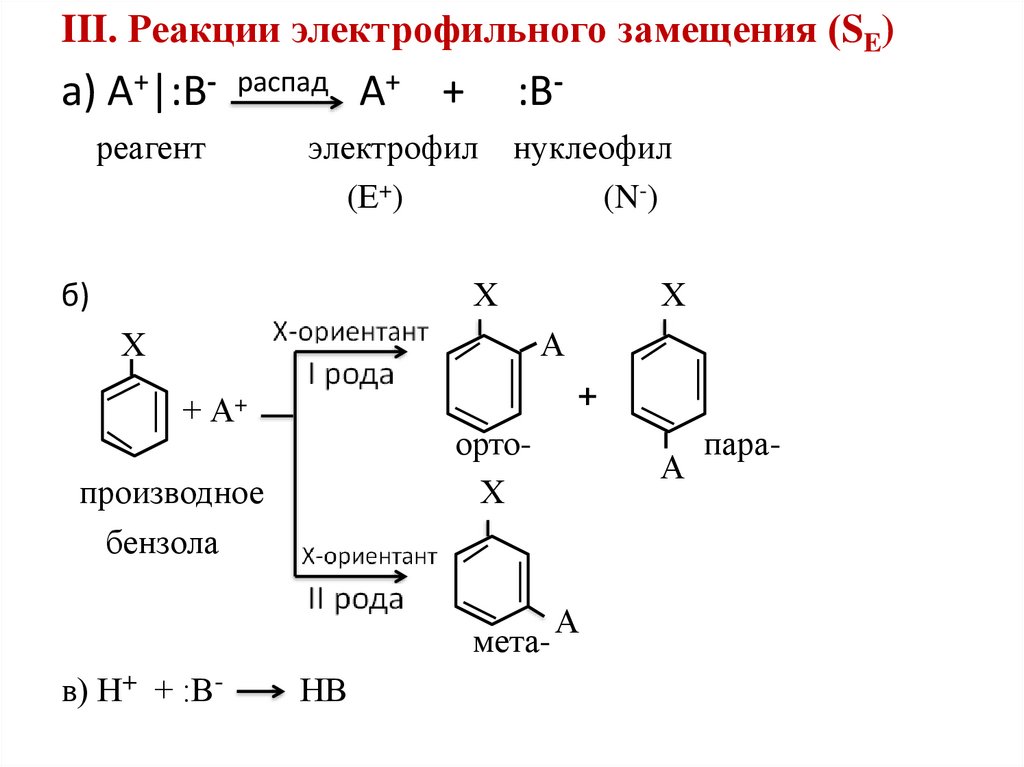
III. Реакции электрофильного замещения (SE)а) А+|:В- распад А+ +
реагент
:В-
электрофил
(Е+)
нуклеофил
(N-)
Х
Х
б)
Х
А
+
+ А+
ортоХ
производное
бензола
метав) Н+ + :В-
НВ
А
А
пара-
20.
Заместители I рода (алкильные группы (R-),OH, -NH2, -NHR, -NR2, галогены) направляют новый
заместитель преимущественно в орто- и параположение.
Заместители II рода ( -SO3H, -NO2, -CHO, -CN,
-COOH, -COOR) ориентируют второй заместитель
преимущественно в мета – положение.
При наличии заместителей и I и II рода
предпочтительным является заместитель I рода.
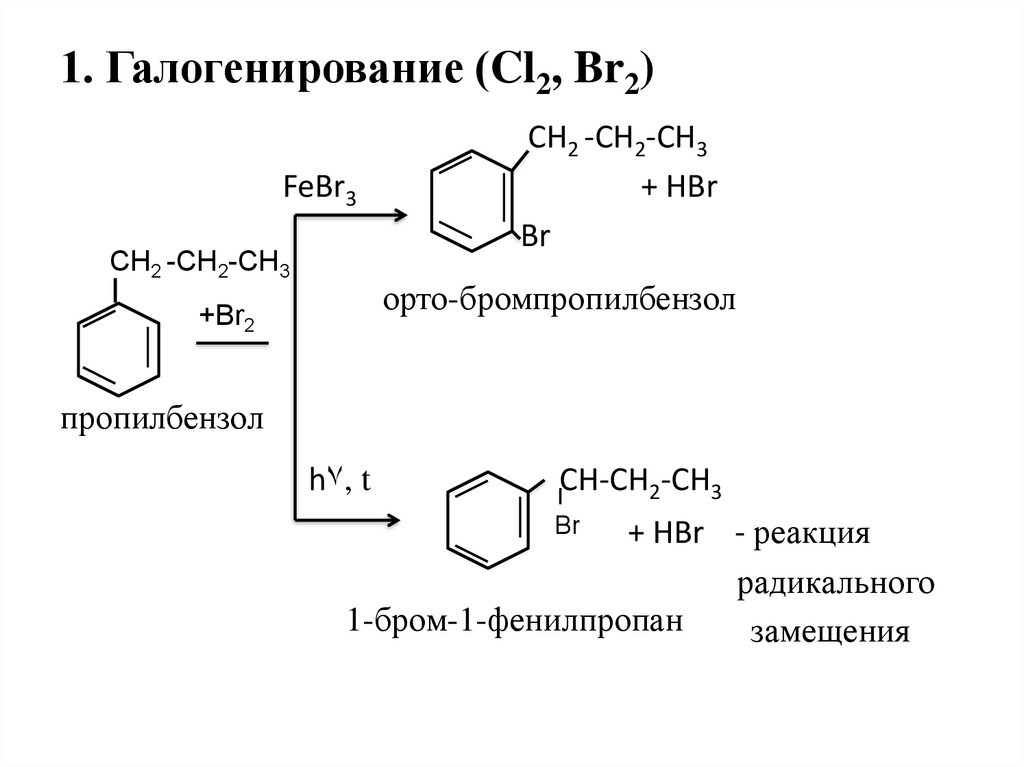
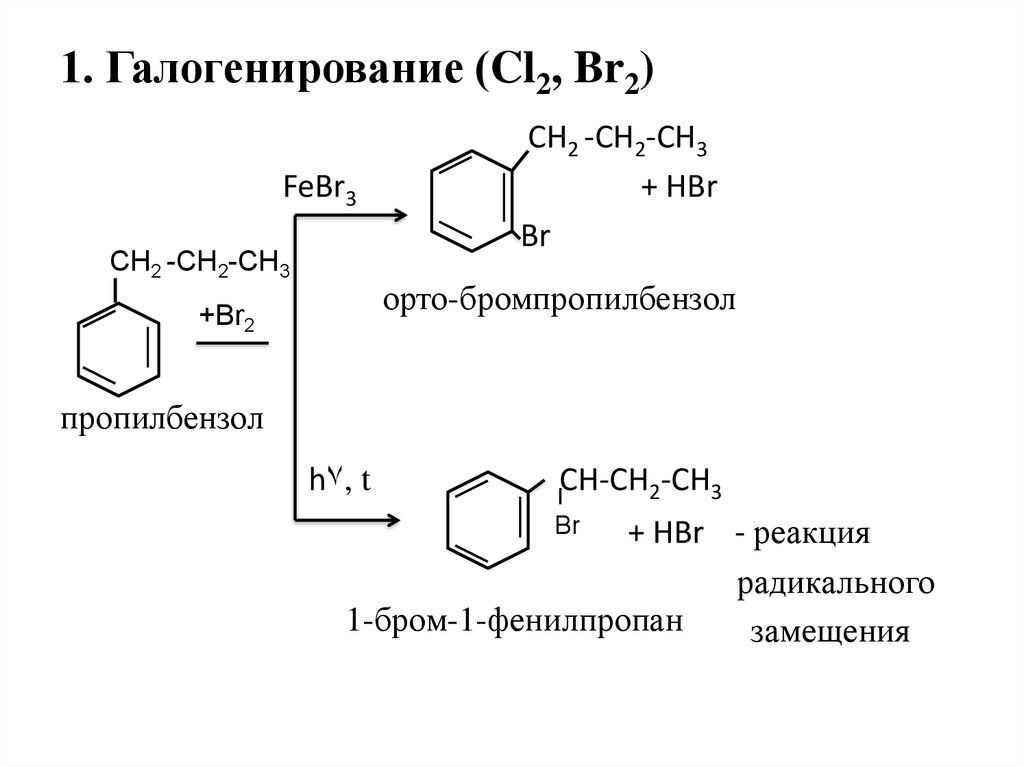
21. 1. Галогенирование (Cl2, Br2)
FeBr3CН2 -СН2-СH3
СН2 -СН2-СН3
+ HBr
Br
орто-бромпропилбензол
+Br2
пропилбензол
h۷, t
CH-СН2-СН3
+ HBr - реакция
радикального
1-бром-1-фенилпропан
замещения
Br
22. 1. Галогенирование (Cl2, Br2)
FeBr3CН2 -СН2-СH3
СН2 -СН2-СН3
+ HBr
Br
орто-бромпропилбензол
+Br2
пропилбензол
h۷, t
CH-СН2-СН3
+ HBr - реакция
радикального
1-бром-1-фенилпропан
замещения
Br
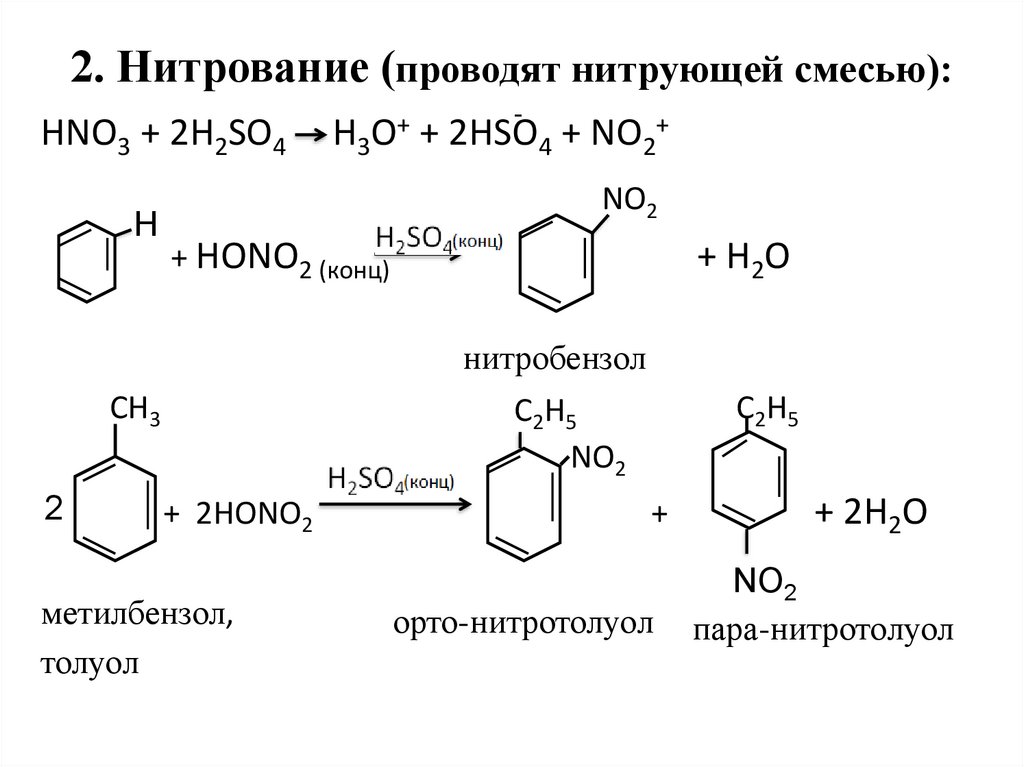
23. 2. Нитрование (проводят нитрующей смесью):
HNO3 + 2H2SO4Н
+
H3O + 2HSO4 + NO2+
NO2
+ HONO2 (конц)
+ H2O
нитробензол
СН3
2
С2Н5
С2Н5
NO2
+ 2HONO2
метилбензол,
толуол
+
орто-нитротолуол
+ 2H2O
NO2
пара-нитротолуол
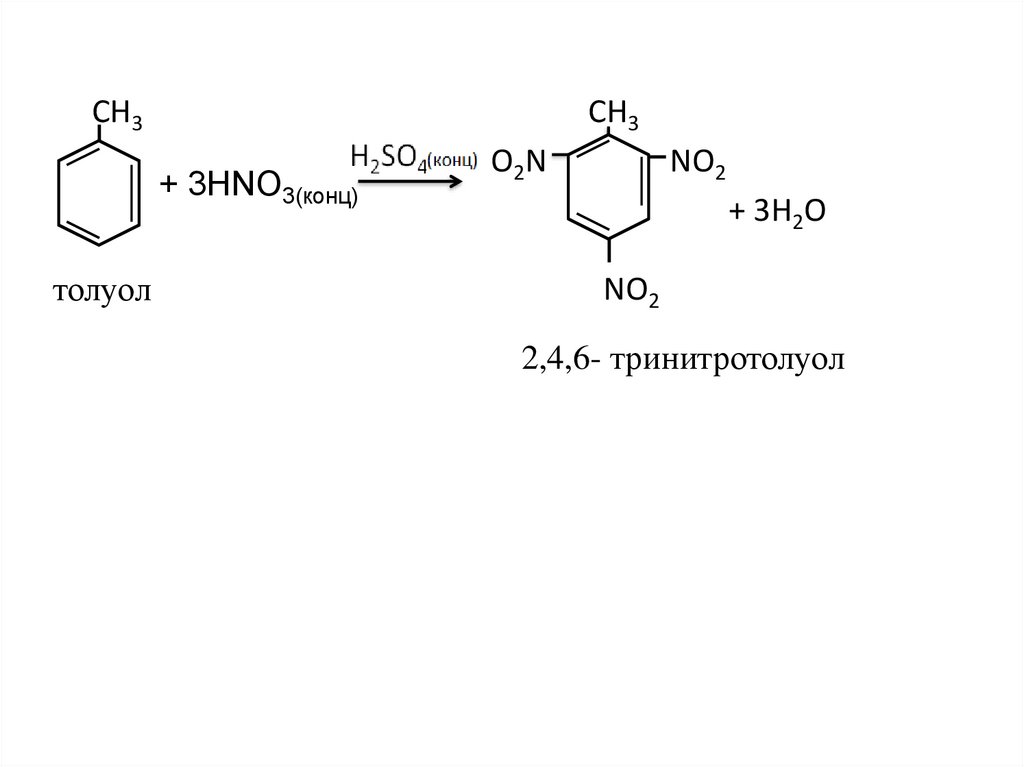
24.
CH3CH3
+ 3HNO3(конц)
толуол
O2N
NO2
+ 3H2O
NO2
2,4,6- тринитротолуол
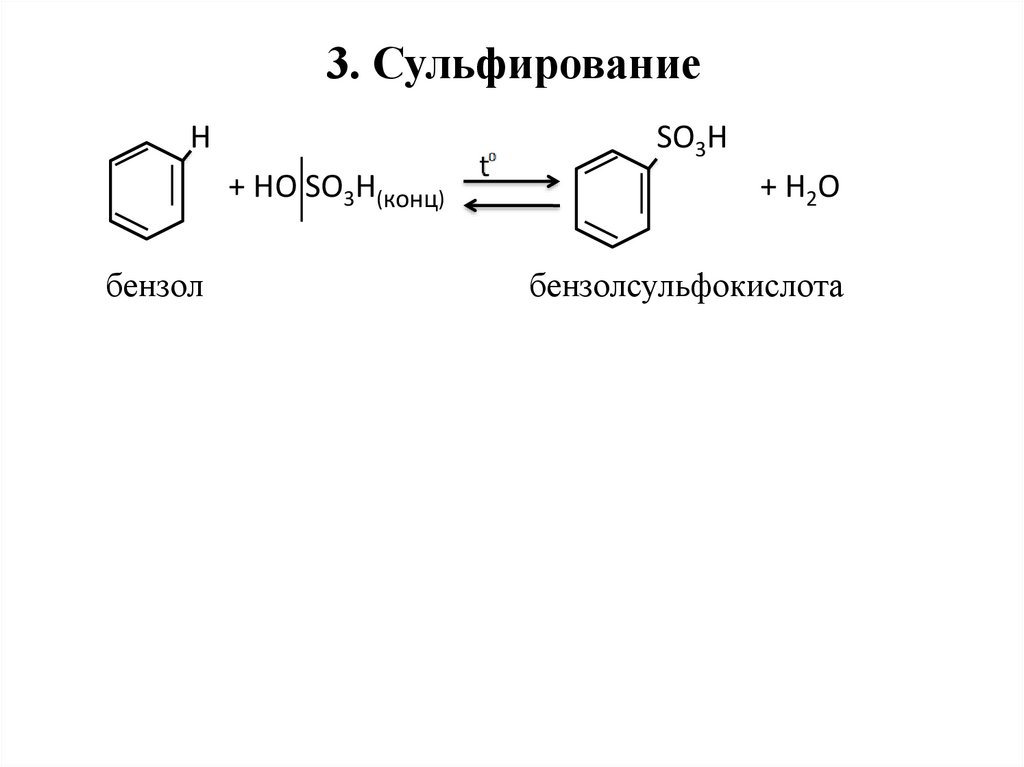
25. 3. Сульфирование
НSO3H
+ HO SO3H(конц)
бензол
+ H2O
бензолсульфокислота
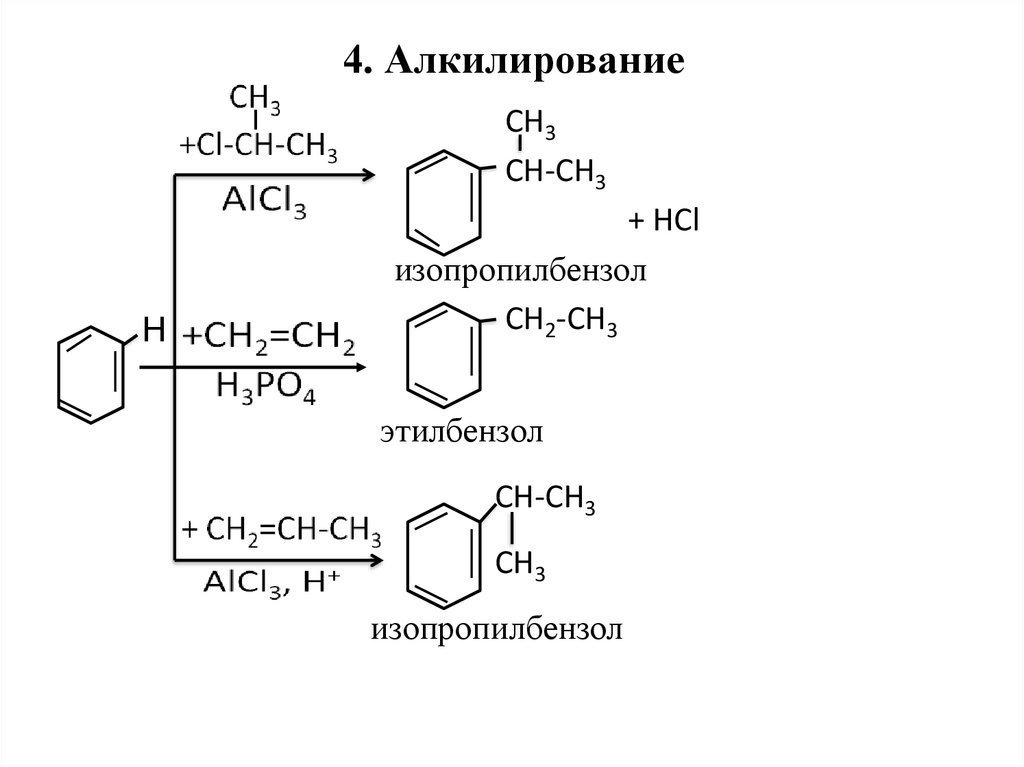
26. 4. Алкилирование
СН3СН-СН3
Н
+ НCl
изопропилбензол
CH2-CH3
этилбензол
CH-CH3
CH3
изопропилбензол
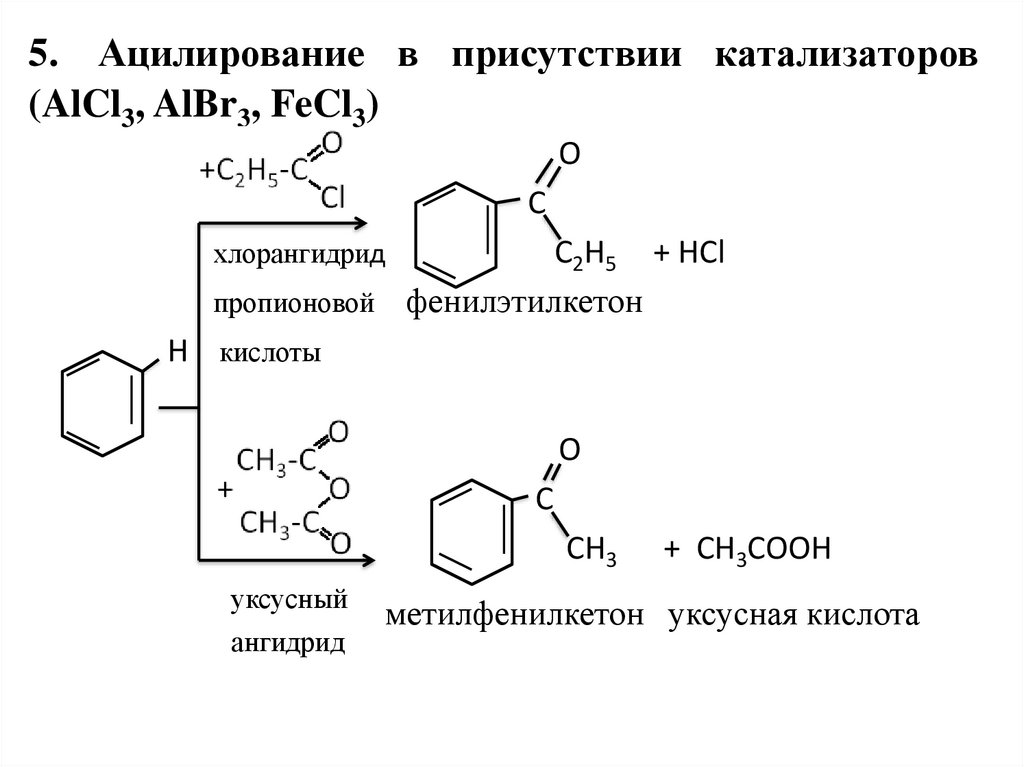
27. 5. Ацилирование в присутствии катализаторов (AlCl3, AlBr3, FeCl3)
OC
C2H5 + HCl
пропионовой фенилэтилкетон
хлорангидрид
Н кислоты
O
C
CH3
уксусный
ангидрид
+ CH3COOH
метилфенилкетон уксусная кислота
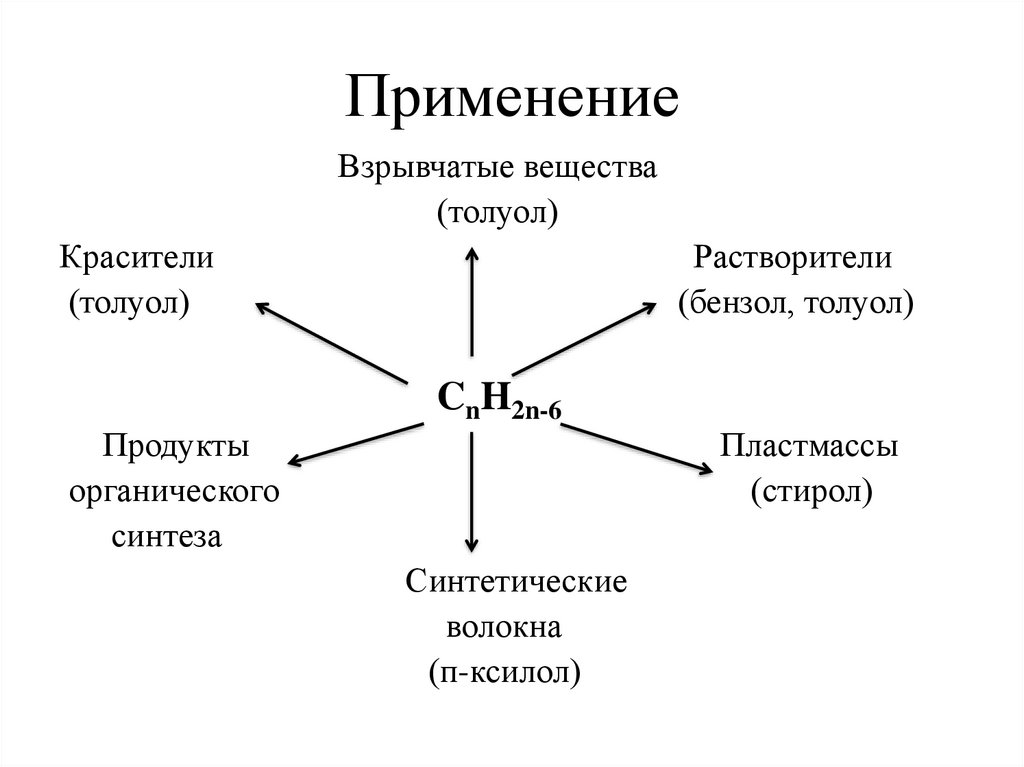
28. Применение
Взрывчатые вещества(толуол)
Красители
(толуол)
Растворители
(бензол, толуол)
CnH2n-6
Продукты
органического
синтеза
Пластмассы
(стирол)
Синтетические
волокна
(п-ксилол)





 Химия
Химия








