Похожие презентации:
Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов
1.
Изменение числаэлектронов на внешнем
энергетическом уровне
атомов химических
элементов
2.
Проверка знаний:1.
2.
Изобразите схемы строения электронной
оболочки атомов:
Вариант 1
Вариант 2
Кислород
Водород
Натрий
Алюминий
Углерод
Азот
Сравните строение электронных оболочек
атомов:
Вариант 1
Вариант 2
Азот и фосфор
Фосфор и сера
Водород и гелий
Литий и натрий
3.
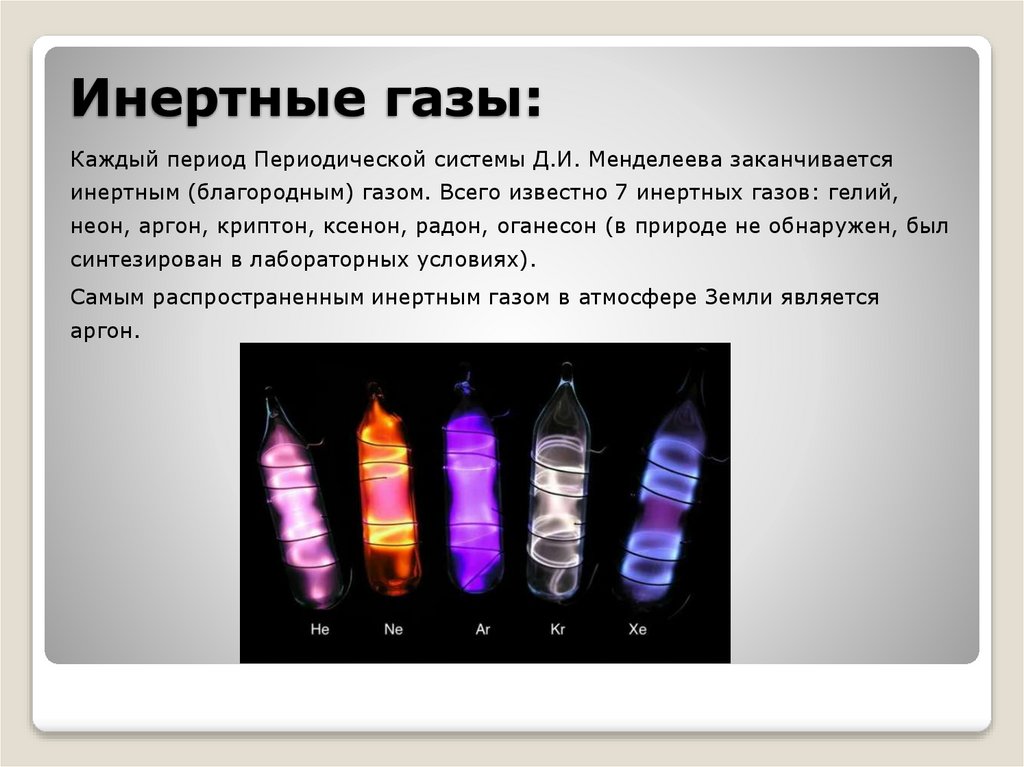
Инертные газы:Каждый период Периодической системы Д.И. Менделеева заканчивается
инертным (благородным) газом. Всего известно 7 инертных газов: гелий,
неон, аргон, криптон, ксенон, радон, оганесон (в природе не обнаружен, был
синтезирован в лабораторных условиях).
Самым распространенным инертным газом в атмосфере Земли является
аргон.
4.
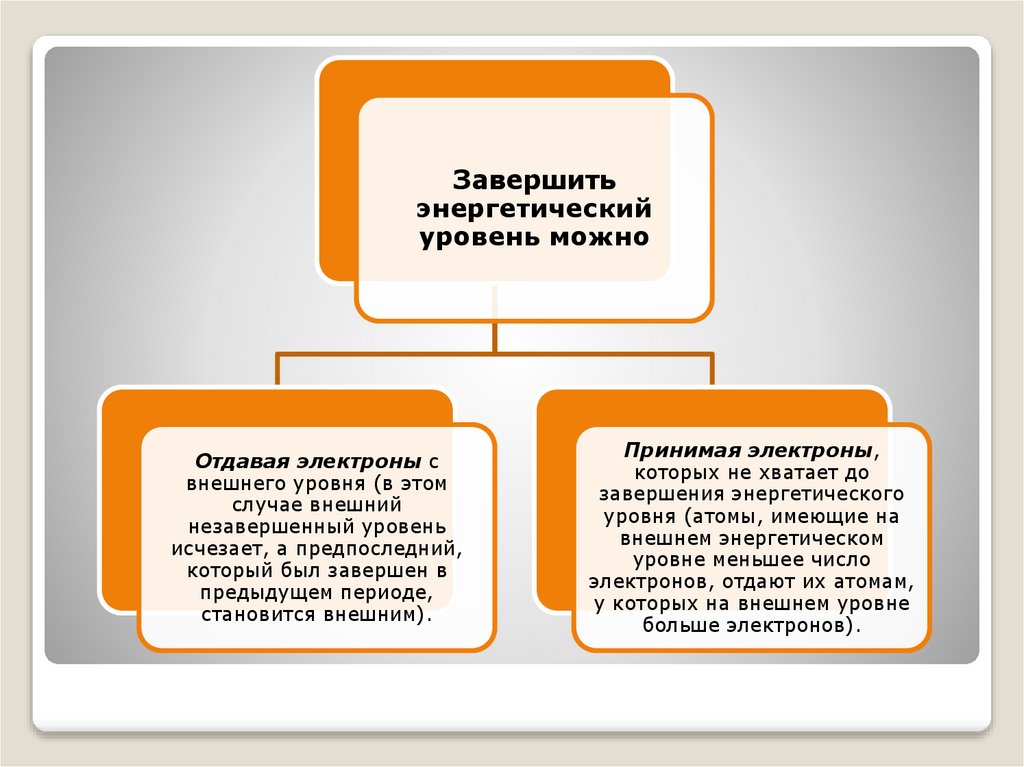
Завершитьэнергетический
уровень можно
Отдавая электроны с
внешнего уровня (в этом
случае внешний
незавершенный уровень
исчезает, а предпоследний,
который был завершен в
предыдущем периоде,
становится внешним).
Принимая электроны,
которых не хватает до
завершения энергетического
уровня (атомы, имеющие на
внешнем энергетическом
уровне меньшее число
электронов, отдают их атомам,
у которых на внешнем уровне
больше электронов).
5.
Инертные газы:У атомов инертных газов на внешних, самых
удаленных от ядра уровнях находится
восемь электронов (у гелия – два). Это
своеобразный идеал прочности
энергетического уровня, к которому
стремятся атомы всех остальных элементов
ПСХЭ Д.И. Менделеева.
6.
Отдача электронов:Тенденция к отдаче электронов с внешнего
уровня имеют атомы элементов-металлов.
Чем легче атомы элемента-металла отдают свои
внешние электроны, тем в большей степени
выражены у него металлические свойства.
Наиболее типичными металлами в
Периодической системе Д.И. Менделеева
являются элементы главной подгруппы I
группы (IA группы).
7.
Принятие электронов:Тенденция к принятию недостающих до завершения
внешнего энергетического уровня имеют атомы элементовнеметаллов.
В пределах периода с увеличением заряда атомного ядра, а
соответственно и с увеличением числа внешних электронов
металлические свойства химических элементов ослабевают.
Неметаллические свойства элементов, характеризующиеся
легкостью принятия электронов на внешний уровень, при этом
усиливаются. Наиболее типичными неметаллами в
Периодической системе Д.И. Менделеева являются элементы
главной подгруппы VII группы (VIIA группы).
8.
Способность атома принимать иотдавать электроны:
На способность атомов принимать и отдавать
электроны оказывает влияние не только число
электронов на внешнем уровне, но и радиус
атома.
В пределах периода число энергетических
уровней у атомов элементов не изменяется, а вот
радиус уменьшается, так как увеличивается
заряд ядра. Поэтому притяжение электронов к
ядру усиливается, и радиус атома уменьшается
(атом «сжимается»). Поэтому становится все
труднее отдать внешние электроны и все легче
принять недостающие до заполнения
энергетического уровня электроны.
9.
В Периодической системе Д.И. Менделеева сувеличением порядкового номера свойства
атомов изменяются:
10.
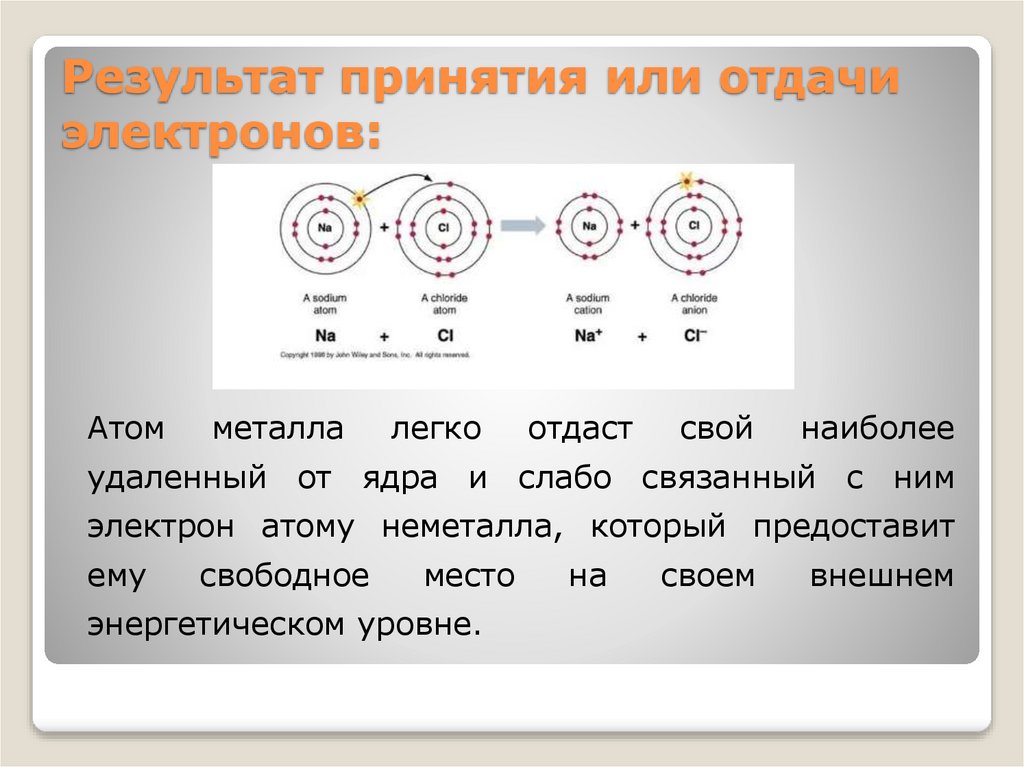
Результат принятия или отдачиэлектронов:
Атом
металла
легко
отдаст
свой
наиболее
удаленный от ядра и слабо связанный с ним
электрон атому неметалла, который предоставит
ему
свободное
место
энергетическом уровне.
на
своем
внешнем
11.
Атом металла, лишенный одногоотрицательного заряда, приобретает
положительный заряд, а атом
неметалла благодаря полученному
электрону превращается в
отрицательно заряженную частицу –
ион.
12.
Разноименно заряженные ионы по законупритяжения противоположных зарядов
соединяются, между ними возникает
химическая связь.
Химическая связь, образующаяся между
ионами, называют ионной.
13.
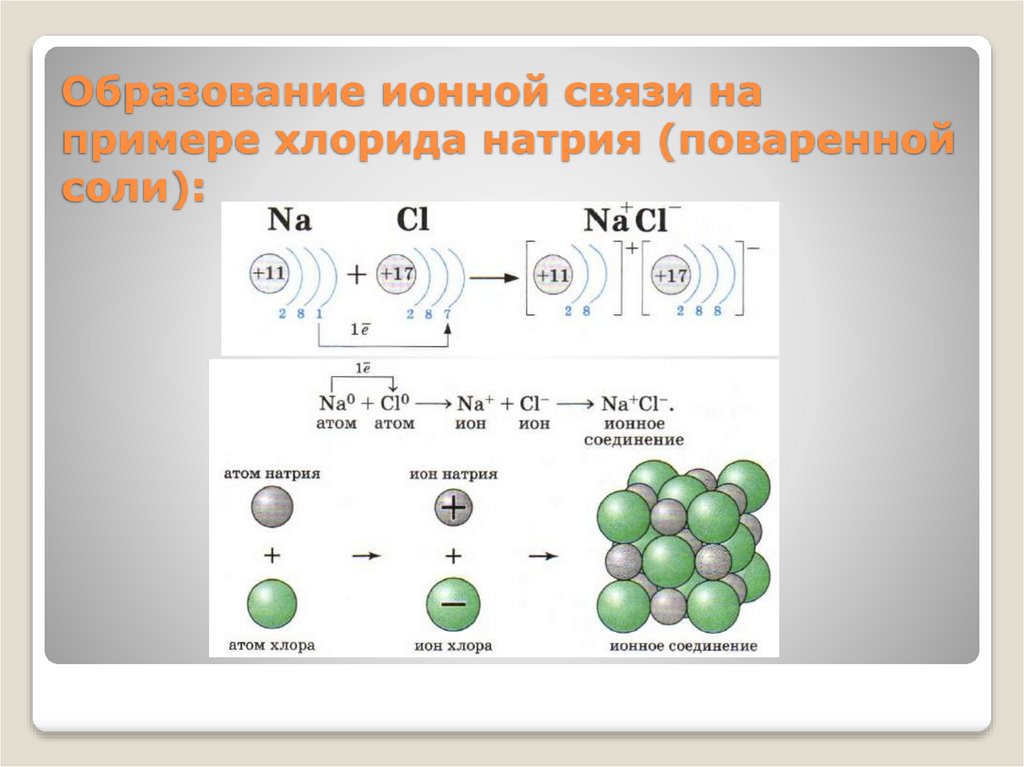
Образование ионной связи напримере хлорида натрия (поваренной
соли):
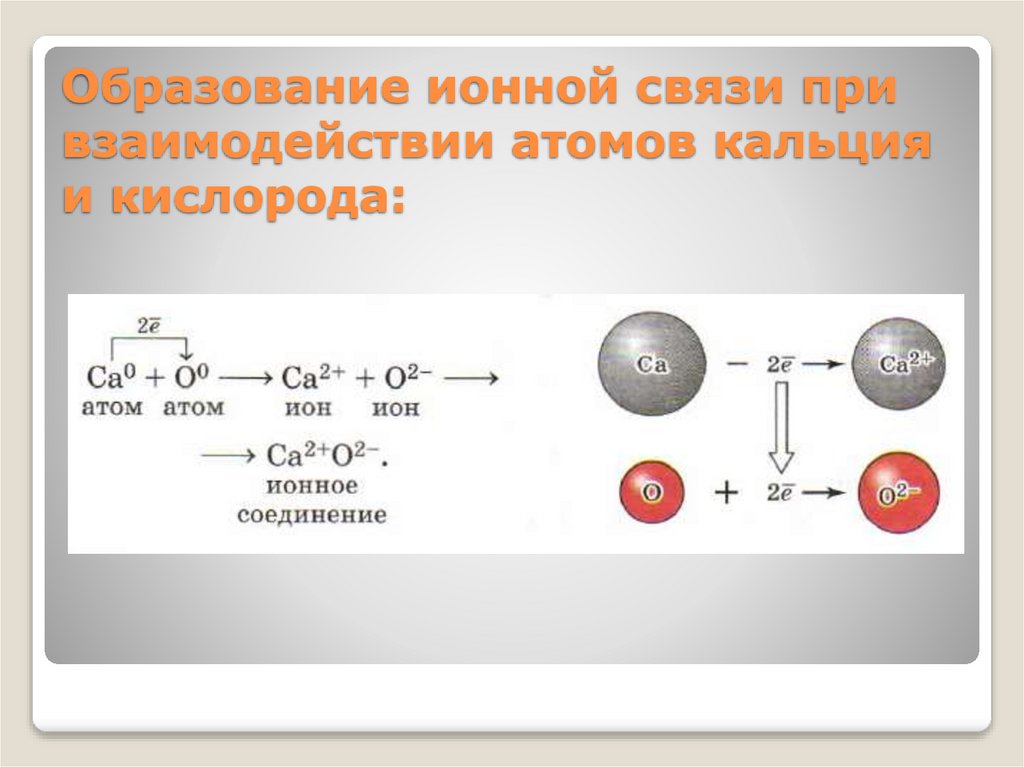
14.
Образование ионной связи привзаимодействии атомов кальция
и кислорода:









 Химия
Химия








