Похожие презентации:
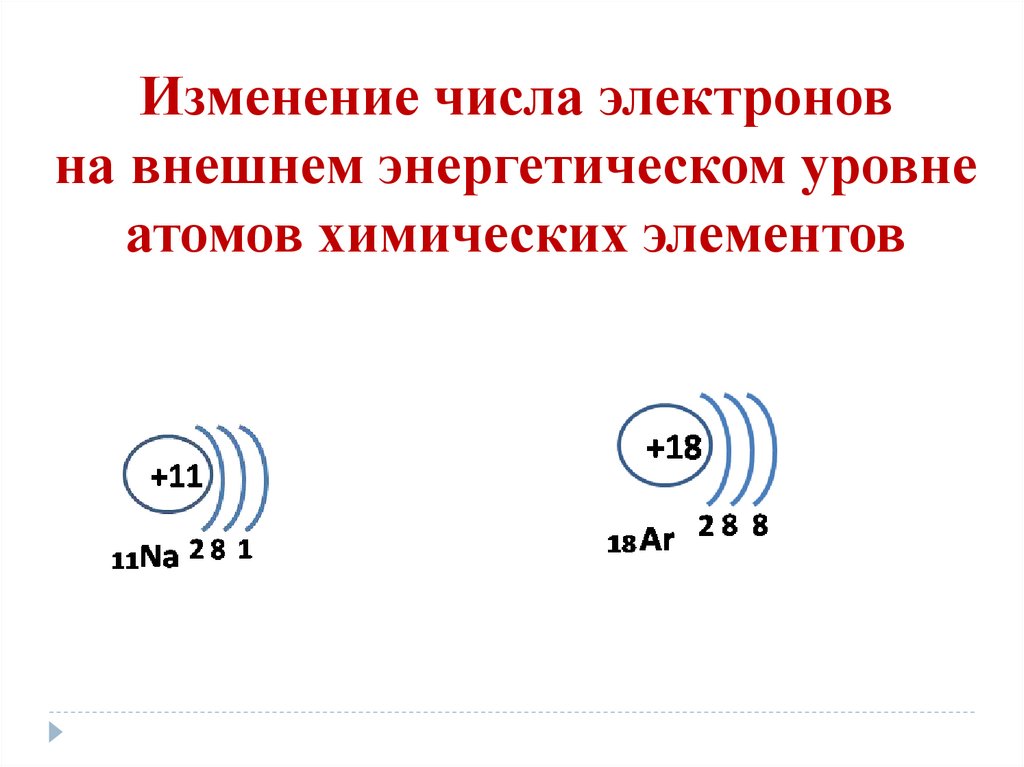
Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов
1.
Изменение числа электроновна внешнем энергетическом уровне
атомов химических элементов
2.
Атомы разных химических элементов образуют химические связи. Такпоявляются простые и сложные вещества.
Происходит это за счёт внешних (валентных) электронов.
Атомы стремятся получить энергетически выгодное состояние.
Оно достигается, когда внешний энергетический уровень завершён,
то есть соответствует атомам инертных газов.
Смотрим в Периодическую таблицу.
Завершённый внешний уровень имеют атомы элементов He, Ne, Ar.
3.
Ne +102e 8e
Na0 – 1e = Na+1
Атомы, которые отдают электроны, называются восстановителями.
Итак натрий проявляет восстановительные свойства, так как может
только отдавать свой внешний электрон.
Al +13
2e 8e 3e
Al0 – 3e = Al+3
восстановитель
Только восстановительными свойствами обладают атомы
металлов.
4.
N0 + 3e = N-3окислитель
Атомы, которые принимают электроны, называются окислителями.
+9
F
F0 + 1e = F-1
2
7
Фтор более активный окислитель, чем азот, так как 1 электрон
принять легче, чем 3.
5.
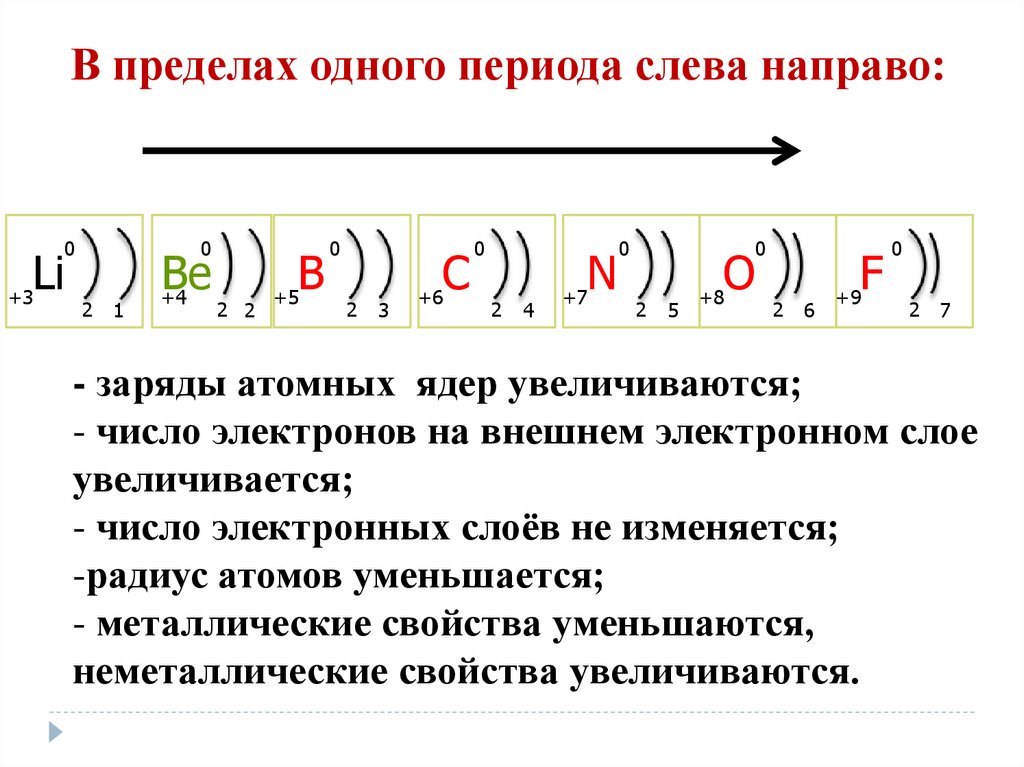
В пределах одного периода слева направо:0
Li
+3
0
2
1
Be
+4
2 2
B
+5
0
2
3
C
+6
0
2
4
N
+7
0
0
2
5
O
+8
2
6
F
+9
0
2
7
- заряды атомных ядер увеличиваются;
- число электронов на внешнем электронном слое
увеличивается;
- число электронных слоёв не изменяется;
-радиус атомов уменьшается;
- металлические свойства уменьшаются,
неметаллические свойства увеличиваются.
6.
В пределах одной группы главной подгруппысверху вниз:
Li
-заряды атомных ядер
+3
2
Na
+11
K
+19
2
2
Rb
+37
2
1
увеличиваются;
-число электронов на внешнем
электронном слое не изменяется;
-число электронных слоёв
увеличивается;
-радиус атомов увеличивается;
-металлические свойства
увеличиваются.
8 1
8 8
1
8 18 8
1
7.
Cl+17
Cl0 + 1e = Cl-1
2
8 7
Cl0 -7e = Cl+7
+9
F
2
7
8.
В пределах одной группы главной подгруппысверху вниз:
-заряды атомных ядер
F
+9
Cl
+17
+35
Br
+53
I
2
7
2
8 7
2
8 18 7
2
8 18 18 7
увеличиваются;
-число электронов на внешнем
электронном слое не изменяется;
-число электронных слоёв
увеличивается;
-радиус атомов увеличивается;
-неметаллические свойства
уменьшаются.






 Химия
Химия








