Похожие презентации:
Алюминий, его соединения
1.
Алюминий,его соединения
работу выполнила
учитель химии ГБОУ СОШ № 547
Антипова Татьяна Евгеньевна
Санкт-Петербург 2020
2.
Al+13
2
8
3
Al0 - 3ē → Al+3
Степень окисления алюминия в его соединениях +3.
3.
Алюминий представляет собой серебристо-белый металл.Лёгкий (ρ=2,7г/см3) и мягкий.
Плавится при температуре 660 0С.
Он очень пластичный и легко вытягивается в проволоку и
прокатывается в фольгу.
Алюминий обладает большой электро- и
теплопроводностью.
Для алюминия характерна высокая упругость.
4.
Соединения алюминияАлюмосиликаты
Бокситы
Корунд (Al2O3)
5.
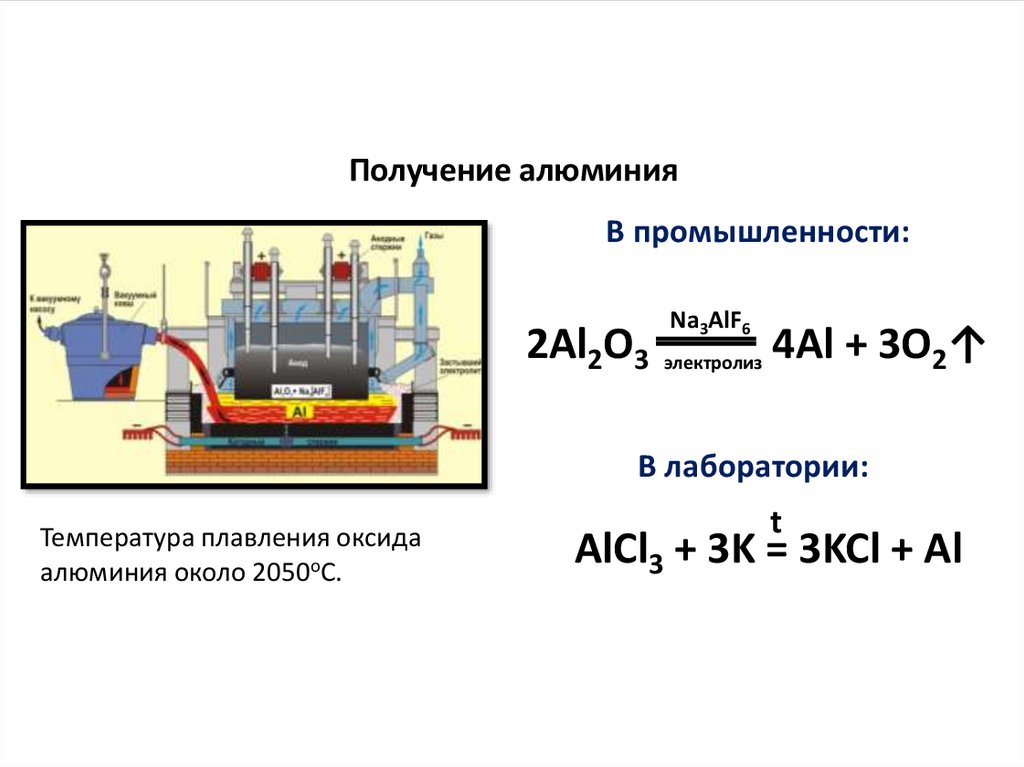
Получение алюминияВ промышленности:
2Al2O3
Na3AlF6
электролиз
4Al + 3O2↑
В лаборатории:
Температура плавления оксида
алюминия около 2050оС.
t
AlCl3 + 3K = 3KCl + Al
6.
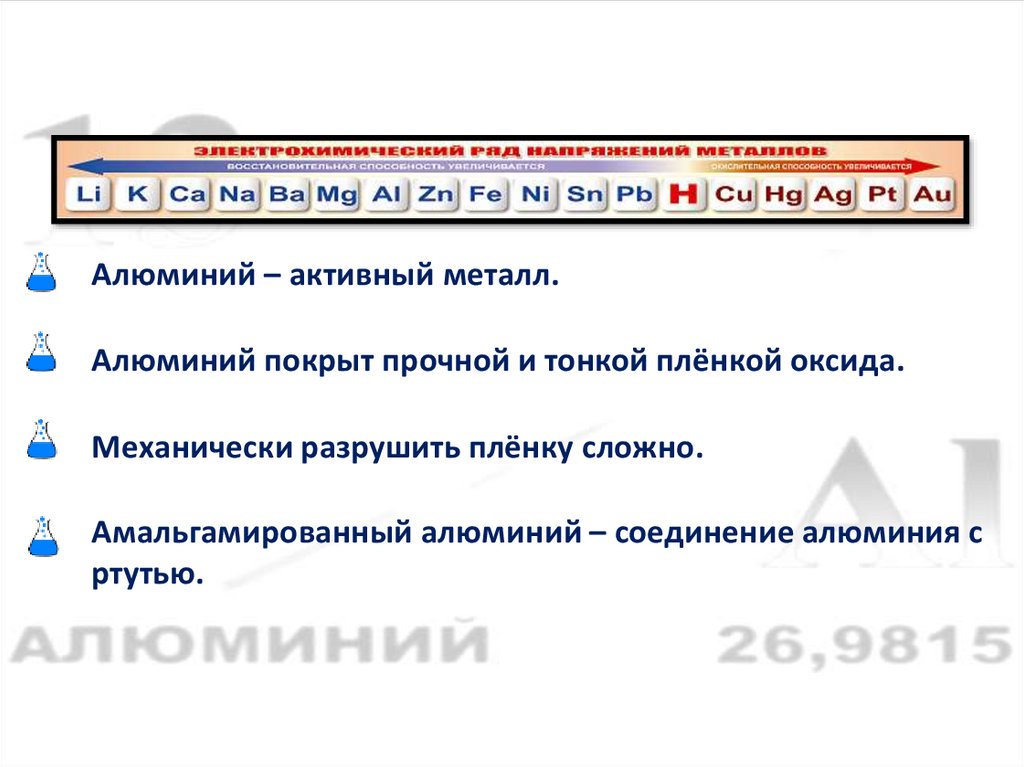
Алюминий – активный металл.Алюминий покрыт прочной и тонкой плёнкой оксида.
Механически разрушить плёнку сложно.
Амальгамированный алюминий – соединение алюминия с
ртутью.
7.
Химические свойстваРеакция с кислородом
0
12 ē
0
t
+3 -2
4Al + 3O2 = 2Al2O3
Аl – восстановитель
O2 – окислитель
оксид
алюминия
8.
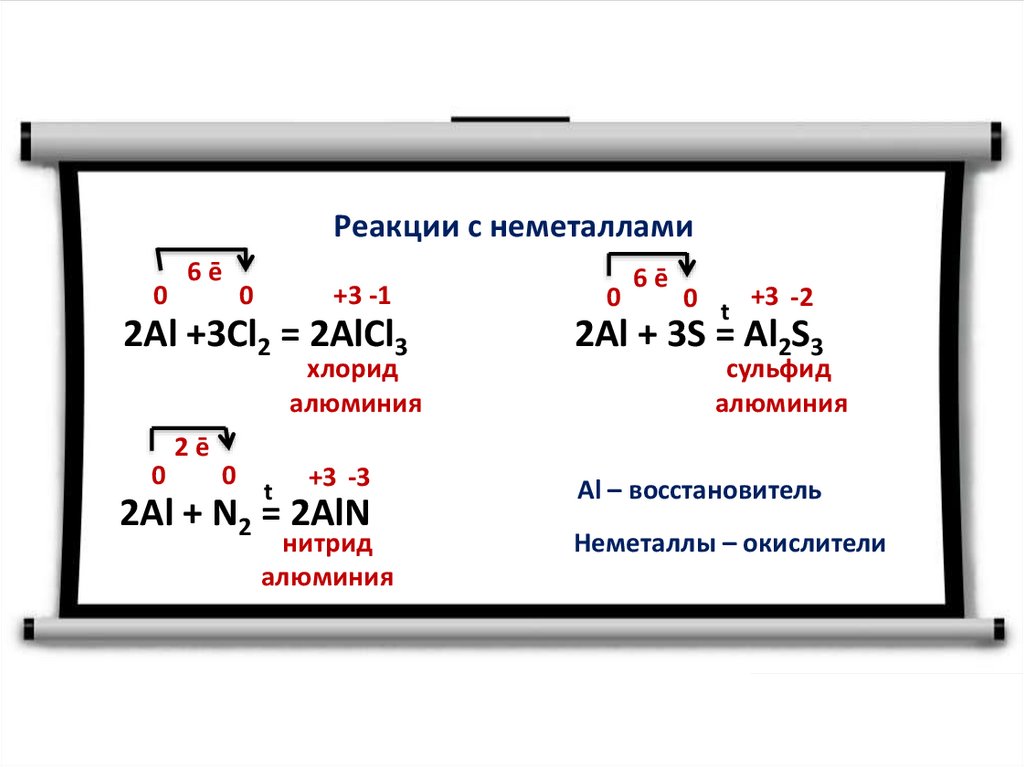
Реакции с неметаллами0
6ē
+3 -1
0
2Al +3Cl2 = 2AlCl3
хлорид
алюминия
0
2ē
0
t
+3 -3
2Al + N2 = 2AlN
нитрид
алюминия
0
6ē
0 t +3 -2
2Al + 3S = Al2S3
сульфид
алюминия
Аl – восстановитель
Неметаллы – окислители
9.
Химические свойстваРеакции с растворами кислот
0
+1
+3
0
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
Восст-ль Ок-ль
0
+1
сульфат
алюминия
+3
0
2Al + 6HCl = 2AlCl3 + 3H2↑
Восст-ль Ок-ль
хлорид
алюминия
10.
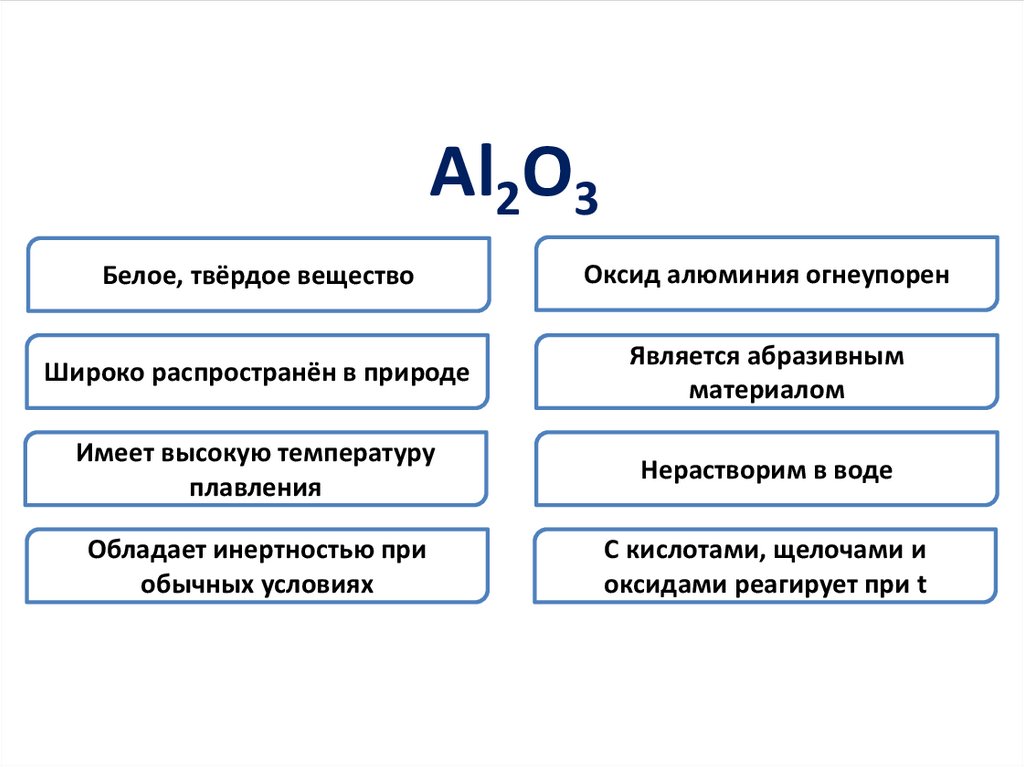
Al2O3Белое, твёрдое вещество
Оксид алюминия огнеупорен
Широко распространён в природе
Является абразивным
материалом
Имеет высокую температуру
плавления
Нерастворим в воде
Обладает инертностью при
обычных условиях
С кислотами, щелочами и
оксидами реагирует при t
11.
Благородная шпинельДрагоценный хризоберилл
12.
Соли алюминияВсе соли алюминия, кроме фосфатов,
хорошо растворимы в воде
Некоторые соли, такие как сульфиды,
сульфиты разлагаются водой
Хлорид алюминия, применяется как
катализатор
13.
Al14.
Al15.
Al16.
Al
Алюминий — самый распространённый металл в
природе.
A
l
Он расположен в 3 периоде IIIA группы, имеет
степень окисления +3.
A
l
В природе встречается только в виде соединений.
A
l
По физическим свойствам – типичный
металл.
17.
Al
Алюминий химически очень активный.
A
l
Реагирует с кислотами и щелочами.
A
l
Алюминий, оксид алюминия и гидроксид алюминия
проявляют амфотерные свойства.
A
l
Алюминий и его сплавы находят широкое
распространение в промышленности и
быту.










 Химия
Химия








