Похожие презентации:
Кинетика химических реакций. Основные понятия и законы химической кинетики
1. Кинетика химических реакций
КИНЕТИКА ХИМИЧЕСКИХРЕАКЦИЙ
Основные понятия и законы
химической кинетики
2.
Химическая кинетика – учение оскоростях химических реакций и влиянии
различных факторов на скорость.
Задачи химической кинетики:
1) расчет скоростей реакций и построение
кинетических кривых, т.е. зависимости
концентраций реагирующих веществ от
времени;
2) определение механизмов реакций по
кинетическим кривым.
3.
Химическаякинетика
изучает
протекание процессов во времени, т.е. в
неравновесном состоянии системы.
Основная кинетическая характеристика
– скорость реакции.
Скорость
химической
реакции
изменение числа молей вещества в
единицу
времени
в
единице
реакционного объема .
4.
Скорость в момент времени τ − истиннаяили мгновенная скорость:
«+» - скорость по
продукту,
(1)
«─» - скорость по
исходному веществу.
Для реакций, протекающих при V=const, скорость
выражают через молярную концентрацию
(2)
5.
Средняя скоростьинтервале времени:
на
определенном
(3)
Скорость реакции зависит от многих факторов:
природы
реагирующих
веществ,
их
концентраций или парциальных давлений,
температуры, наличия катализатора, типа
реактора, наличия протока реагентов.
6.
Формальная кинетика – изучает зависимостьскорости реакции только от концентрации
веществ при постоянной температуре.
Основной постулат формальной кинетики –
закон действующих масс Гульдберга и Вааге:
Скорость химической реакции
в каждый
момент
времени
пропорциональна
концентрациям
реагирующих
веществ,
возведенным в некоторые степени.
7.
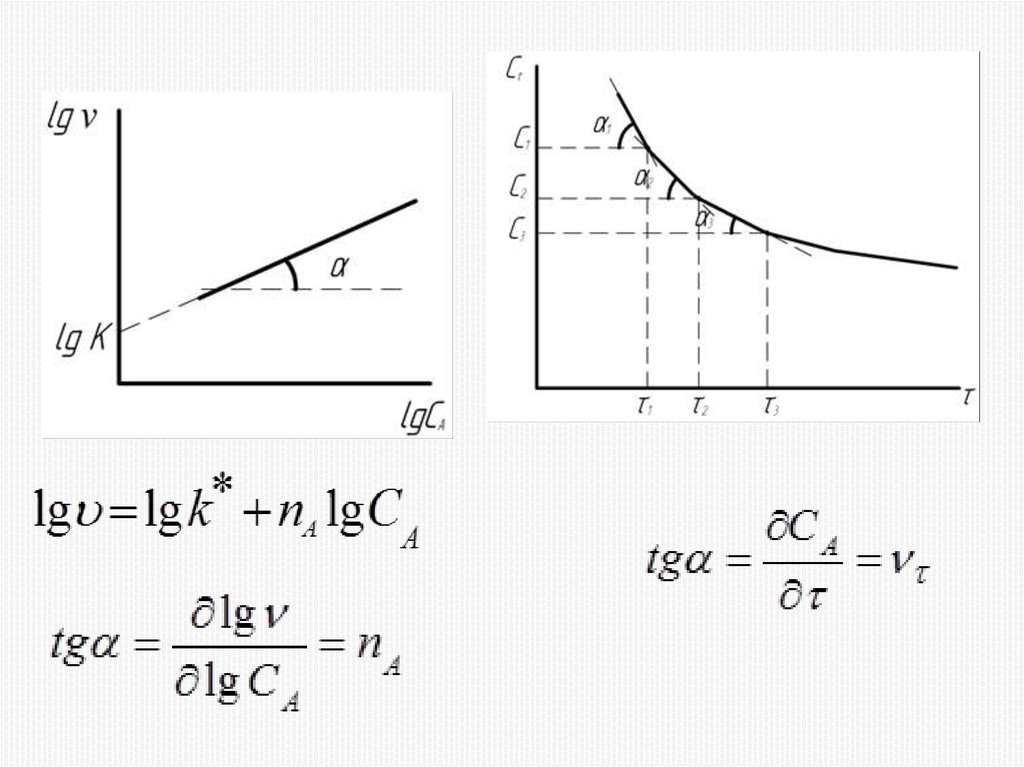
(4)k – константа скорости реакции (удельная
скорость);
nA, nB, nC – частные порядки реакции по веществам
А, В и С соответственно.
Частные порядки не равны стехиометрическим
ко-эффициентам в уравнении реакции, они
совпадают
только
для
случая
простых
(одностадийных) реакций.
8.
(4)Частный порядок по веществу равен
показателю степени при концентрации
этого вещества в кинетическом уравнении
реакции.
Частные
порядки
не
равны
стехиометрическим ко-эффициентам в
уравнении реакции и совпадают с рими
только для случая простых (одностадийных)
реакций.
9.
Сумму показателей степеней при концентрацияхв кинетическом уравнении реакции (частных
порядков) называют общим порядком реакции:



















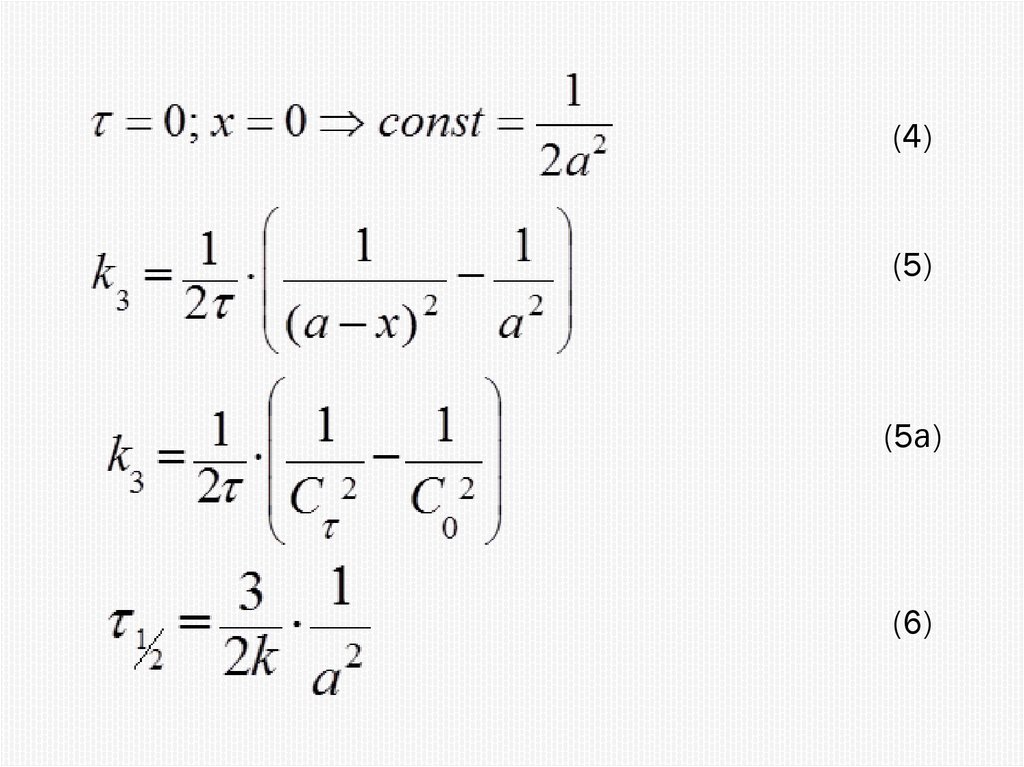




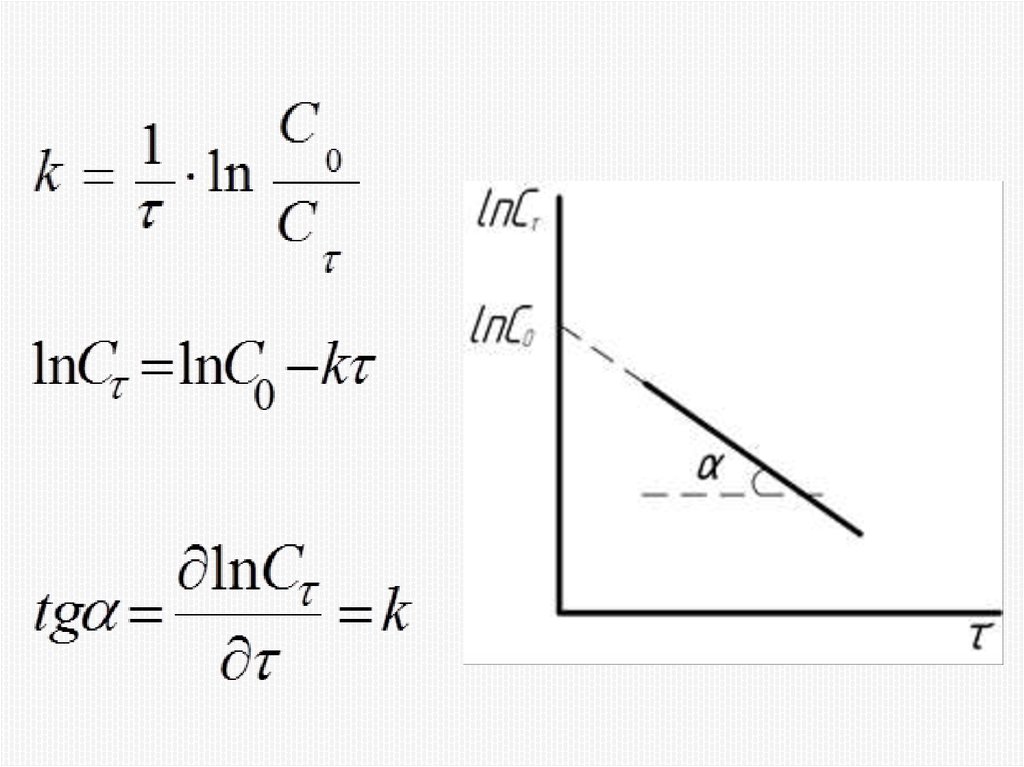

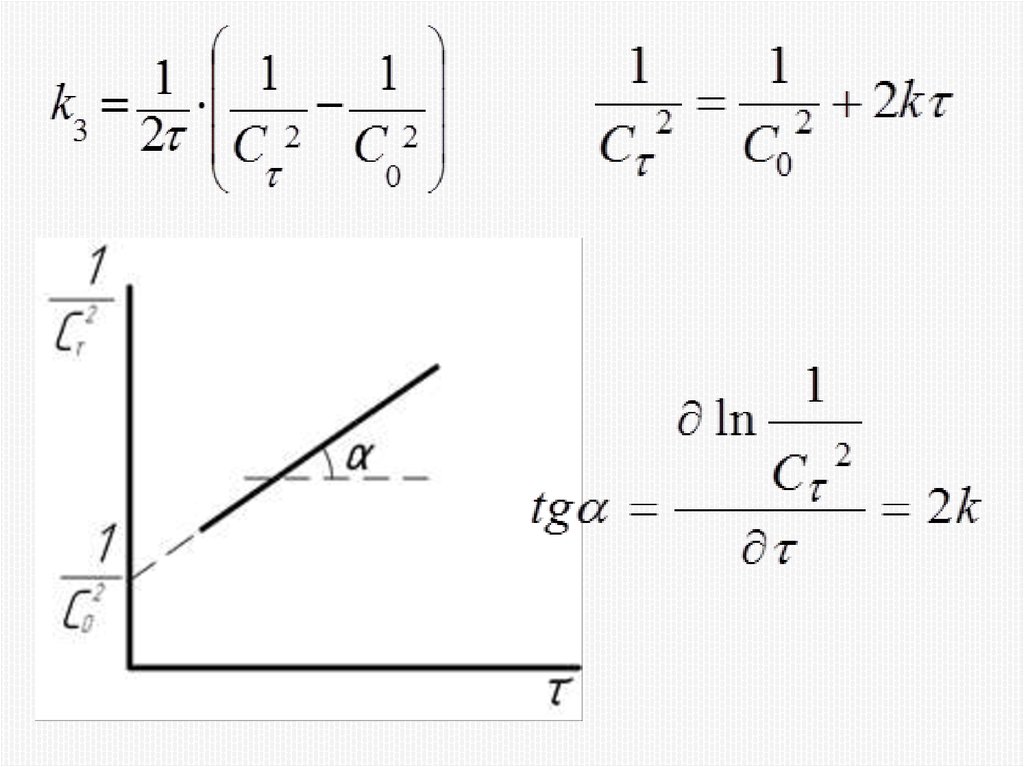
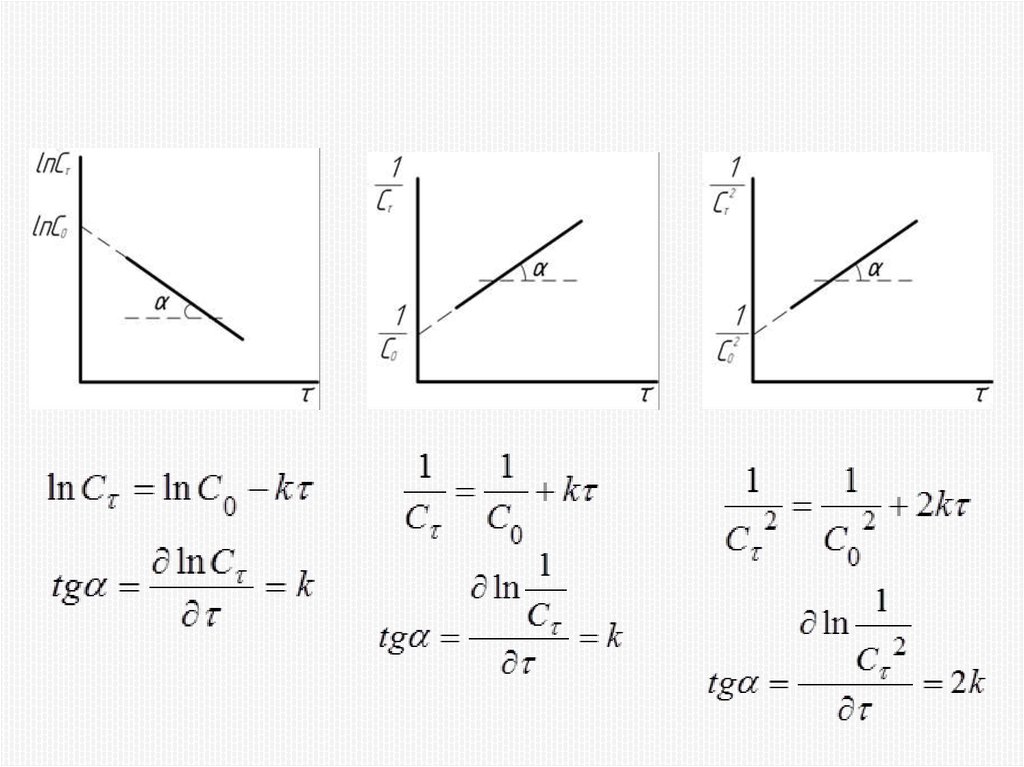

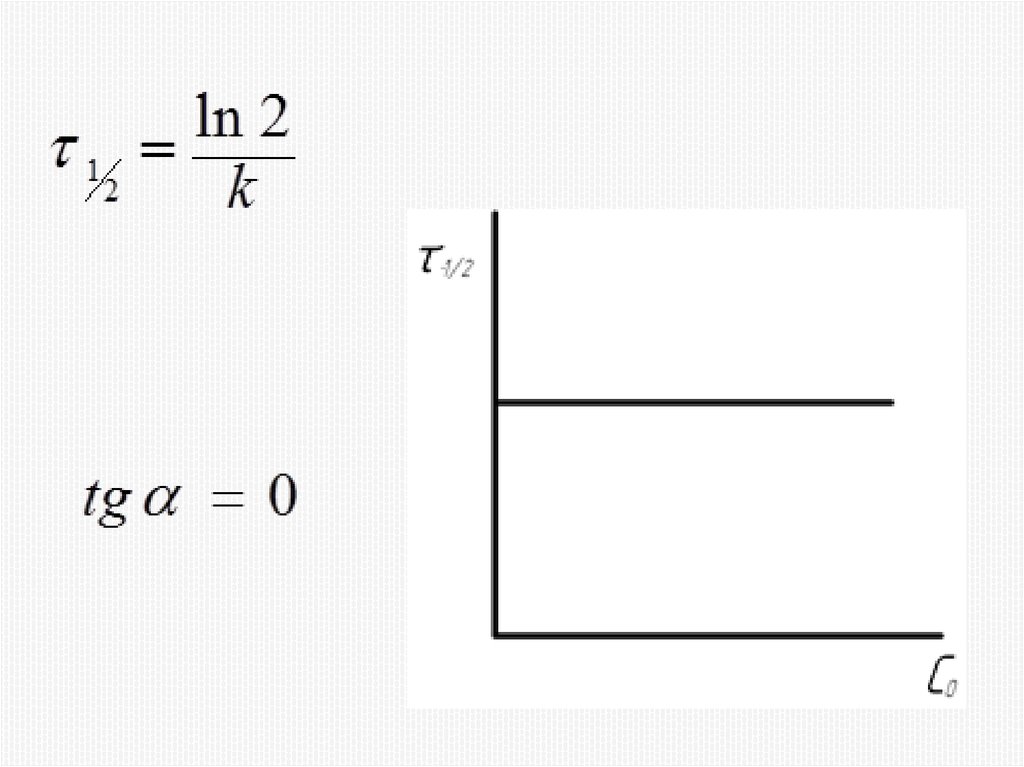
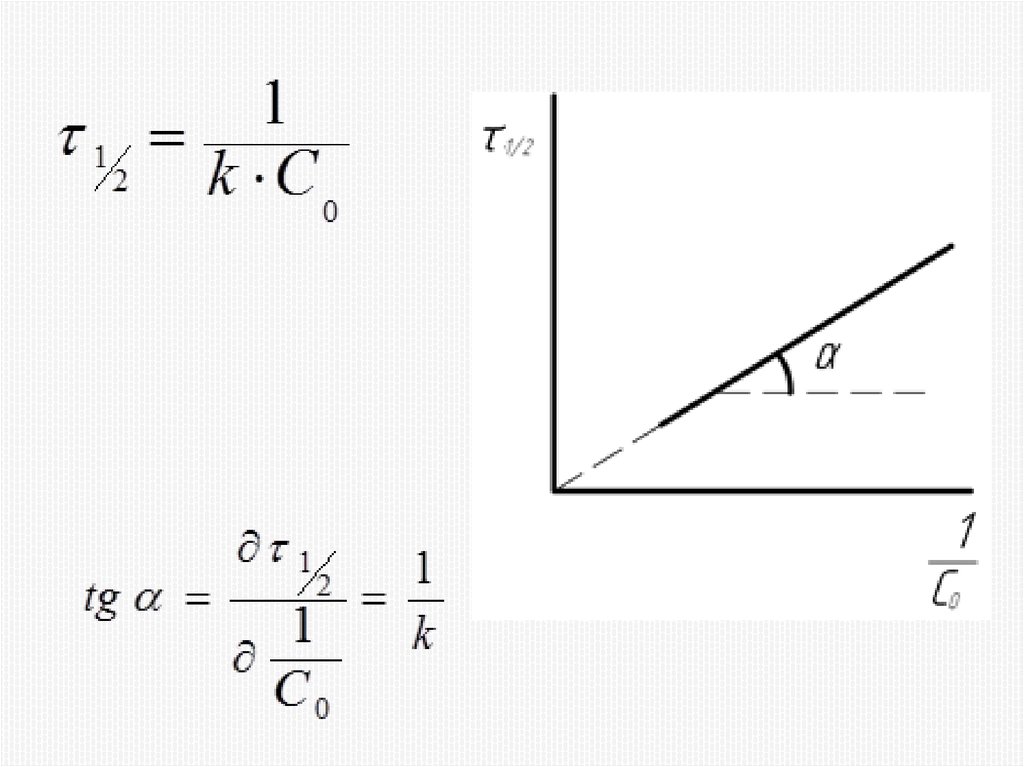
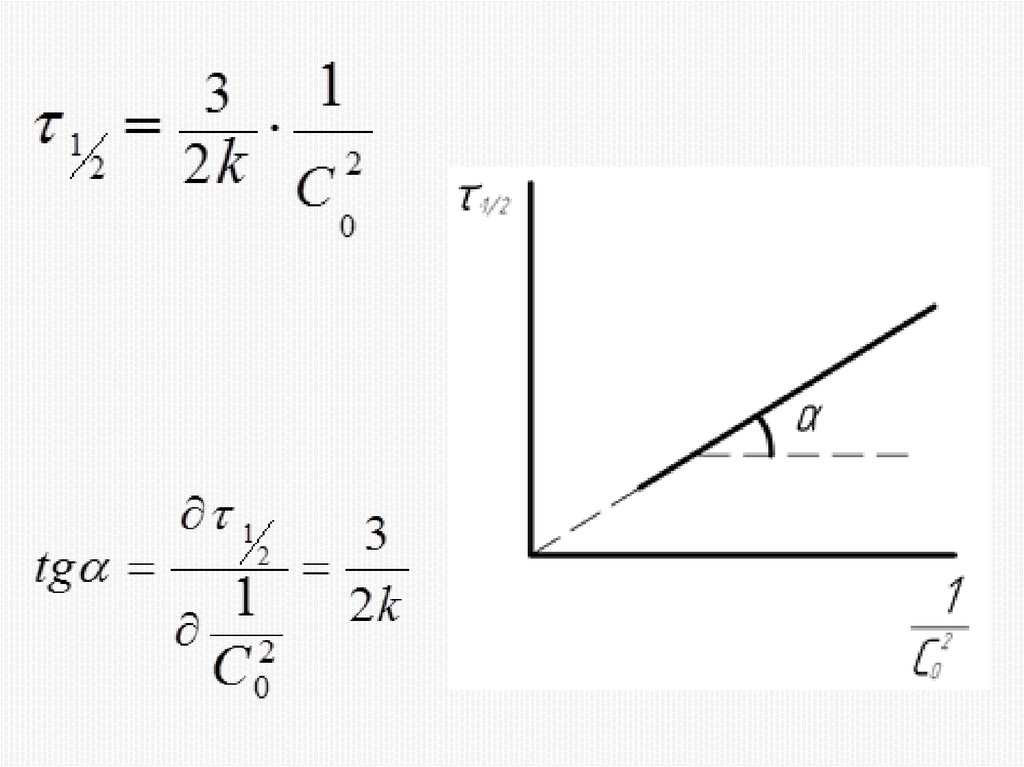
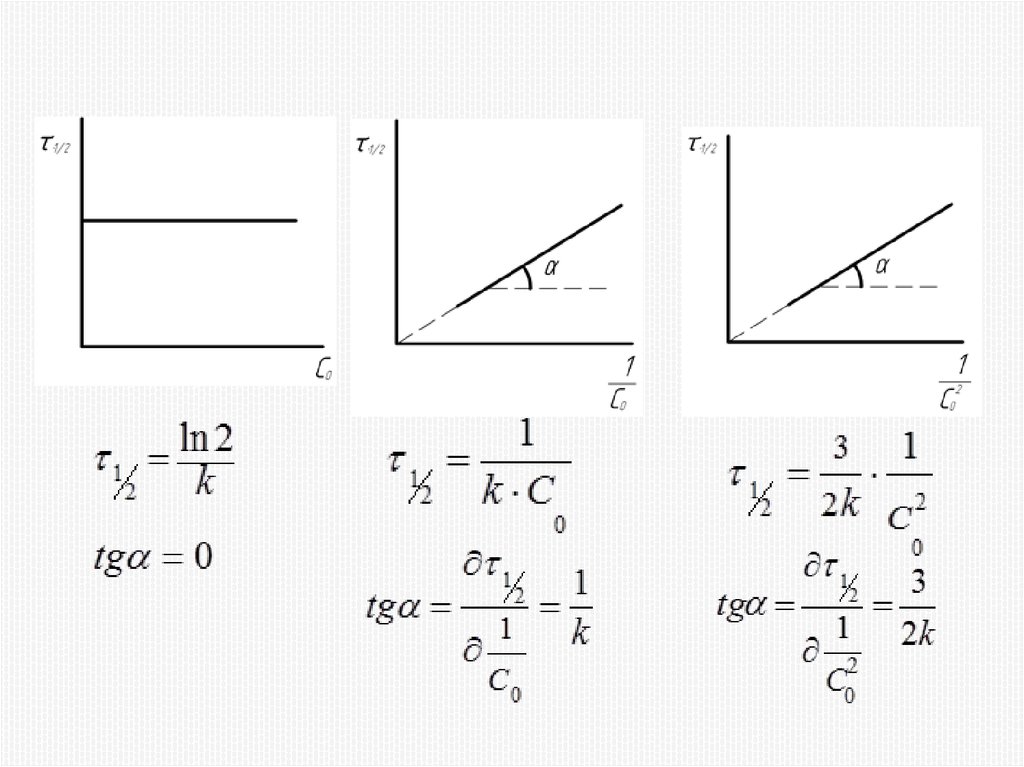





 Химия
Химия








