Похожие презентации:
Щелочи. Получение и химические свойства
1.
ЩелочиПолучение и химические
свойства
2.
Получение оснований1. Растворимых: Взаимодействие оксидов
щелочных или щелочноземельных
металлов (Ме I и II) с водой.
Na2O + H2O = 2NaOH
BaO + H2O = Ba(OH)2
2. Нерастворимых:
Соль + Щелочь = Нерастворимое основание +
Другая соль
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl
3.
Химические свойства щелочей1. Щелочь + кислотный оксид = соль + вода
2NaOH + CO2 = Na2CO3 + H2O
Ca(OH)2 + N2O5 = Ca(NO3)2 + H2O
4.
2. Щелочь + кислота = соль + водаNaOH + HCl = NaCl + H2O
3KOH + H3PO4 = K3PO4 + 3H2O
5.
3. Щелочь + соль (раствор) = нерастворимоеоснование + соль (другая)
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
ZnCl2 + 2NaOH = Zn(OH)2↓ + 2NaCl
6.
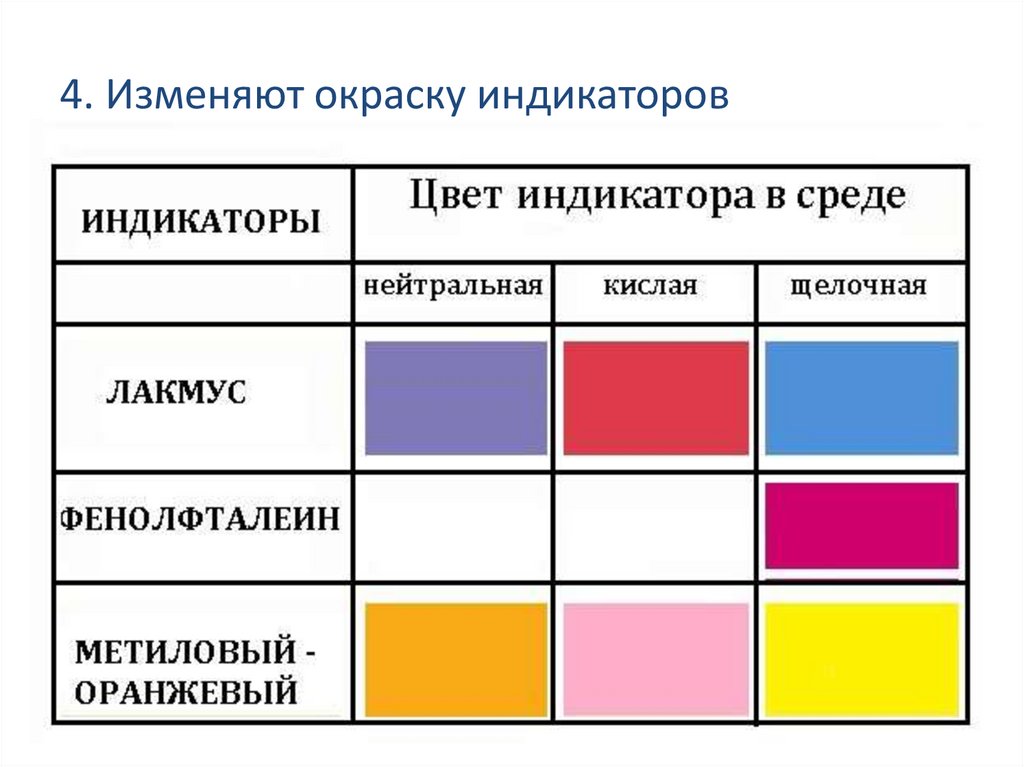
4. Изменяют окраску индикаторов7.
Химические свойстванерастворимых оснований
1. Нерастворимое основание + Кислота =
Соль + Вода
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
8.
2) Разлагаются при нагревании:Нерастворимое основание = Оксид металла
+ Вода
t
2Fe(OH)3 = Fe2O3 + 3H2O
t
Cu(OH)2 = CuO+ H2O
9.
Домашнее задание• Параграф 36, 37.
• Стр. 155 № 7(а), стр. 158 №2








 Химия
Химия








