Похожие презентации:
Получение и химические свойства кислот
1.
Ильина И.В., руководитель ЦДОШ, учитель химии МБОУ «Средняяобщеобразовательная школа №27 имени А.А. Дейнеки» г. Курска
E-mail мой: ilina.irina71@mail.ru
2.
Получение и химические свойствакислот
Урок по химии
8 класс (2 урок)
3.
Цель урока:повторить классификацию и химические свойства кислот.
4.
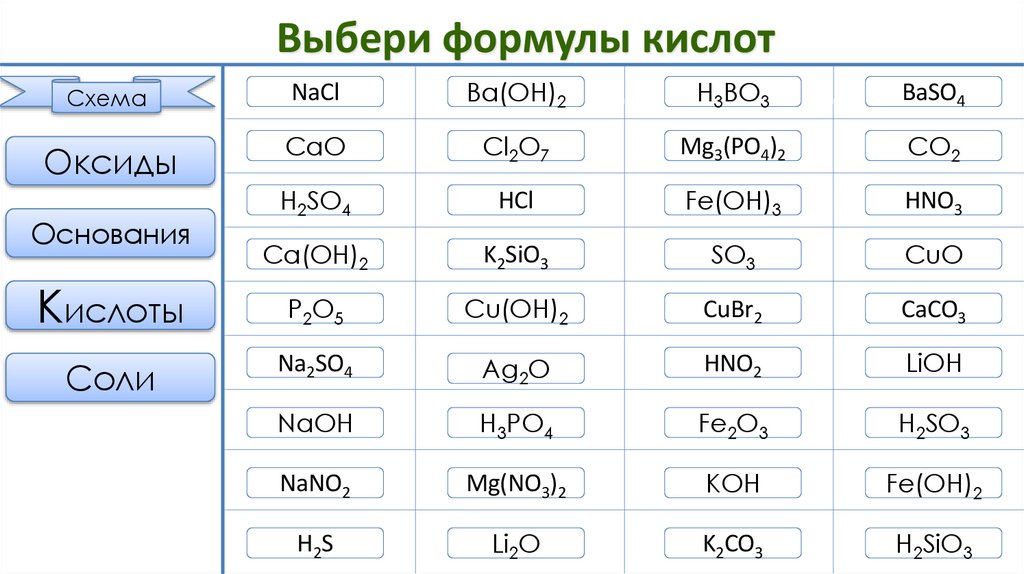
Выбери формулы кислотСхема
NaCl
Ba(ОH)2
H3BО3
BaSO4
Оксиды
СaО
Cl2О7
Mg3(PO4)2
CО2
H2SО4
HCl
Fe(ОH)3
HNO3
Сa(ОH)2
K2SiO3
SО3
CuО
Кислоты
P2О5
Сu(ОH)2
CuBr2
CaCO3
Соли
Na2SO4
Ag2О
HNO2
LiОH
NaОH
H3PО4
Fe2О3
H2SО3
NaNO2
Mg(NO3)2
KОH
Fe(ОH)2
H2S
Li2О
K2CO3
H2SiО3
Основания
5.
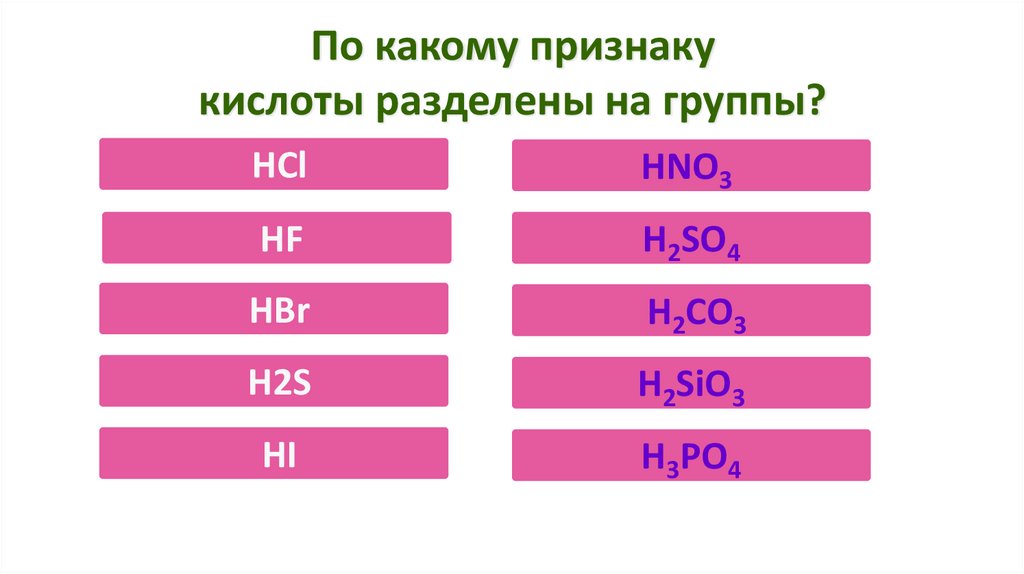
По какому признакукислоты разделены на группы?
HCl
HNO3
HF
H2SO4
HBr
H2CO3
H2S
H2SiO3
HI
H3PO4
6.
По какому признаку кислотыразделены на группы?
?
?
?
HF
HCl
HBr
HI
HNO3
HClO4
H2S
H2SO4
H2SO3
H2CO3
H2SiO3
H3PO4
H3BO3
7.
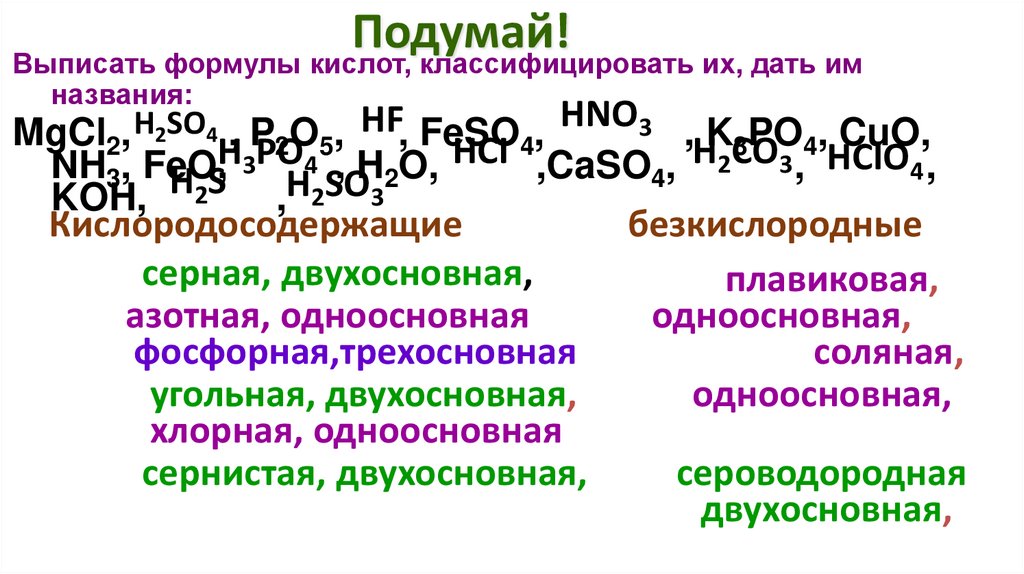
Подумай!Выписать формулы кислот, классифицировать их, дать им
названия:
HF, FeSO , HNO3 , K PO , CuO,
MgCl2, H2SO4H, PPO
O
,
2 5
4
3
4
H
CO
HCI
HClO4 ,
2
3
3
4
NH3, FeO,
,
H
O,
,CaSO
,
,
2
4
KOH, Н2S ,H2SO3
Кислородосодержащие
безкислородные
серная, ,двухосновная,
плавиковая,
H2SO4 серная,
двухосновная, HF плавиковая,
азотная, одноосновная
одноосновная,
HNO3 азотная,
одноосновная одноосновная,
фосфорная,трехосновная
соляная,
H3PO4 фосфорная,трехосновная
HCI соляная,
угольная, двухосновная,
одноосновная,
H2CO3 угольная,
двухосновная, одноосновная,
хлорная, одноосновная
HClO4 хлорная,
одноосновная Н2S
сернистая, двухосновная,
сероводородная
H2SO3 сернистая,
двухосновная, сероводородная
двухосновная,
двухосновная,
8.
Проверь себя1. Выберите группу веществ, в состав которой
входят только двухосновные кислоты.
2. Выберите группу веществ, в состав которой
входят только кислородсодержащие кислоты.
а) HNO3, H2S, HBr, H2CO3
б) HNO2, H2S, H2SiO3, H3PO4
в) H2S, H2SiO3, H2SO3, H2CO3
г) HNO3, H2SO4, H3PO4, HNO2
9.
Проверь себя3. Выберите группу веществ, в состав которой
входят только кислоты.
а) HCl, SO3, NaOH,CuCl2
б) HNO3, H2S, HCl, H3PO4
в) K2O, H2SO4, H2S, KOH
г) AgNO3, CO2, CuSO4, HCl
4. Формула оксида, соответствующего H2SO4?
1)SO2
2) SO3
3)SiO2
4)CO2
5. Формула кислоты, соответствующей N2O3?
1) HNO3
2) HNO2
3) H2SO4 4) H3PO4
10.
Химические загадкиЕсли в паре элементов
Кислород вторым стоит,
Ты же знаешь, эта пара
Называется …
• Оксид – это…
Если формулы начало
Представляется с металла,
ОН – красуется затем,
Вещества знакомы всем.
Не надо придумывать им
название
Ведь эти вещества…
• Основания – это…
11.
Мы состоим из двух частей:Во-первых, водород, о’кей!
Кислоты
Во-вторых, остаток наш.
Ну, вот и весь наш экипаж!
Окрасим лакмус в красный цвет,
Без нас и удобрений нет.
12.
Химические свойства кислот1. Изменяют цвет индикатора
HCl
HNO3
HNO2
Окрашивают лакмус и
метиловый оранжевый в красный цвет
13.
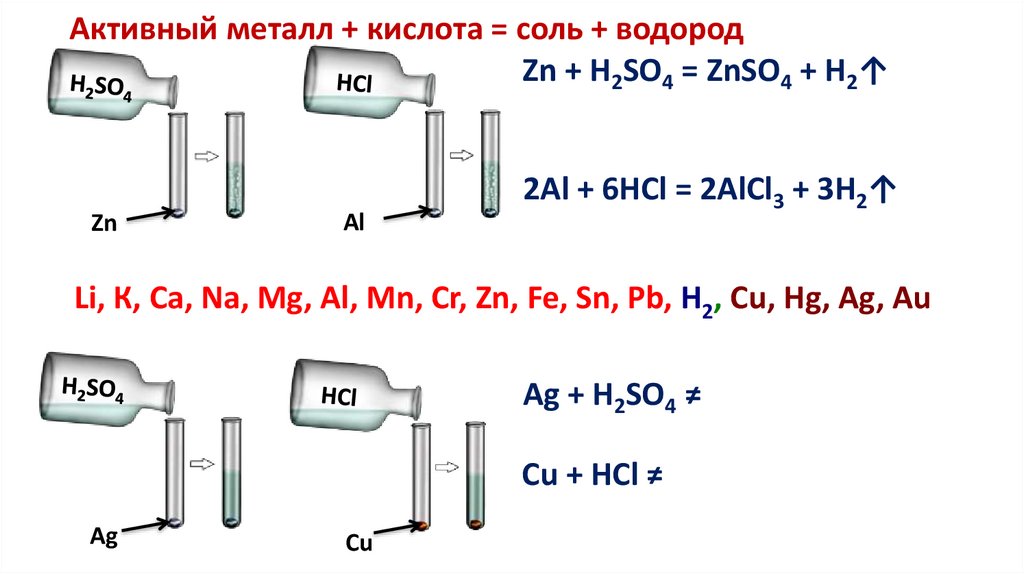
2. Кислоты реагируют с металламиПри этом образуется соль и водород
Это реакции замещения
14.
Для этих реакций необходимы условия:• Металл должен находиться в ряду напряжений до
водорода;
Li, К, Ca, Na, Mg, Al, Mn, Cr, Zn, Fe, Sn, Pb, H2, Cu, Hg, Ag, Au
• Нерастворимые кислоты не вступают в реакцию
с металлами.
• Концентрированная серная кислота и азотная кислота
взаимодействуют с металлами, не образуя водород.
15.
Активный металл + кислота = соль + водородZn + H2SO4 = ZnSO4 + H2↑
Zn
Al
2Al + 6HCl = 2AlCl3 + 3H2↑
Li, К, Ca, Na, Mg, Al, Mn, Cr, Zn, Fe, Sn, Pb, H2, Cu, Hg, Ag, Au
Ag + H2SO4 ≠
Cu + HCl ≠
Аg
Cu
16.
3. Кислоты вступают в реакцииобмена с основными и
амфотерными оксидами
В результате реакции образуется
соль и вода
17.
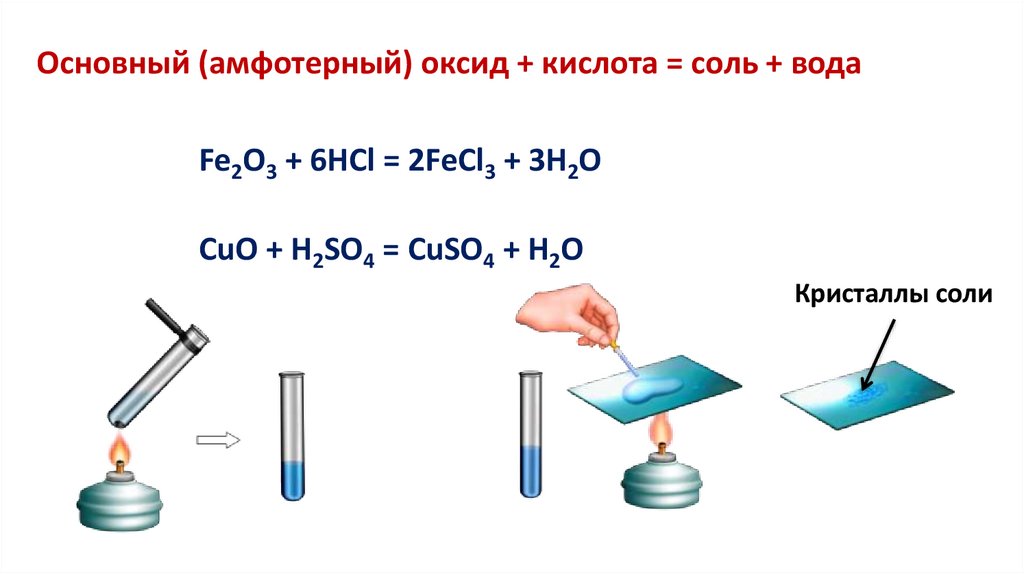
Основный (амфотерный) оксид + кислота = соль + водаFe2O3 + 6HCl = 2FeCl3 + 3H2O
CuO + H2SO4 = CuSO4 + H2O
Кристаллы соли
18.
4. Кислоты реагируют с основаниямиПри этом образуется соль и вода
Это реакция обмена
19.
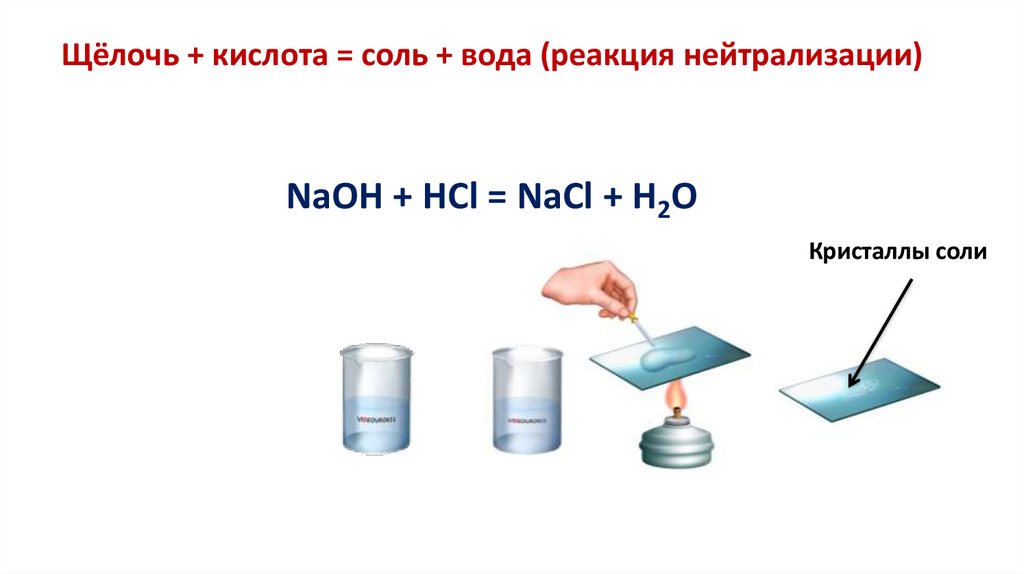
Щёлочь + кислота = соль + вода (реакция нейтрализации)NaOH + HCl = NaCl + H2O
Кристаллы соли
20.
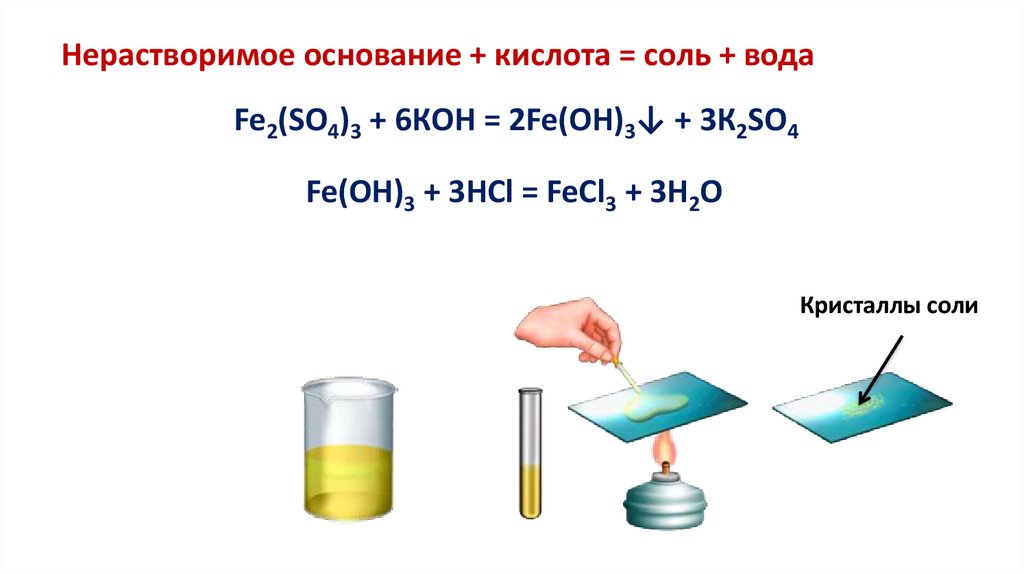
Нерастворимое основание + кислота = соль + водаFe2(SO4)3 + 6КOH = 2Fe(OH)3↓ + 3К2SO4
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Кристаллы соли
21.
Кислоты вступают в реакцииобмена с солями
При этом образуется новая
кислота и новая соль
Реакция идёт, если образуется
осадок или газ
22.
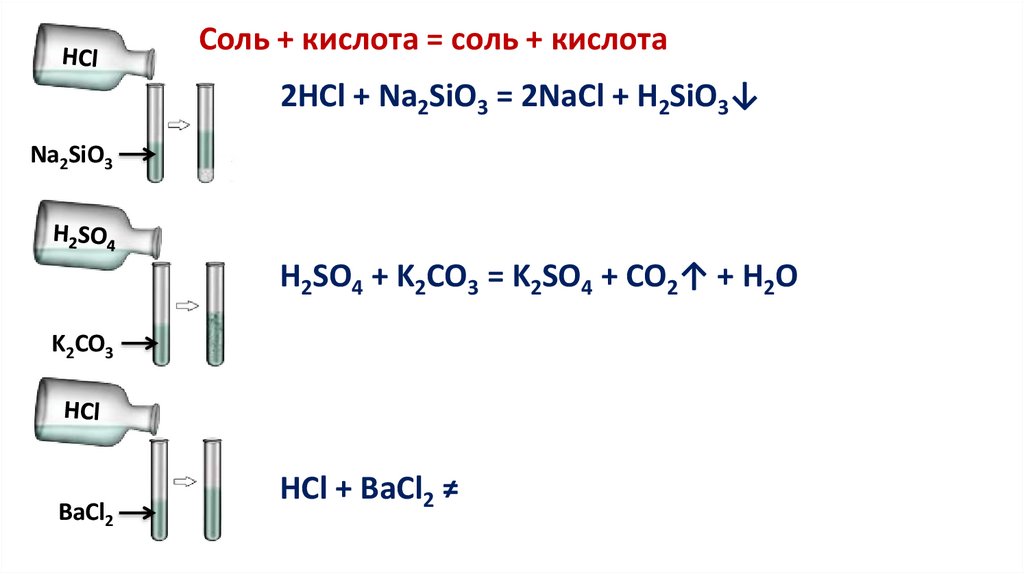
Соль + кислота = соль + кислота2HCl + Na2SiO3 = 2NaCl + H2SiO3↓
Na2SiO3
H2SO4 + K2CO3 = K2SO4 + CO2↑ + H2O
K2CO3
BaCl2
HCl + BaCl2 ≠
23.
Получение кислот1. Бескислородные кислоты получают синтезом
из простых веществ
H2 + Cl2 = 2HCl
Кислородсодержащие кислоты получают путем
взаимодействия кислотного оксида с водой
SO3 + H2O = H2SO4
2. Реакцией обмена получают кислоты из их солей
вытеснением более сильными кислотами
Ca3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4
24.
Домашнее задание1. Параграф 25, выучить свойства кислот
2. Упражнения №1, №2 и задача №3 (из
презентации)
Пишите в электронный журнал или на мою почту.
E-mail мой: ilina.irina71@mail.ru
25.
Домашнее заданиеУпр. 1. Допишите уравнения реакций:
А) Zn + HCl =
В) Ca(OH)2 + H3PO4 =
Б) CuO + H2SO4 =
Г) BaCl2 + H2SO4 =
Упр. 2. Напишите уравнения, с помощью которых можно
осуществить следующие превращения:
А) Cl2 → HCl→ AlCl3
Б) C → CO2 → Na2CO3 → CO2 → CaCO3 → CaO → Ca(OH)2 → Ca(NO3)2
Задача №3. В реакции между оксидом железа(III) и соляной
кислотой получен хлорид железа(III) массой 60,5 г. Рассчитайте
массу и количество вещества оксида, вступившего в реакцию.

















 Химия
Химия








