Похожие презентации:
Гидролиз. Качественное определение среды раствора
1.
Гидролиз2.
Для выражения кислотности илищёлочности среды пользуются водородным
показателем pH.
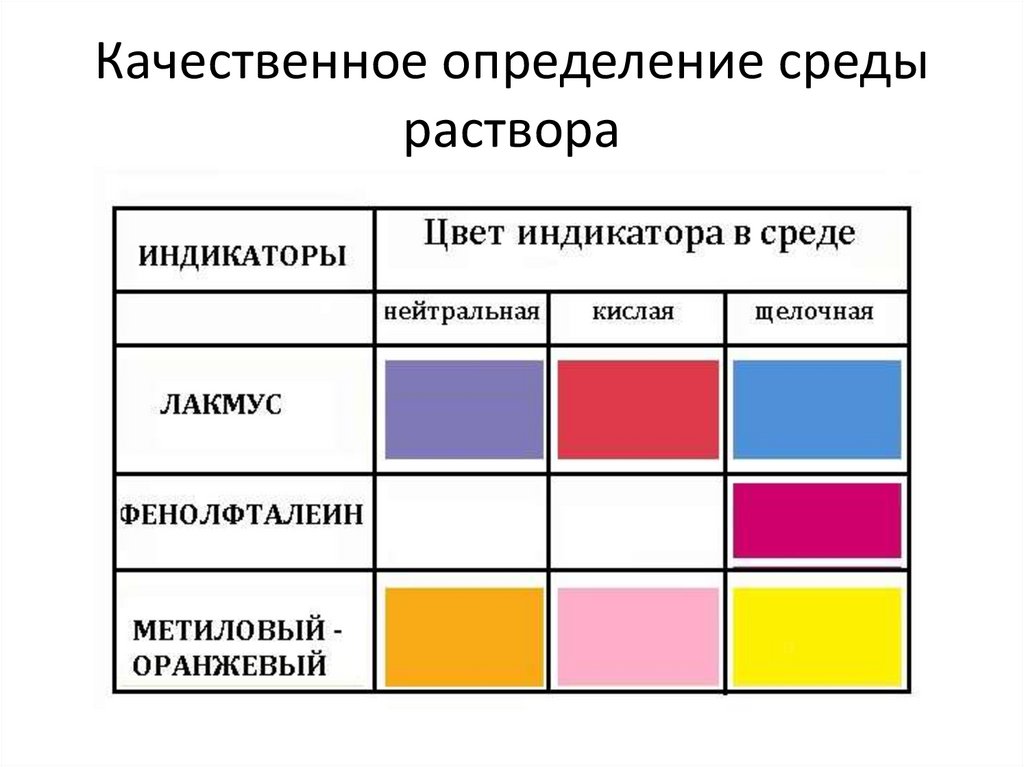
рН = 7 - среда нейтральная, т.к. [Н+] = [ ОН-]
рН > 7 - среда щёлочная, т.к. [Н+] < [ ОН-]
рН < 7 - среда кислая , т.к. [Н+] > [ ОН-]
3.
Качественное определение средыраствора
4.
Гидролиз солей – это взаимодействие ионовсоли с водой с образованием
малодиссоциирующих частиц.
5.
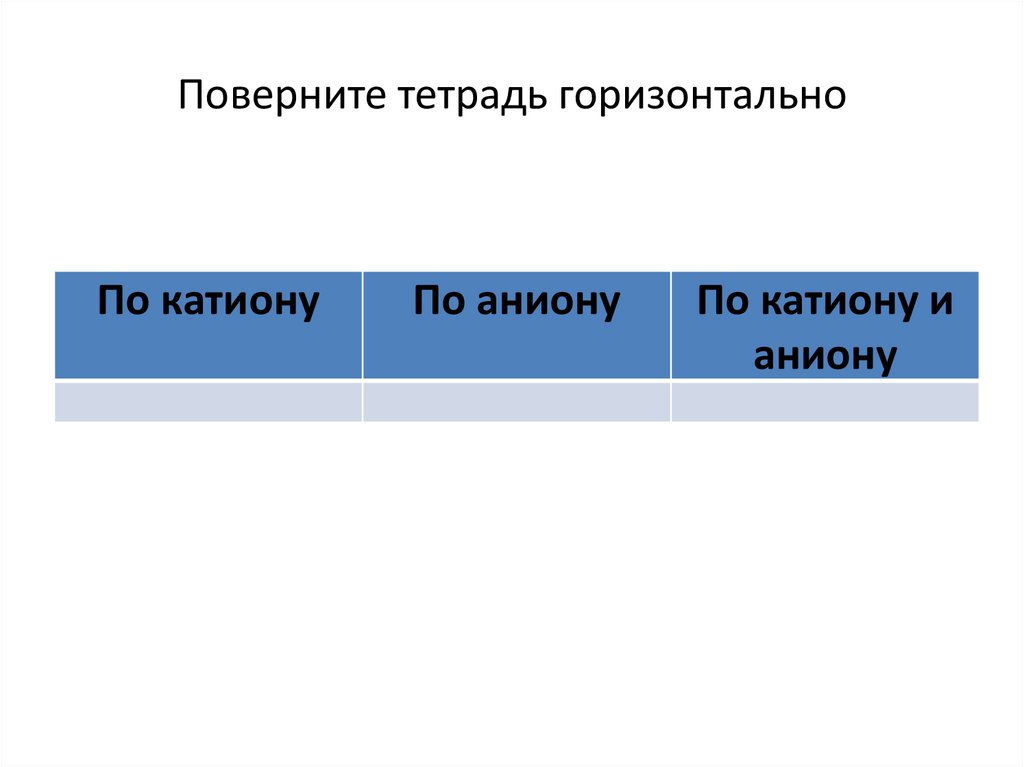
Поверните тетрадь горизонтальноПо катиону
По аниону
По катиону и
аниону
6.
Гидролиз по катионуСоль слабого основания и сильной кислоты.
Пример: FeCl3 → Fe3+ + 3ClFe(OH)3 – слабое основание
HCl – сильная ислота
Ионный вид: Fe3+ + HOH ↔ FeOH2+ + H+
Молекулярный вид: FeCl3 + HOH ↔ HCl + FeOHCl2
рН < 7, среда кислая
7.
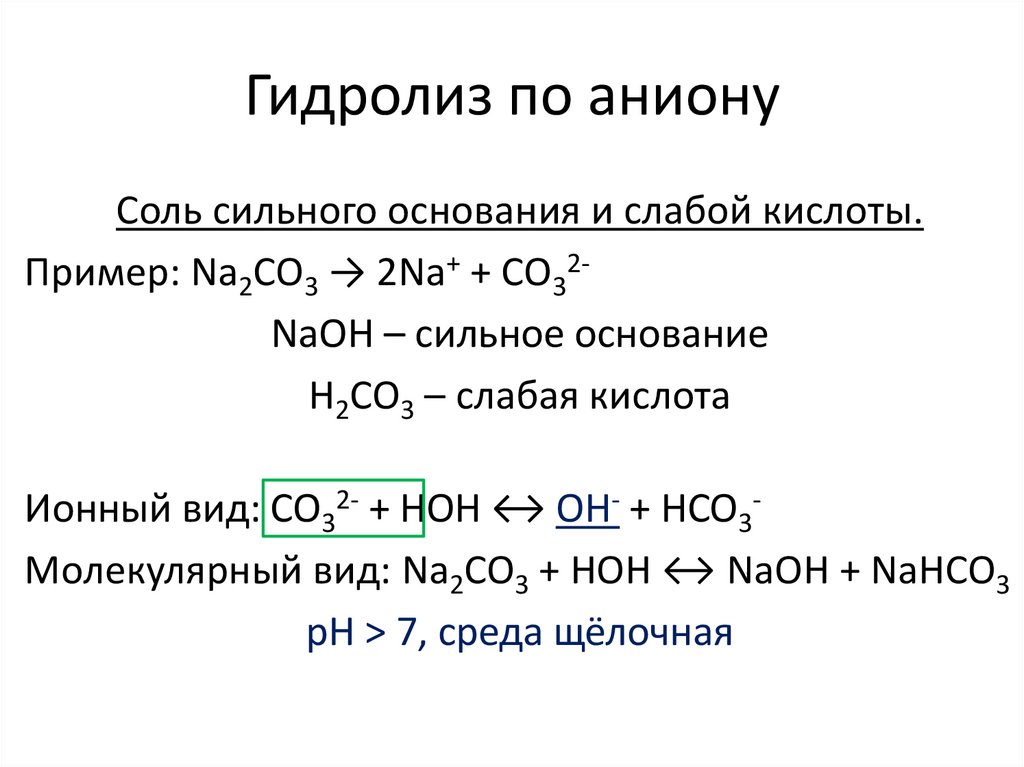
Гидролиз по анионуСоль сильного основания и слабой кислоты.
Пример: Na2CO3 → 2Na+ + CO32NaOH – сильное основание
H2CO3 – слабая кислота
Ионный вид: CO32- + HOH ↔ OH- + HCO3Молекулярный вид: Na2CO3 + HOH ↔ NaOH + NaHCO3
рН > 7, среда щёлочная
8.
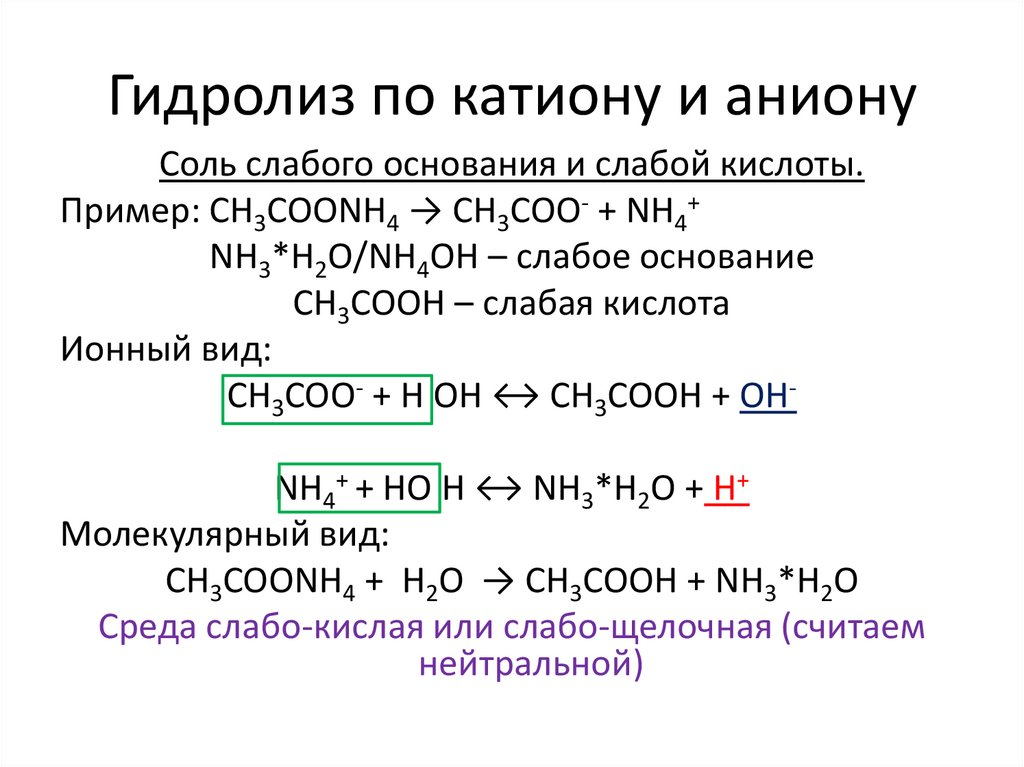
Гидролиз по катиону и анионуСоль слабого основания и слабой кислоты.
Пример: CH3COONH4 → CH3COO- + NH4+
NH3*H2O/NH4OH – слабое основание
CH3COOH – слабая кислота
Ионный вид:
CH3COO- + H OH ↔ CH3COOH + OHNH4+ + HO H ↔ NH3*H2O + H+
Молекулярный вид:
CH3COONH4 + H2O → CH3COOH + NH3*H2O
Среда слабо-кислая или слабо-щелочная (считаем
нейтральной)
9.
Задание 1Нейтральную среду имеет водный раствор:
А)NaNО3
Б) (NH4)2SO4
B) FeSO4
Г) CH3COONH4
10.
Задание 2Кислая среда будет в растворе:
А) ацетата натрия
Б) хлорида алюминия
В) фосфата натрия
Г) нитрата серебра
11.
Задание 3Установите соответствие между формулой соли и
средой ее водного раствора:
1)HCOOK
2)KCl
3)MnCl2
4)Na2SO3
БАВБ
A)нейтральная
Б)щелочная
В)кислотная
12.
Задание 5Укажите окраску лакмуса в растворах солей:
А) ZnSO4
1)фиолетовый
Б)RbNO3
2)красный
В)KF
3)синий
Г)Na2HPO4
2133
13.
Задание 6Установите соответствие между составом соли и
типом ее гидролиза:
1)CrCl2
A)по катиону
2)Cu(NO3)2
Б) по аниону
3) K3PO4
В) по катиону и аниону
4)Na2S
ААББ









 Химия
Химия








