Похожие презентации:
Гидролиз солей
1.
ГОУ ВПО «Донбасская Национальная академия строительства иархитектуры»,
кафедра «Прикладная химия»
Курс лекций по дисциплине «Химия»
для студентов 1 курса
Направление подготовки – 08.03.01 Строительство
Составил:
Ташкинов Ю.А.
Макеевка, 2019
1
2.
23.
34.
45.
56.
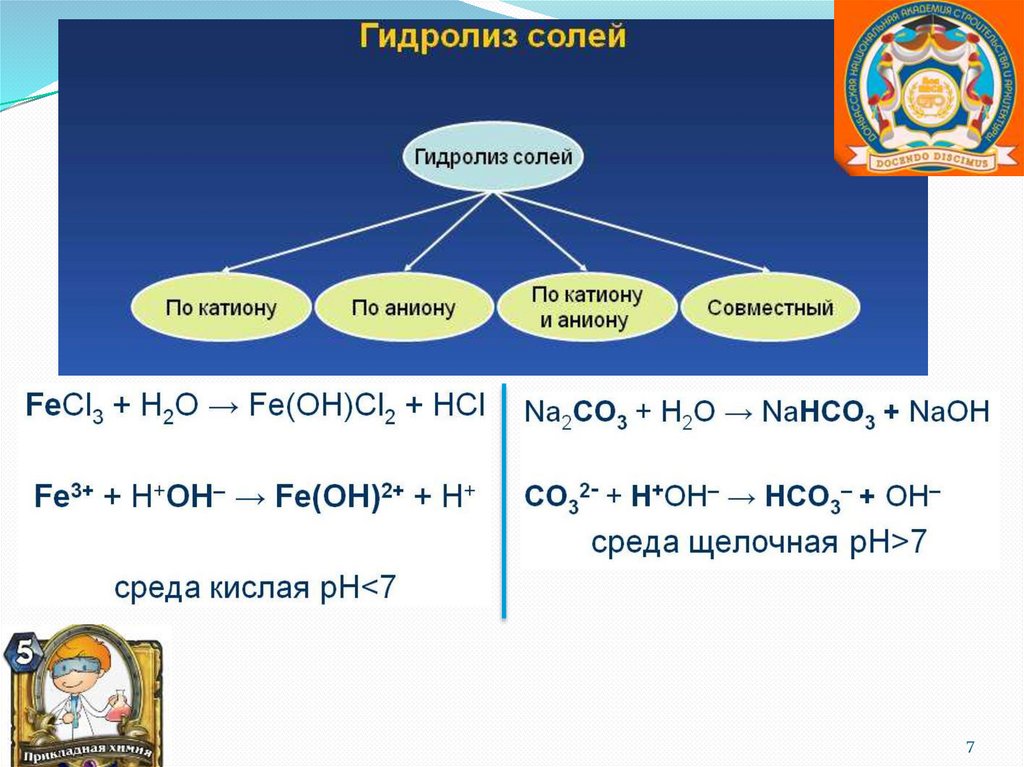
Гидролиз солей.Гидролиз – это реакция
обменного разложения веществ
водой.
Обратимый процесс
6
7.
78.
89.
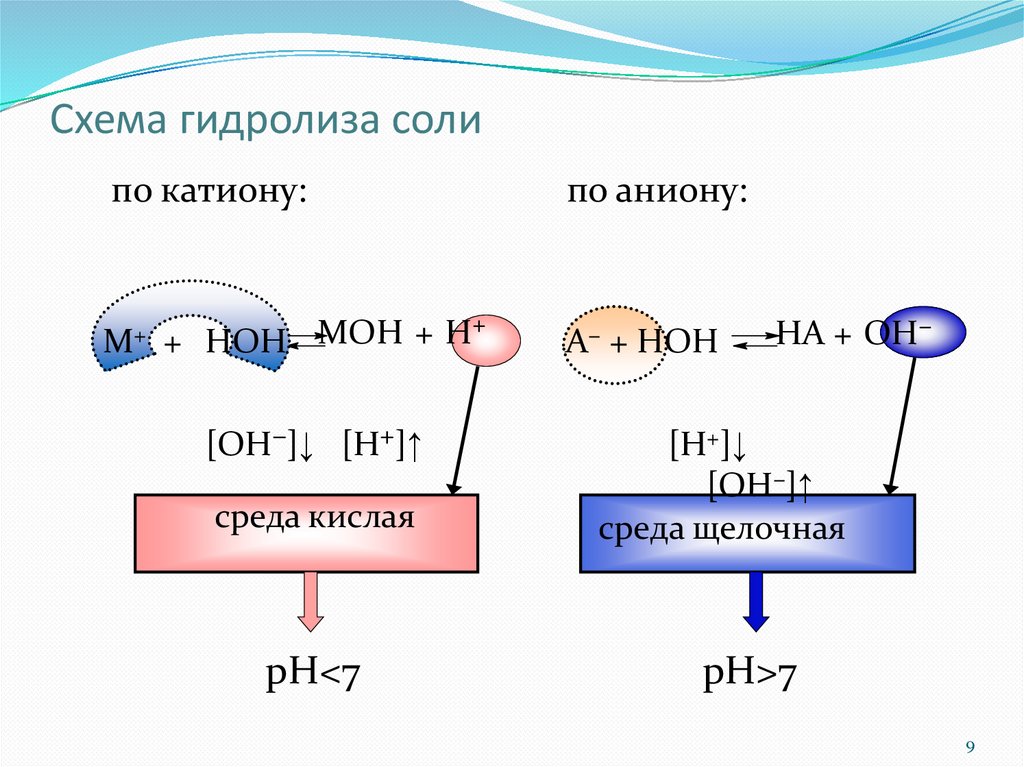
Схема гидролиза солипо катиону:
М+
+
MOH
+
H
+ НОН
[ОН−]↓ [H+]↑
среда кислая
pH<7
по аниону:
А−
+ НОН
HА + OH−
[H+]↓
[ОН−]↑
cреда щелочная
pH>7
9
10.
1011.
1112.
1213.
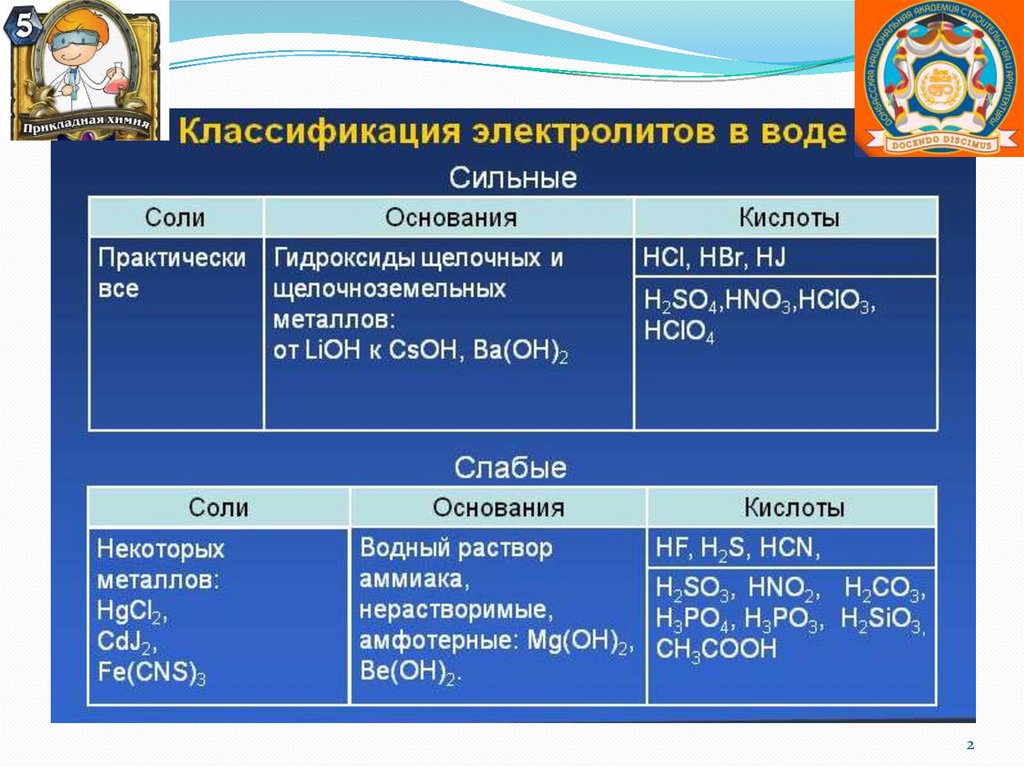
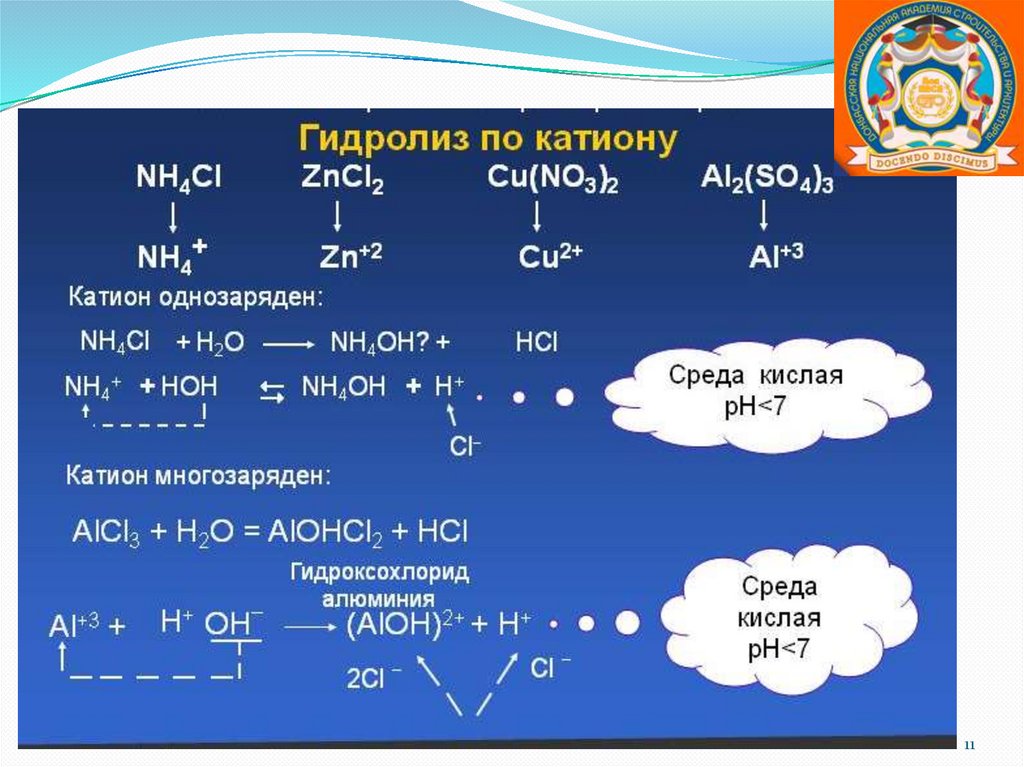
Соли, образованные слабой кислотой ислабым основанием.
Гидролиз по катиону и по аниону.
1.
2.
3.
Химическое равновесие смещено вправо.
Реакция среды или нейтральная, или
слабокислая, или слабощелочная, что
зависит от констант диссоциации кислоты и
основания.
Гидролиз может быть необратимым, если
хотя бы один из продуктов реакции
гидролиза уходит из сферы реакции.
13
14.
Гидролиз соли CH3COONH4Соль образована слабым основанием и слабой
одноосновной кислотой
CH3COONH4 = NH4+ + CH3COO
Уравнения гидролиза:
NH4+ + CH3COO + HOH
CH3COONH4 + H2O
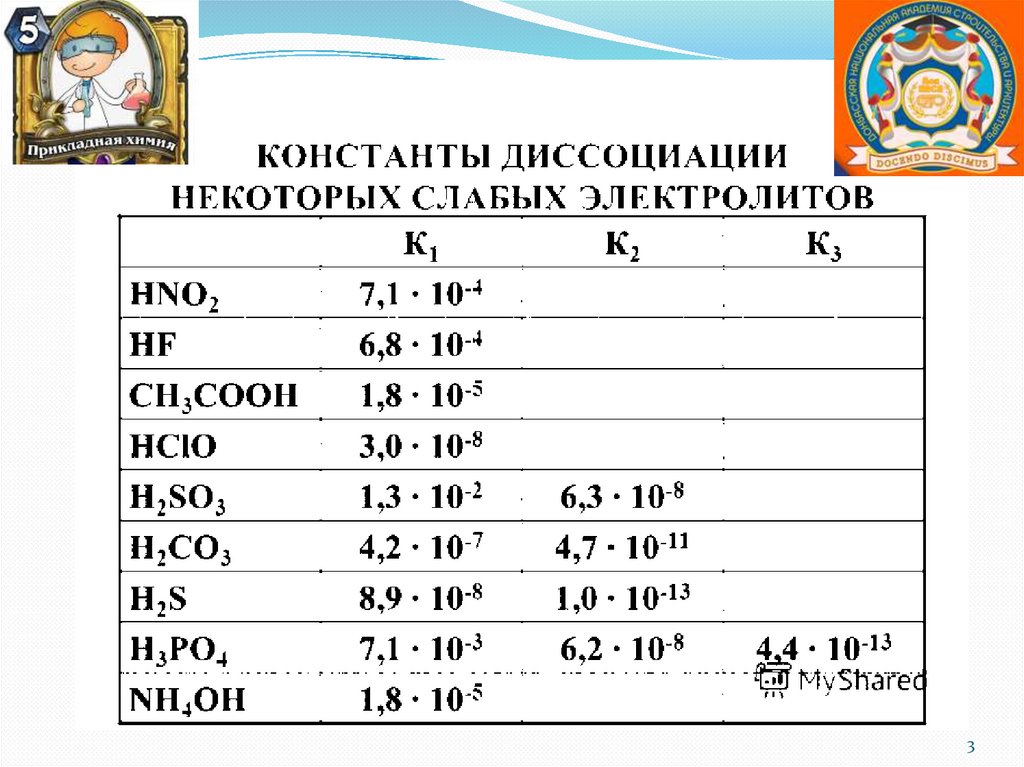
K CH3COOH 1,8 10 5
NH3 H2O+ CH3COOH
NH3 H2O+ CH3COOH
KNH3 H2O 1,8 10 5
Коснования = Ккислоты
среда нейтральная
14
15.
Гидролиз солей слабых кислот ислабых оснований
Соли слабого основания и слабой многоосновной кислоты в
растворе полностью гидролизованы
(NH4)2S + H2O
NH4HS +
NH4HS + HOH
NH3 H2O
+ H2 S
NH3 H2O
Соли слабых одноосновных кислот и слабых оснований при
гидролизе образуют осадки основных солей:
Al(CH3COO)3 + HOH
Al(OH)(CH3COO)2 + HOH
Al(OH)(CH3COO)2↓ + CH3COOH
Al(OH)2CH3COO↓ + CH3COOH
Гидролиз некоторых солей, образованных летучими или
малорастворимыми слабыми кислотами и слабыми основаниями
протекает необратимо:
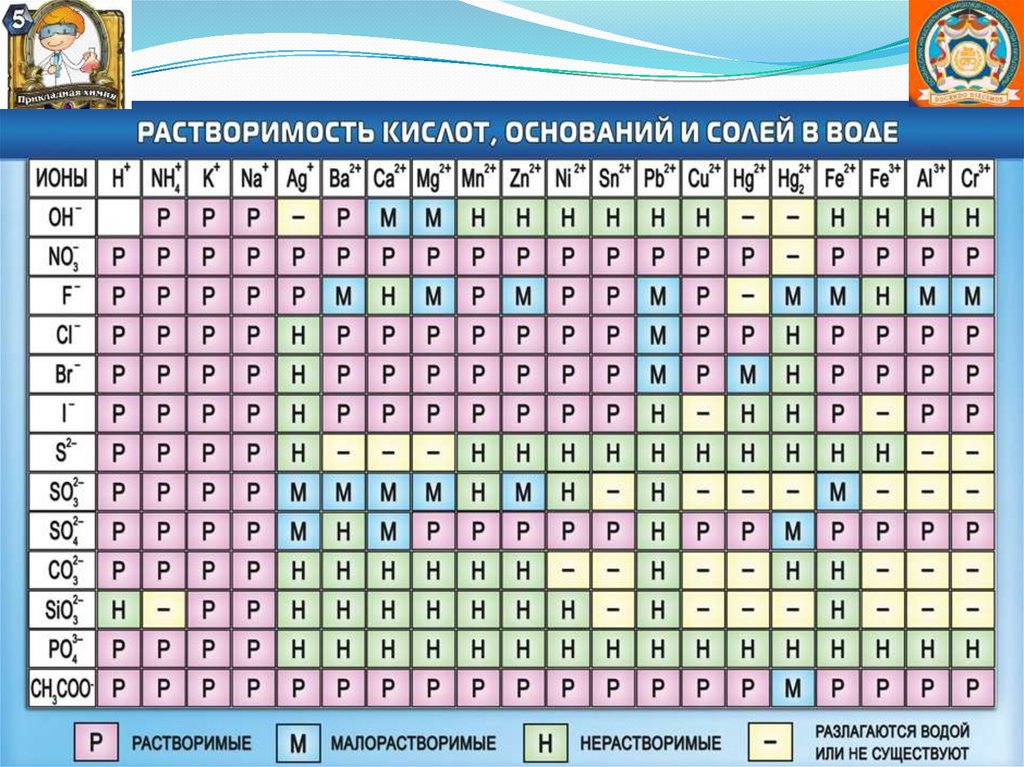
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Такие соли в водных растворах не существуют
15
16.
1617.
1.2.
3.
1.
2.
3.
Гидролиз можно усилить:
Добавить воды.
Нагреть раствор (увеличится диссоциация воды).
Связать один из продуктов гидролиза в
труднорастворимое соединение или удалить один из
продуктов в газовую фазу.
Гидролиз можно подавить.
Увеличить концентрацию растворённого вещества.
Охладить раствор.
Ввести в раствор один из продуктов гидролиза:
подкислять (если рН <7) или подщелачивать (если
рН>7).
17
18.
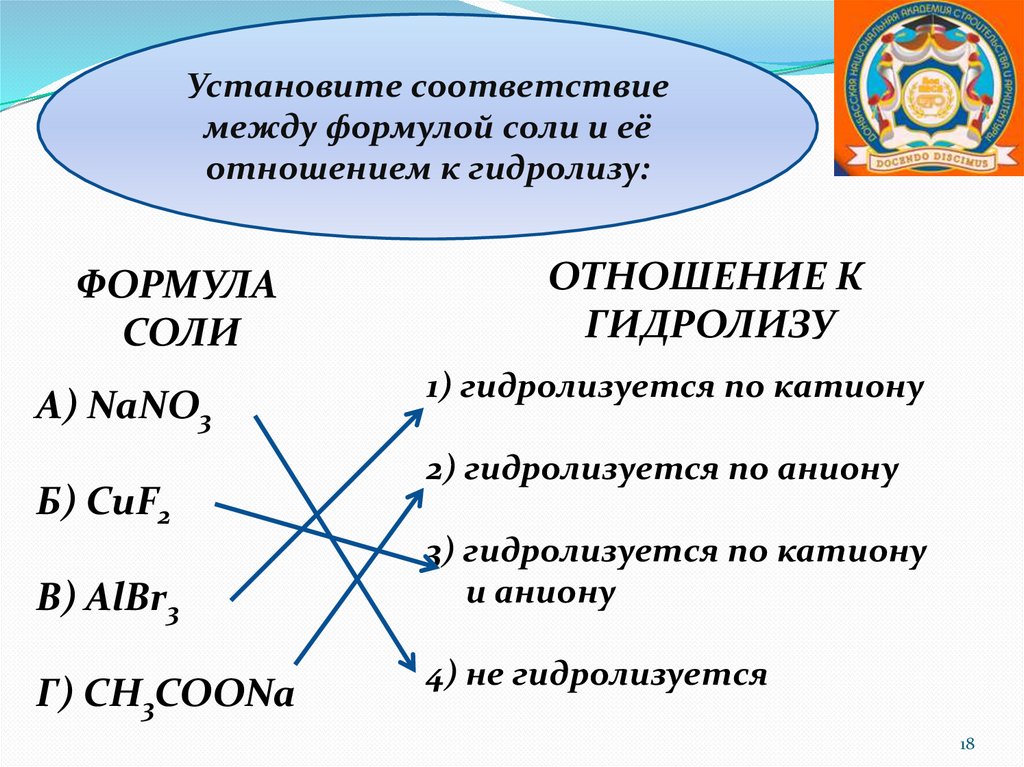
Установите соответствиемежду формулой соли и её
отношением к гидролизу:
ФОРМУЛА
СОЛИ
А) NaNO3
Б) CuF2
В) AlBr3
Г) CH3COONa
ОТНОШЕНИЕ К
ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется по катиону
и аниону
4) не гидролизуется
18
19.
Необратимый совместный гидролиз- с участием катионов Al3+, Fe3+, Cr3+, NH4+ и анионов
2
2 2
CO3 , SiO3 , S проходит с образованием слабого основания и
кислоты
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑+ 6NaCl
2Al3+ + 3S2 + 6H2O = 2Al(OH)3 + 3H2S
2NH4Cl + Na2SiO3 + (H2O) = 2NH3↑ + H2SiO3↓ + 2NaCl
2NH4+ + SiO32 + (H2O) = 2NH3 + H2SiO3
- солей слабых оснований типа M(OH)2 и солей угольной кислоты
проходит с образованием основных солей и угольной кислоты
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + CO2↑ + 2Na2SO4
2Cu2+ + 2CO32 + H2O = (CuOH)2CO3 + CO2
19
20.
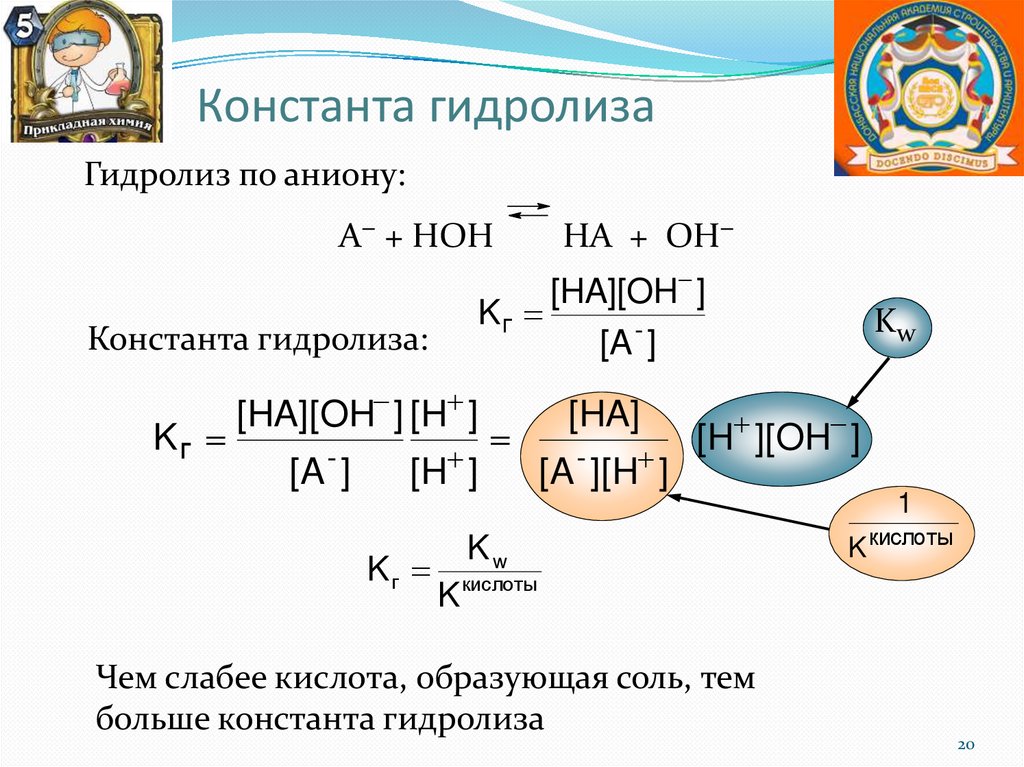
Константа гидролизаГидролиз по аниону:
А− + НОН
Константа гидролиза:
Kг
[HA][OH ]
Kг
[A - ]
[HA][OH ] [H ]
[A - ]
НА + ОН−
[H ]
[HA]
[A - ][H ]
Kw
[H ][OH ]
1
Kг
Kw
K кислоты
K кислоты
Чем слабее кислота, образующая соль, тем
больше константа гидролиза
20
21.
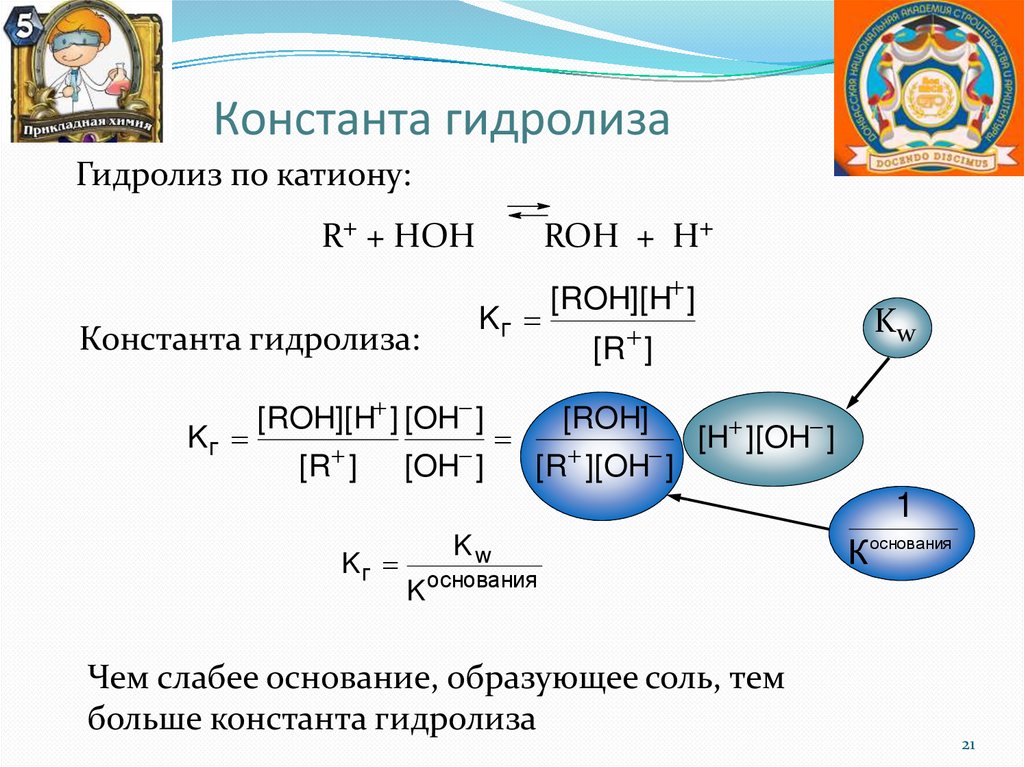
Константа гидролизаГидролиз по катиону:
R+ + НОН
Константа гидролиза:
Kг
ROН + Н+
Kг
[ROH][H ] [OH ]
[R ]
[OH ]
[ROH][H ]
Kw
[R ]
[ROH]
[R ][OH ]
[H ][OH ]
1
Kг
Kw
K основания
Чем слабее основание, образующее соль, тем
больше константа гидролиза
К основания
21
22.
Степень гидролиза соли отношение количества вещества (соли), подвергшегосягидролизу, к общему количеству растворенного вещества
Cгидр
h
С
Размерность – доли ед., %
При комнатной температуре степень гидролиза соли обычно
невелика:
Формула соли
Концентрация
раствора, моль/л
h,%
при 298 К (250С)
NH4Cl
Na2CO3
CН3СООNH4
0,01
0,1
0,1
0,01
2,7
0,5
22
23.
Расчет степени гидролиза CH3COONa в 0,1Мрастворе и pH раствора
Ионное уравнение гидролиза
СH3COO + HOH
СH3COOH + OH
Степень гидролиза
h
Kw
K CH3 COOH С
10 14
1,8 10 - 5 0,1
7,5 10 5
Концентрация ионов Н+ и рН
[OH ] hC 7,5 10 5 0,1 7,5 10 6 моль/л
[H ]
Kw
[OH ]
10 14
7,5 10 6
1,3 10 9 моль/л
pH lg(1,3 10 9 ) 8,9
23
24.
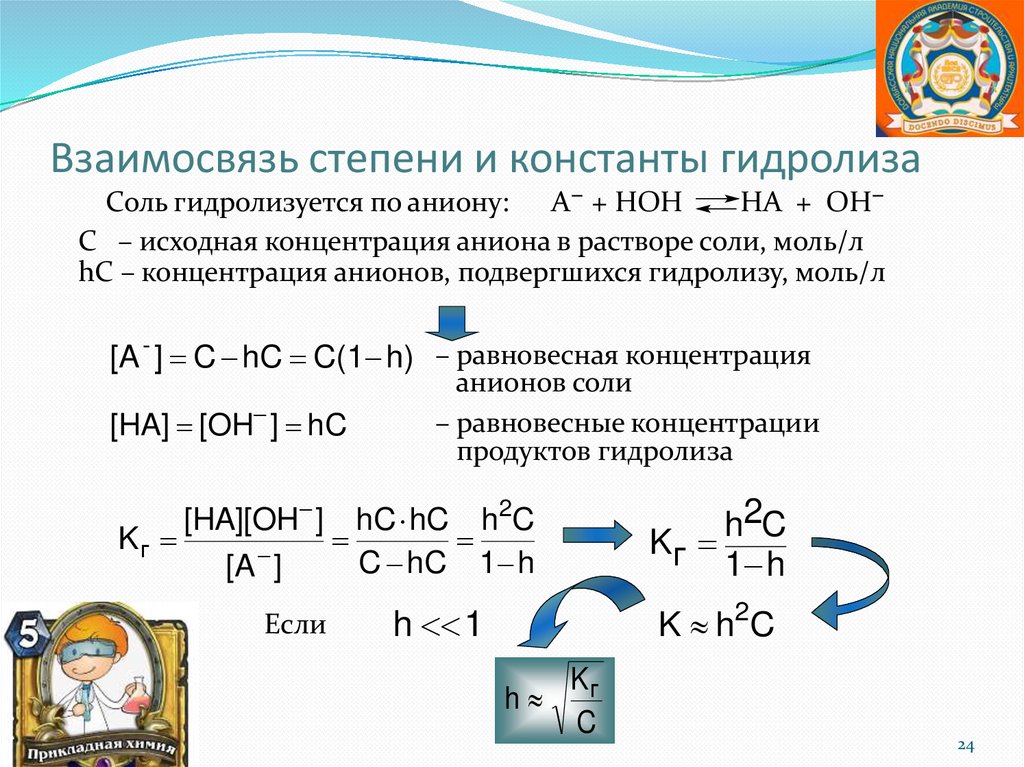
Взаимосвязь степени и константы гидролизаСоль гидролизуется по аниону: А− + НОН
НА + ОН−
С – исходная концентрация аниона в растворе соли, моль/л
hС – концентрация анионов, подвергшихся гидролизу, моль/л
[A - ] C hC C(1 h) – равновесная концентрация
[HA] [OH ] hC
анионов соли
– равновесные концентрации
продуктов гидролиза
[HA][OH ] hC hC h2C
Kг
C hC 1 h
[A ]
Если
h2C
Kг
1 h
h 1
K h 2C
h
Kг
C
24
25.
2526.
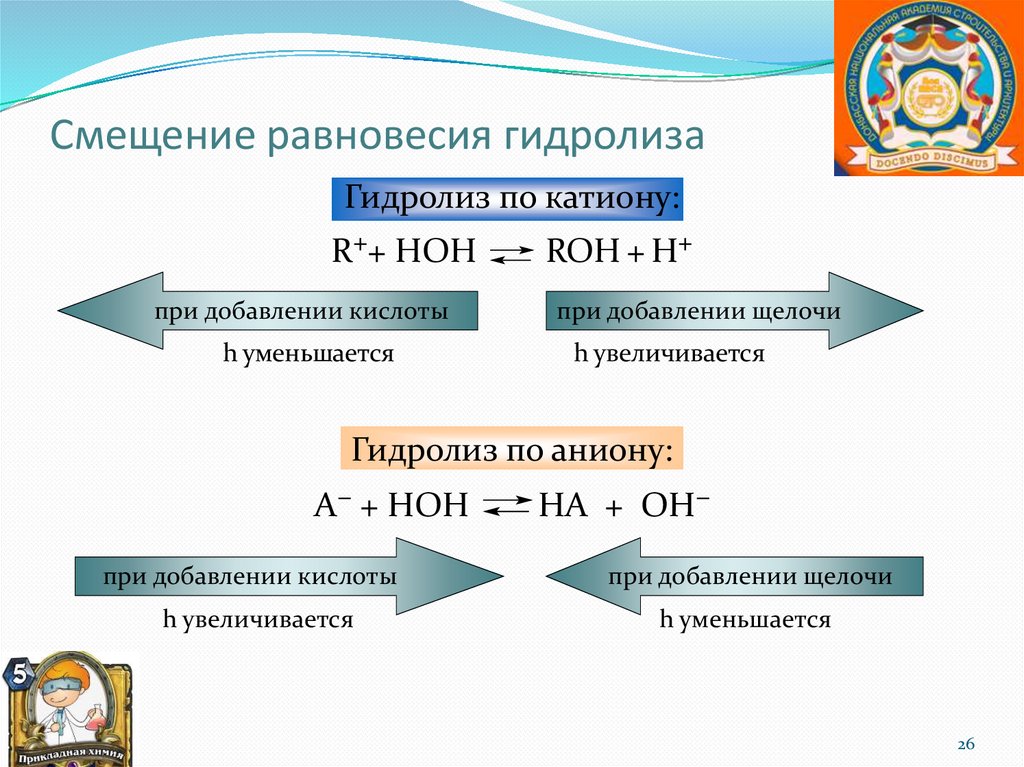
Смещение равновесия гидролизаГидролиз по катиону:
R++ HOH
при добавлении кислоты
h уменьшается
ROH + H+
при добавлении щелочи
h увеличивается
Гидролиз по аниону:
А− + НОН
при добавлении кислоты
h увеличивается
НА + ОН−
при добавлении щелочи
h уменьшается
26















 Химия
Химия








