Похожие презентации:
Спирты. Классификация спиртов
1.
Спирты• Классификация спиртов;
• Номенклатура;
• Изомерия;
• Строение молекул;
• Физические свойства;
• Химические свойства;
• Получение спиртов;
• Применение спиртов
2.
СпиртыСПИРТЫ – это производные углеводородов, содержащие
функциональную группу –OH
Предельные одноатомные спирты - это производные предельных углеводородов, в
молекулах которых один атом водорода замещен на гидроксильную группу
CnH2n+1OH n ≥ 1 или R-OH
R
3.
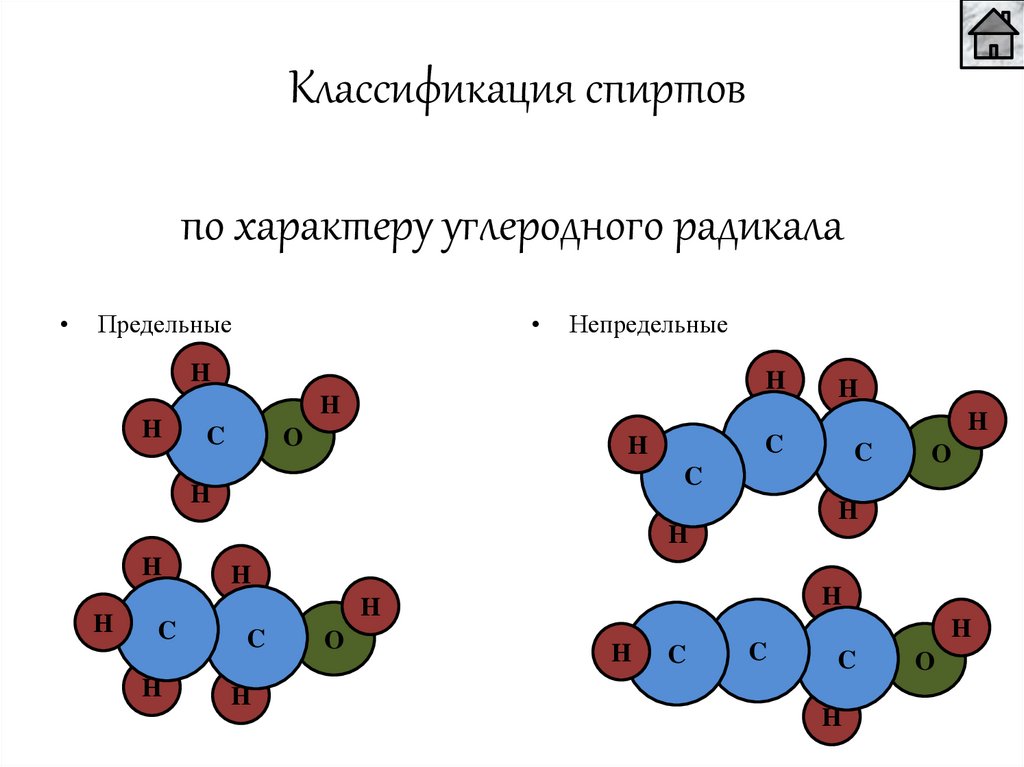
Классификация спиртовпо характеру углеродного радикала
Предельные
Непредельные
H
H
H
H
C
O
H
H
C
H
C
C
H
O
H
H
H
H
C
H
H
H
H
C
H
O
H
C
C
H
C
H
O
4.
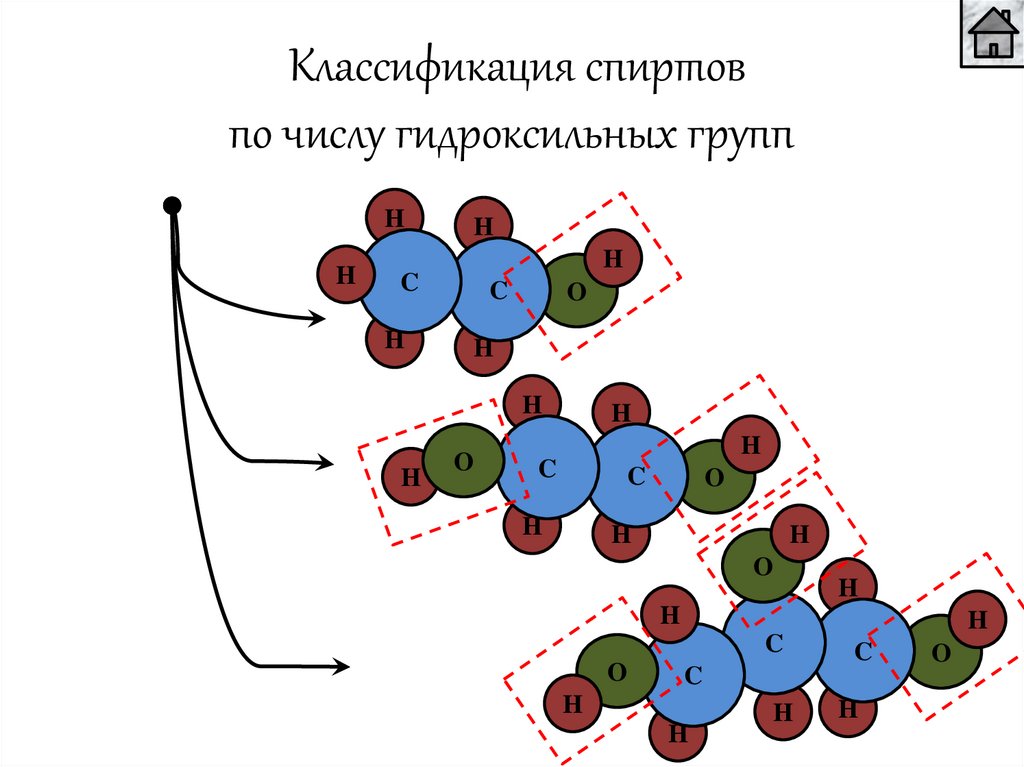
Классификация спиртовпо числу гидроксильных групп
H
H
H
H
C
C
H
O
H
H
H
O
H
H
C
C
H
O
H
H
O
H
H
C
O
H
C
C
H
H
H
H
O
5.
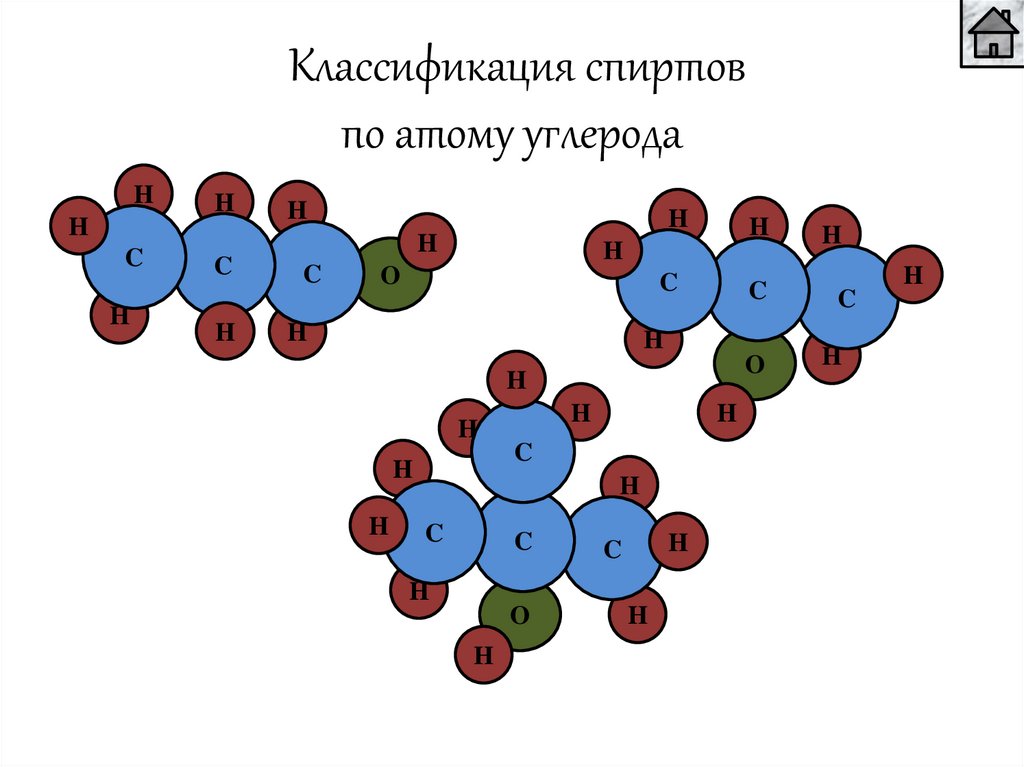
Классификация спиртовпо атому углерода
H
H
H
C
H
C
H
H
H
H
C
H
H
O
C
H
C
H
O
H
H
H
H
H
H
C
H
C
C
H
C
H
O
H
H
H
C
H
H
6.
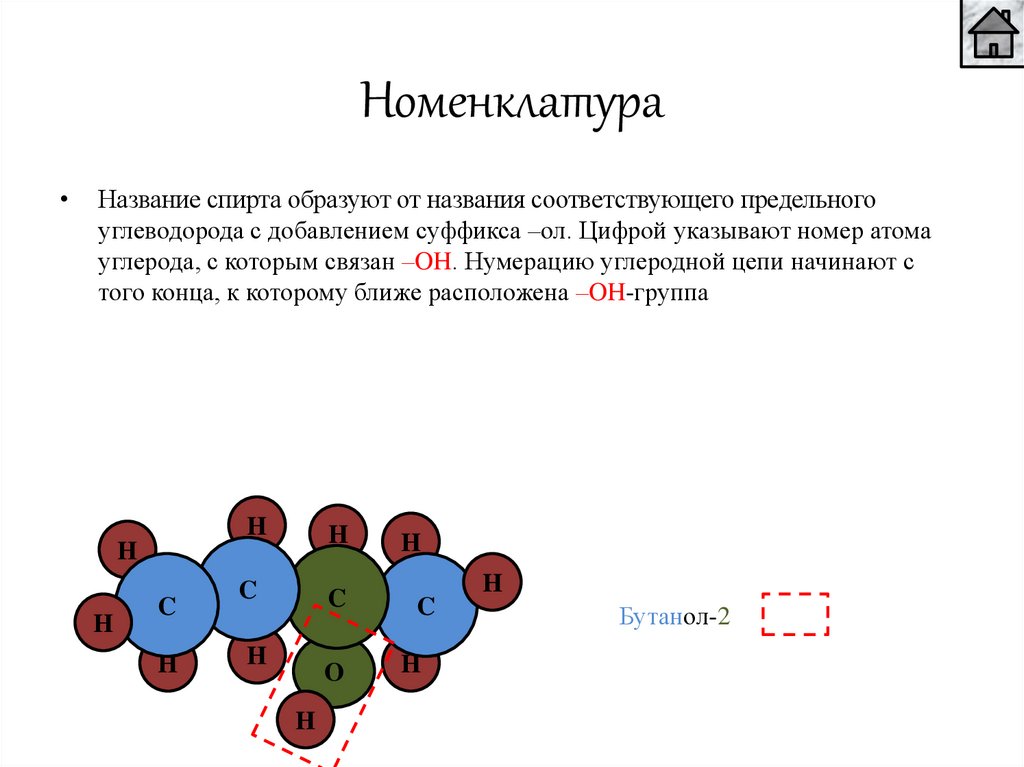
НоменклатураНазвание спирта образуют от названия соответствующего предельного
углеводорода с добавлением суффикса –ол. Цифрой указывают номер атома
углерода, с которым связан –OH. Нумерацию углеродной цепи начинают с
того конца, к которому ближе расположена –OH-группа
H
H
H
H
C
H
C
C
H
O
H
H
C
H
H
Бутанол-2
7.
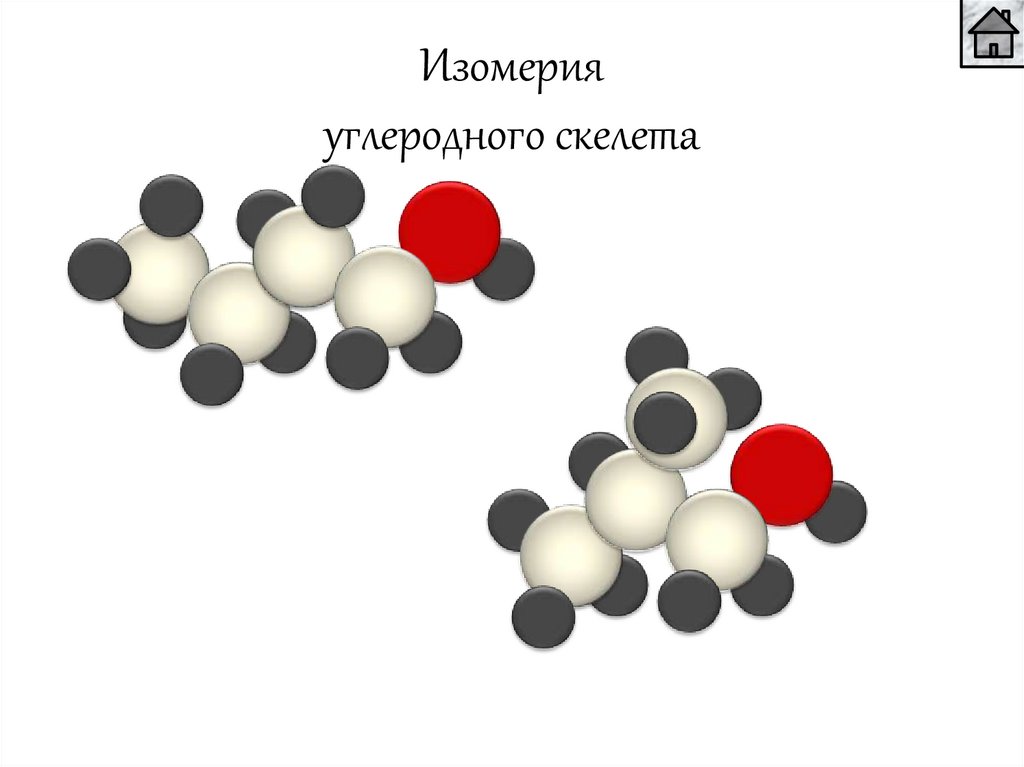
Изомерияуглеродного скелета
8.
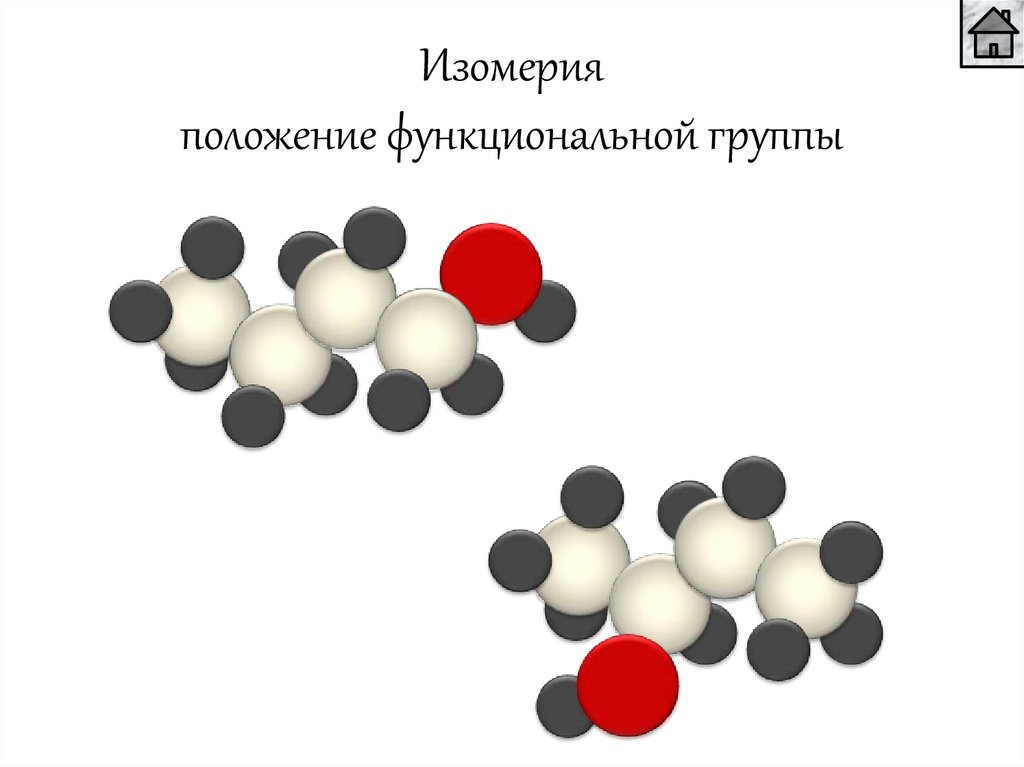
Изомерияположение функциональной группы
9.
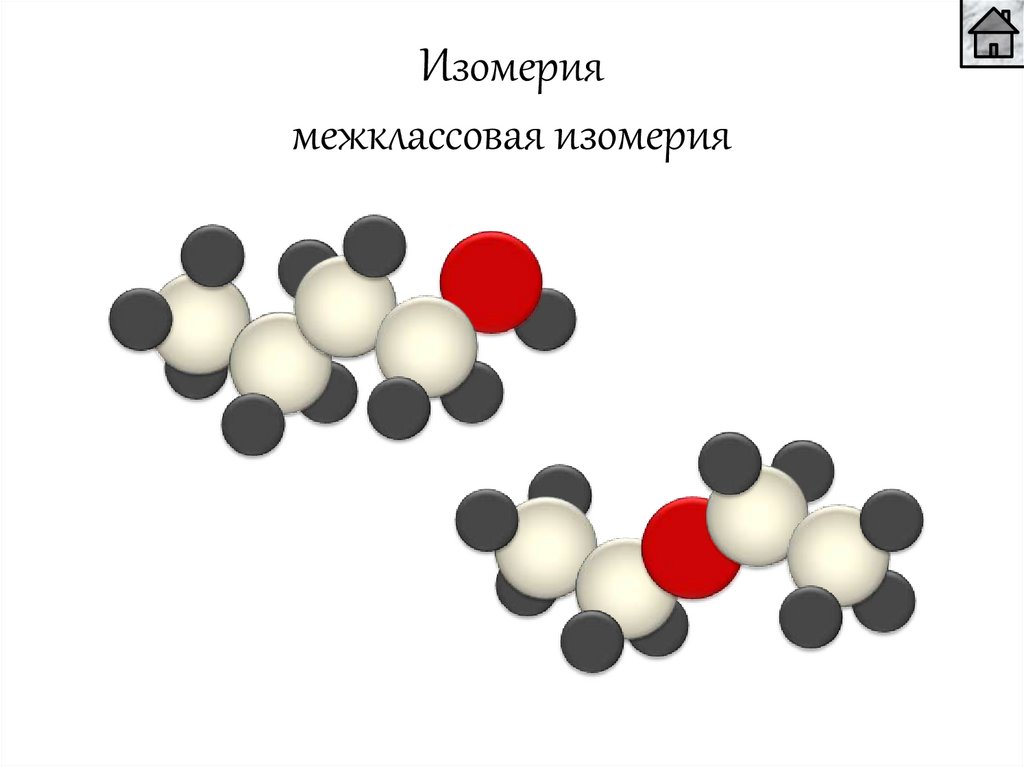
Изомериямежклассовая изомерия
10.
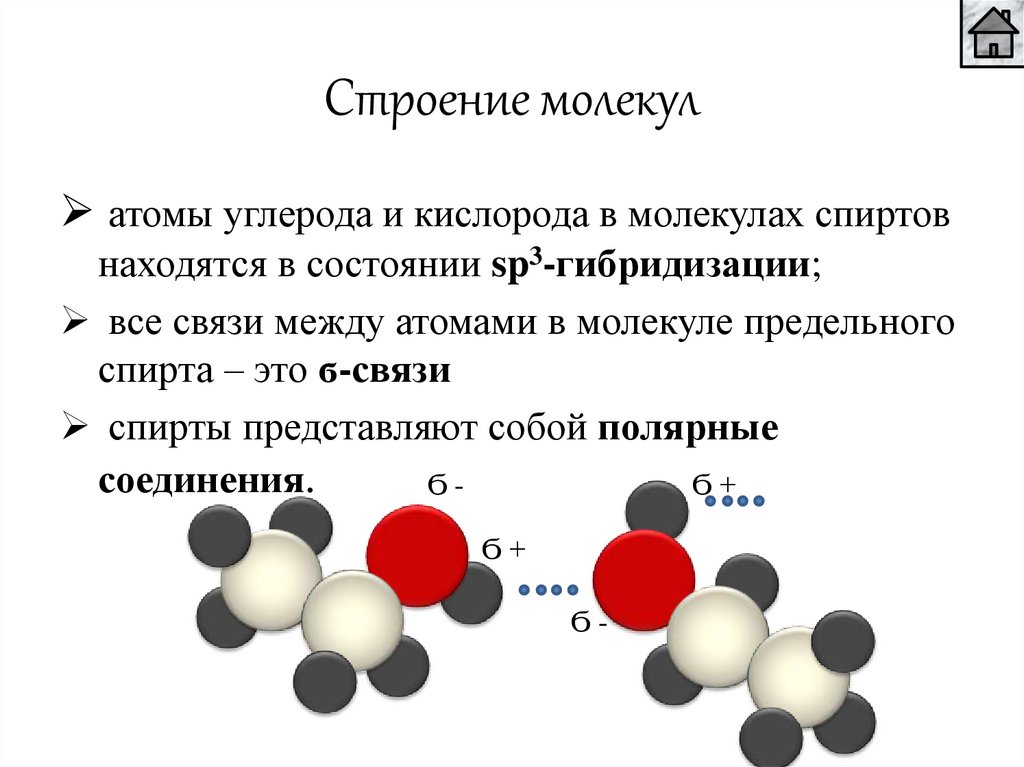
Строение молекулатомы углерода и кислорода в молекулах спиртов
находятся в состоянии sp3-гибридизации;
все связи между атомами в молекуле предельного
спирта – это ϭ-связи
спирты представляют собой полярные
соединения.
ϬϬ+
Ϭ+
Ϭ-
11.
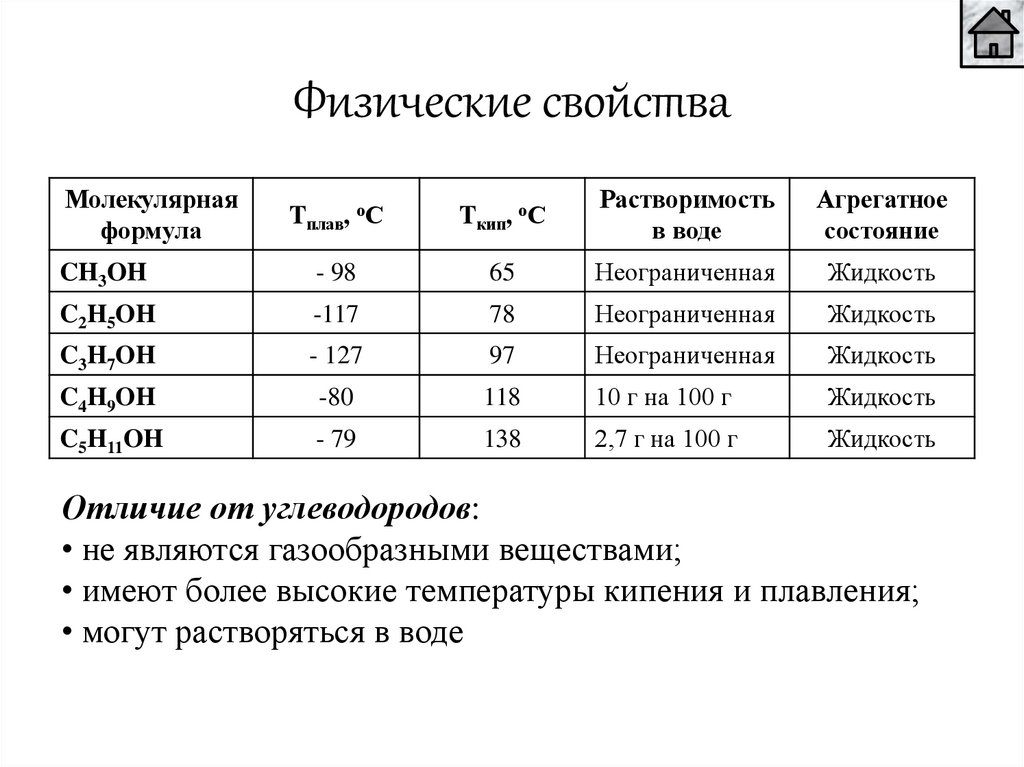
Физические свойстваМолекулярная
формула
Tплав, оС
Tкип, оС
Растворимость
в воде
Агрегатное
состояние
CH3OH
- 98
65
Неограниченная
Жидкость
C2H5OH
-117
78
Неограниченная
Жидкость
C3H7OH
- 127
97
Неограниченная
Жидкость
C4H9OH
-80
118
10 г на 100 г
Жидкость
C5H11OH
- 79
138
2,7 г на 100 г
Жидкость
Отличие от углеводородов:
• не являются газообразными веществами;
• имеют более высокие температуры кипения и плавления;
• могут растворяться в воде
12.
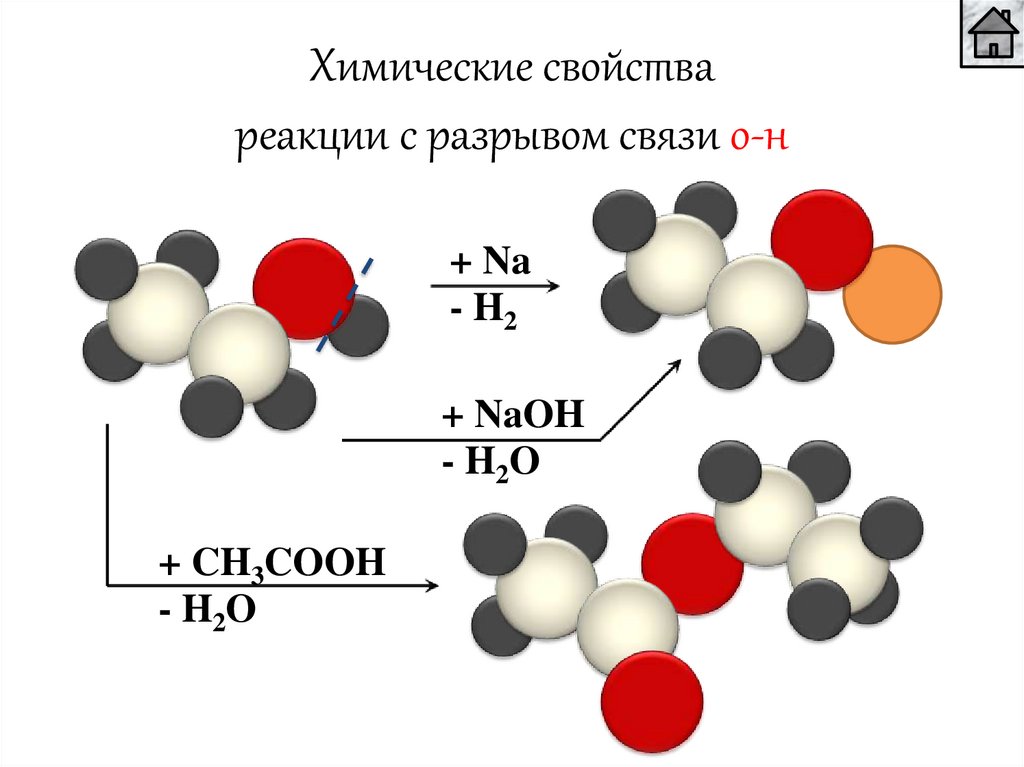
Химические свойствареакции с разрывом связи о-н
+ Na
- H2
+ NaOH
- H2O
+ CH3COOH
- H2O
13.
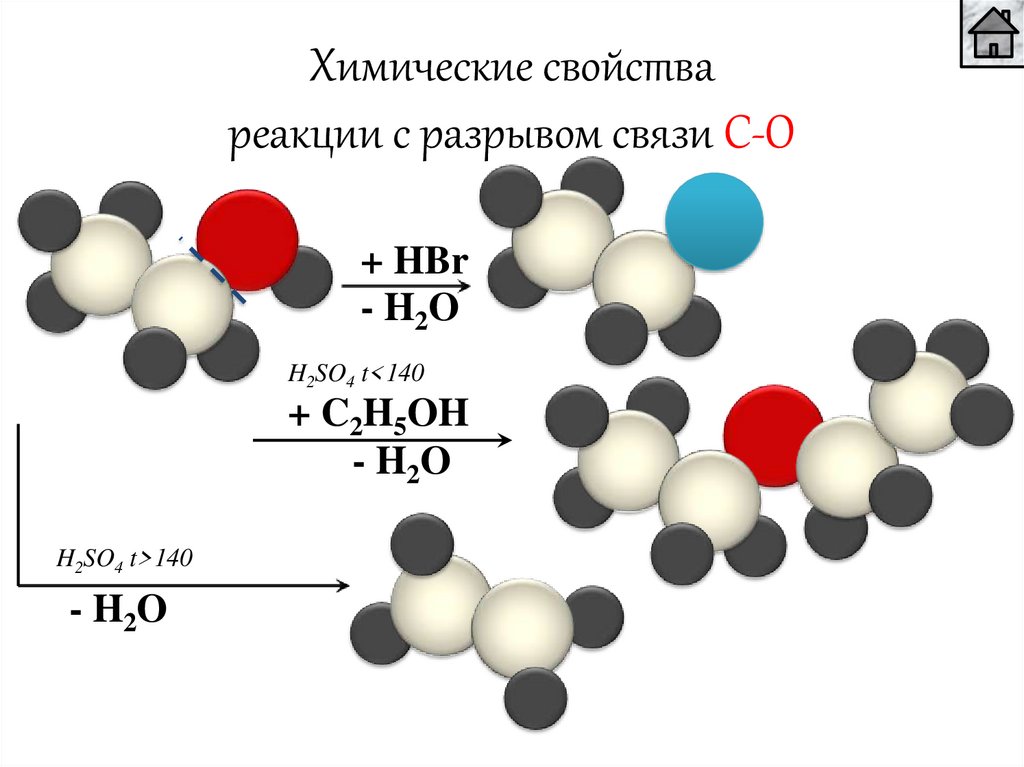
Химические свойствареакции с разрывом связи С-О
+ HBr
- H2O
H2SO4 t<140
+ C2H5OH
- H2O
H2SO4 t>140
- H2O
14.
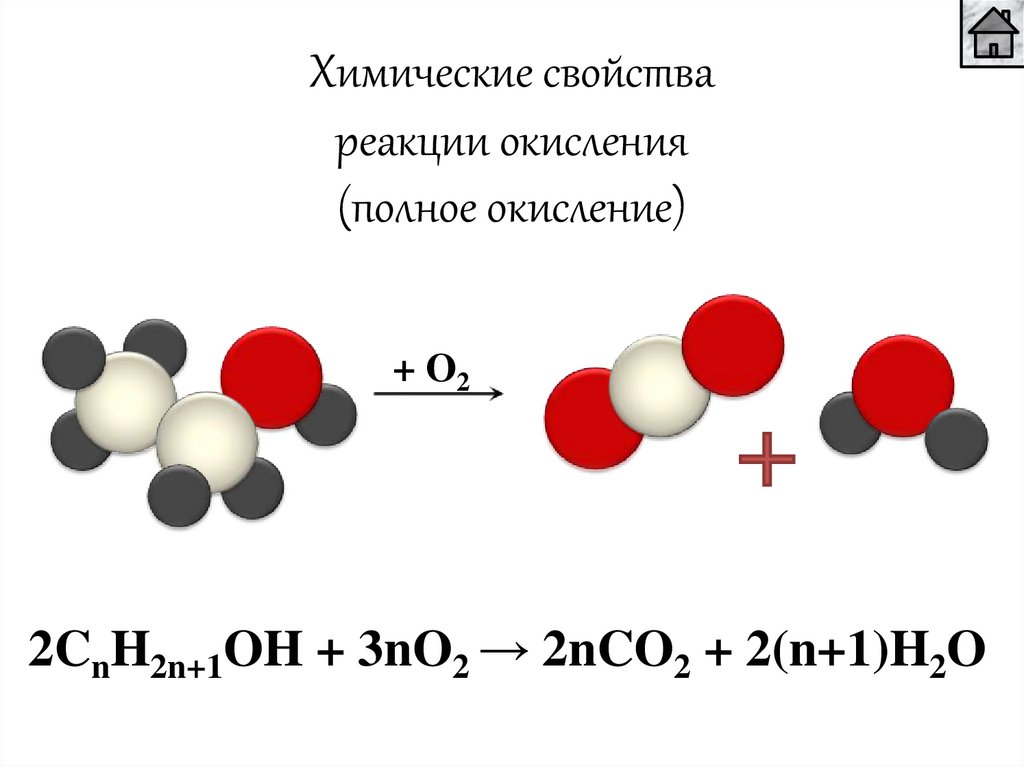
Химические свойствареакции окисления
(полное окисление)
+ O2
2CnH2n+1OH + 3nO2 → 2nCO2 + 2(n+1)H2O
15.
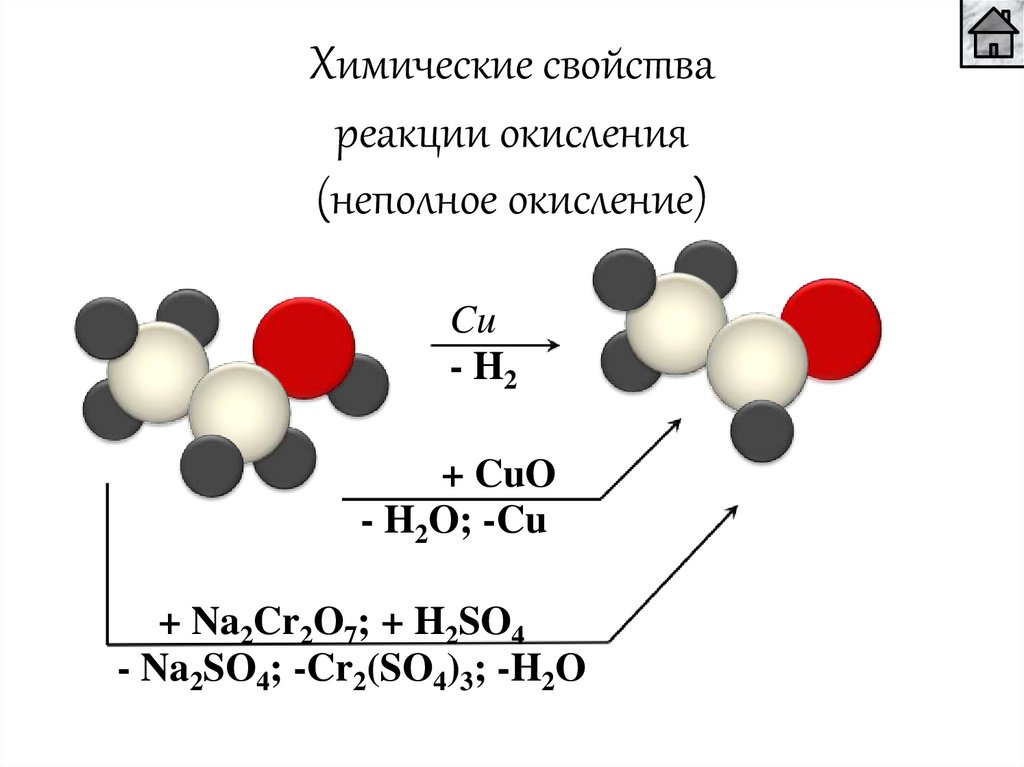
Химические свойствареакции окисления
(неполное окисление)
Cu
- H2
+ CuO
- H2O; -Cu
+ Na2Cr2O7; + H2SO4
- Na2SO4; -Cr2(SO4)3; -H2O
16.
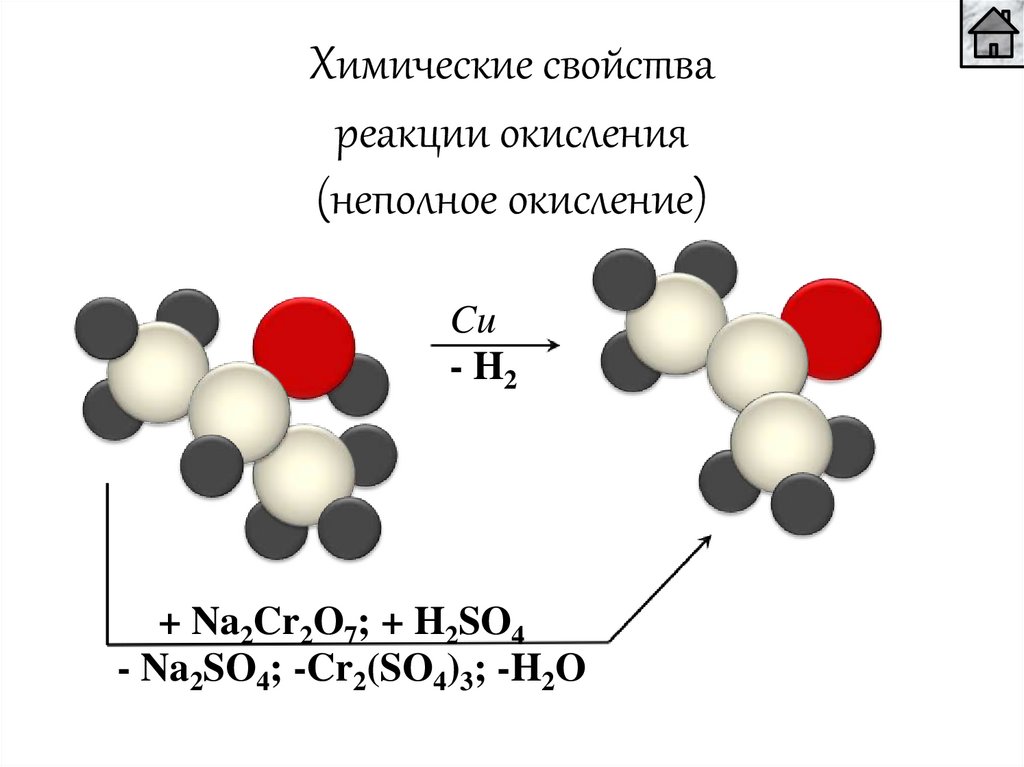
Химические свойствареакции окисления
(неполное окисление)
Cu
- H2
+ Na2Cr2O7; + H2SO4
- Na2SO4; -Cr2(SO4)3; -H2O
17.
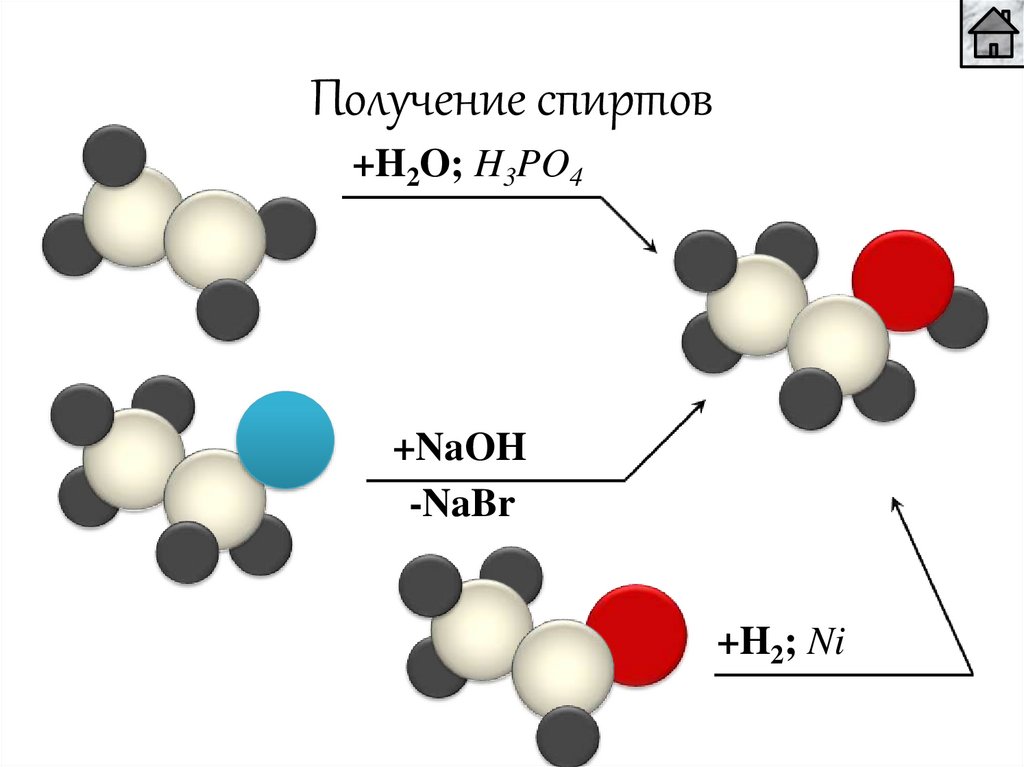
Получение спиртов+H2O; H3PO4
+NaOH
-NaBr
+H2; Ni
18.
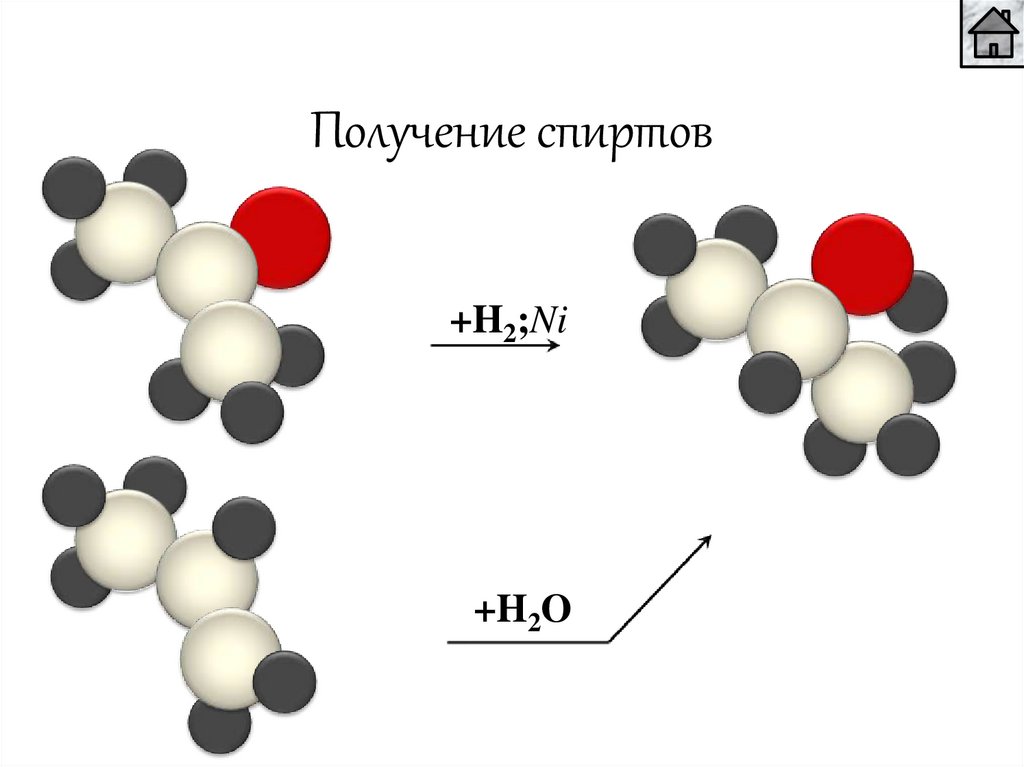
Получение спиртов+H2;Ni
+H2O



 Химия
Химия








