Похожие презентации:
Фенол (лекция в 10 кл.)
1. МОУ«Средняя общеобразовательная школа № 36»
ОНТема: Фенол
(лекция в 10 кл.)
2.
ОборудованиеОборудование: компьютер, проектор, экран, учебник.
Реактив: березовый деготь.
3. План лекции
1. Понятие о фенолах и ароматических спиртах.2. Строение молекулы фенола.
3. Физические свойства фенола.
4. Химические свойства фенола.
5. Получение и применение.
4. Цель лекции
1. Дать понятие о фенолах. Познакомить со строением,свойствами, применением фенола.
2.Уметь доказывать взаимное влияние атомов в молекуле
фенола и подтверждать соответствующими уравнениями
реакций.
3. Уметь определять фенол по характерным реакциям. Иметь
представления об окружающей среды от промышленных
отходов, содержащих фенол.
4. Продолжить формирование знаний о генетической связи
между различными органическими веществами ( УВ и
спиртами).
5. Понятие о фенолах
Фенолы - это органические вещества, в составе которыхприсутствуют бензольные кольца, непосредственно связанные с
одной или несколькими гидроксильными группами.
ОН
Пирокатехин
ОН
ОН
ОН
Фенол
НО
ОН
Флороглюцин
6. Классификация фенолов
7. Строение фенола
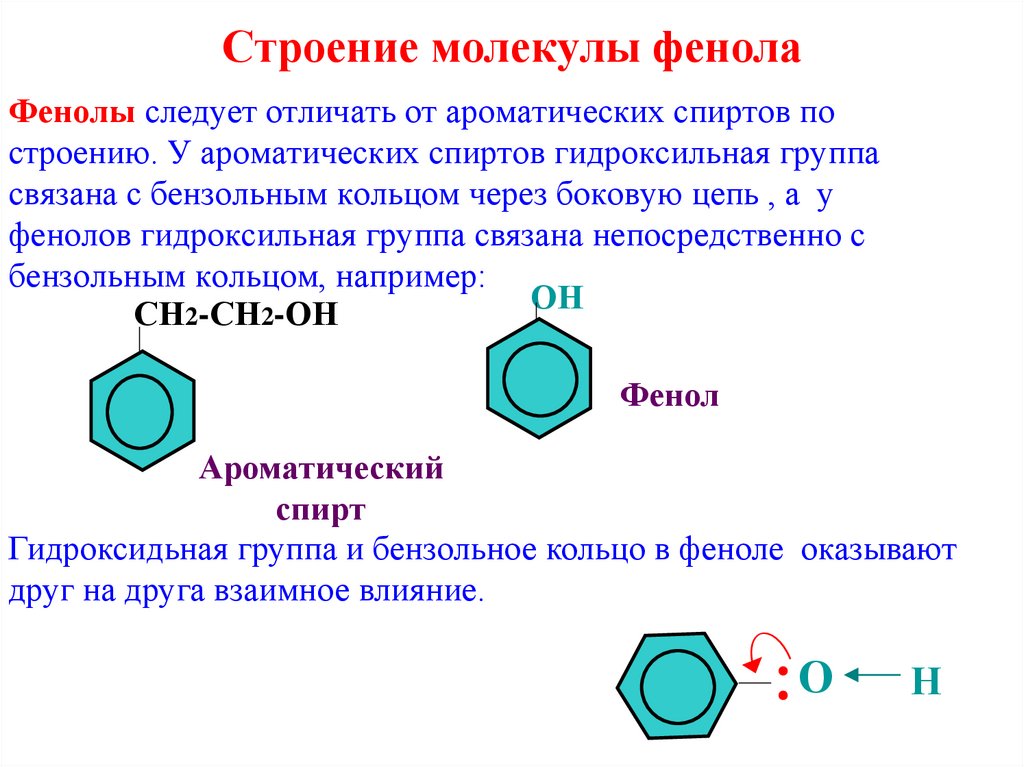
8. Строение молекулы фенола
Фенолы следует отличать от ароматических спиртов построению. У ароматических спиртов гидроксильная группа
связана с бензольным кольцом через боковую цепь , а у
фенолов гидроксильная группа связана непосредственно с
бензольным кольцом, например:
ОН
СН2-СН2-ОН
Фенол
Ароматический
спирт
Гидроксидьная группа и бензольное кольцо в феноле оказывают
друг на друга взаимное влияние.
О
Н
9.
Суть влияния заключается в том, что неподеленная электроннаяпара атома кислорода вступает во взаимодействие
(сопряжение) с ароматической системой. Таким образом,
гидроксильный радикал в молекуле приводит к изменению пиоблака бензольного кольца, увеличению электронной
плотности у 2,4, и 6-го атомов углерода (орто- и параположения).
Бензольное ядро, в свою очередь
оказывает влияние на подвижность
водорода гидроксильной группы,
О Н Атом кислорода, потеряв за счет
сопряжения часть электронной
6
2
плотности, стремиться ее
компенсировать за счет
4
дополнительной поляризации связи
O-H. Поэтому фенол проявляет
более сильные кислотные свойства
по сравнению со спиртами.
10. Физические свойства фенола
Фенол (С6Н5ОН) - кристаллическое бесцветное вещество схарактерным резким запахом, розовеет на воздухе из за окисления.
Фенол ядовит! При попадание на кожу он вызывает ожоги,
поэтому с фенолом необходимо обращаться осторожно. Водный
раствор фенола называют карболовой кислотой.
фильм № 1
Фенол и его производные обладают
способностью убивать микроорганизмы.
Благодаря этому их применяют как
дезинфицирующие и антисептические
средства. Н - р,0,5-3% водным растворами
фенола дезинфицируют хирургические
инструменты.
11. Химические свойства фенола
1) Полное окисление (горение)-свойство, доказывающее составданного вещества С6Н5ОН + О2
?+?
2) Свойство, сходное с одноатомными спиртами,- взаимодействие
с металлическим натрием (р -я замещения)
2С6Н5ОН + 2Na
2С6Н5ОNa + Н2
Техника безопасности.
Соблюдать правила работы
фенол
фенолят
с ядовитыми веществами.
Фенол вызывает ожог
кожи. Не допускать
попадания фенола на кожу.
Соблюдать правила работы
со щелочными металлами.
12.
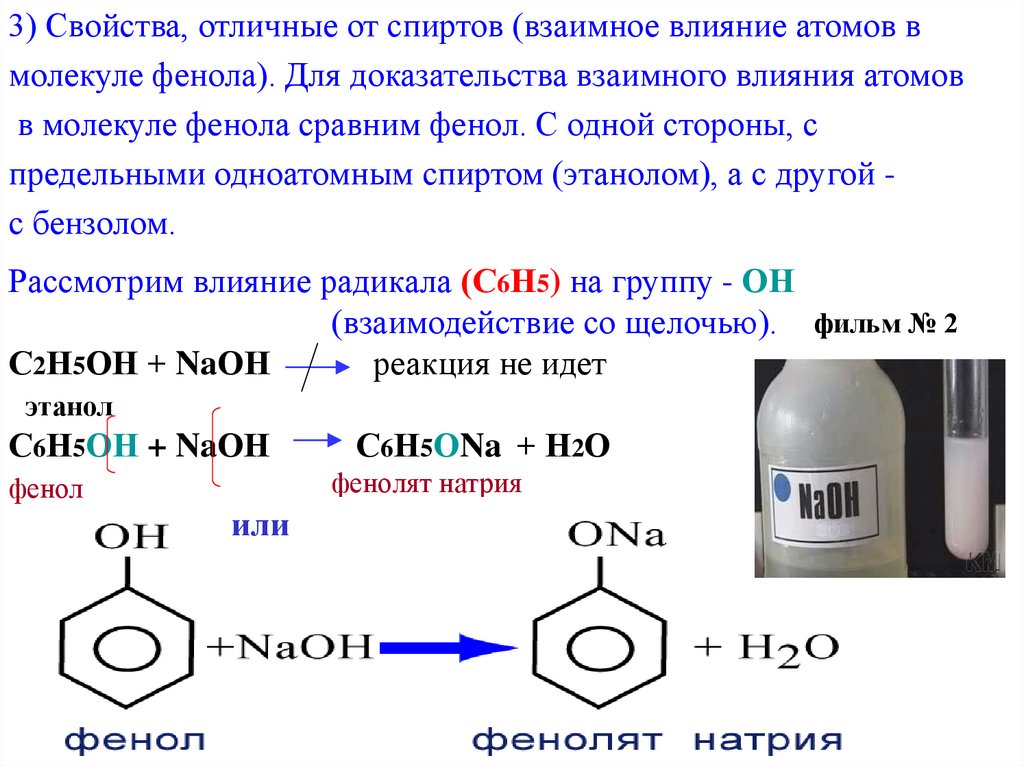
3) Свойства, отличные от спиртов (взаимное влияние атомов вмолекуле фенола). Для доказательства взаимного влияния атомов
в молекуле фенола сравним фенол. С одной стороны, с
предельными одноатомным спиртом (этанолом), а с другой с бензолом.
Рассмотрим влияние радикала (С6Н5) на группу - ОН
(взаимодействие со щелочью). фильм № 2
С2Н5ОН + NaОН
реакция не идет
этанол
С6Н5ОН + NaОН
С6Н5ОNa + Н2О
фенолят натрия
фенол
или
13.
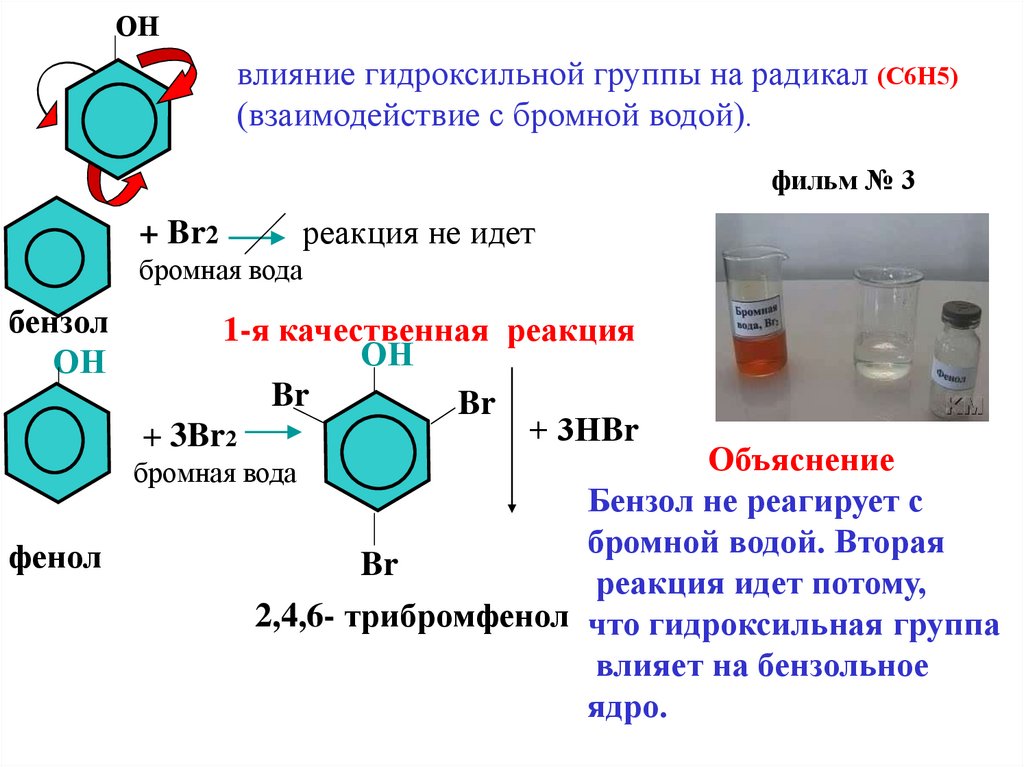
ОНвлияние гидроксильной группы на радикал (С6Н5)
(взаимодействие с бромной водой).
фильм № 3
реакция не идет
+ Br2
бромная вода
бензол
ОН
1-я качественная реакция
ОН
Br
Br
+ 3НBr
+ 3Br2
Объяснение
Бензол не реагирует с
бромной водой. Вторая
Br
реакция идет потому,
2,4,6- трибромфенол что гидроксильная группа
влияет на бензольное
ядро.
бромная вода
фенол
14.
Реакция нитрованияН
(взаимодействие фенола с азотной кислотой).
ОН
ОН
Н
NO2
NO2
+ 3НО -NO2
+ 3Н2О
Н
Под воздействием гидроксильной группы NO2
в молекуле фенола у 2, 4 и 6 атомов
углерода (орто- и пара- положения)
электронная плотность возрастает, а у 3 и 5
атомов углерода (мета- положения)
электронная плотность уменьшается. В
ходе реакции нитрования фенола
концентрированной азотной кислотой
нитрогруппы легко встраиваются в
положениях 2, 4 и 6 (орто- и параположения), получается 2,4,6тринитрофенол.
2,4,6- тринитрофенол или
пикриновая кислота взрывчатое вещество.
15. Качественная реакция на фенол
Качественной реакцией на фенол является взаимодействиефенола с хлоридом железа (III) с образованием яркого синефиолетового или темно- фиолетового цвета комплексного
2- я качественная реакция
соединения.
фильм № 4
3С6Н5ОН + FeCl3
(C6H5O)3Fe + 3HCl
Фенолят железа (III) - темно- фиолетового цвета
16. Реакция поликонденсации
Поликонденсация фенола с формальдегидом происходит собразованием фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:
ОН
ОН
СН2
n
+n
ОН
СН2
….
….
метанал
ь
СН2
СН2
СН2
СН2
….
СН2ОН
фенолформальдегидная смола
ОН
ОН
17. Реакция гидрирования
18. Получение фенола
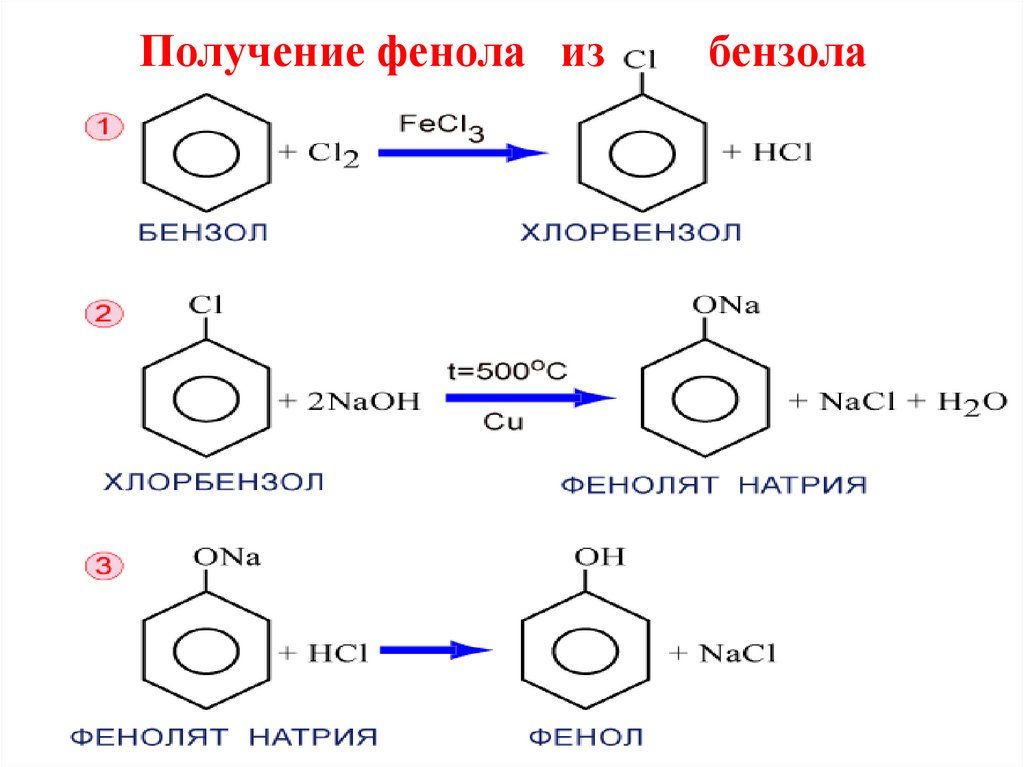
1. В промышленности фенол получают из каменноугольнойсмолы.
2. Кумольный способ: а)окисление изопрпилбензола или кумолаэтот способ экономически наиболее выгоден. Он дает
возможность получать два ценных продукта фенол и ацетон.
19. Получение фенола из бензола
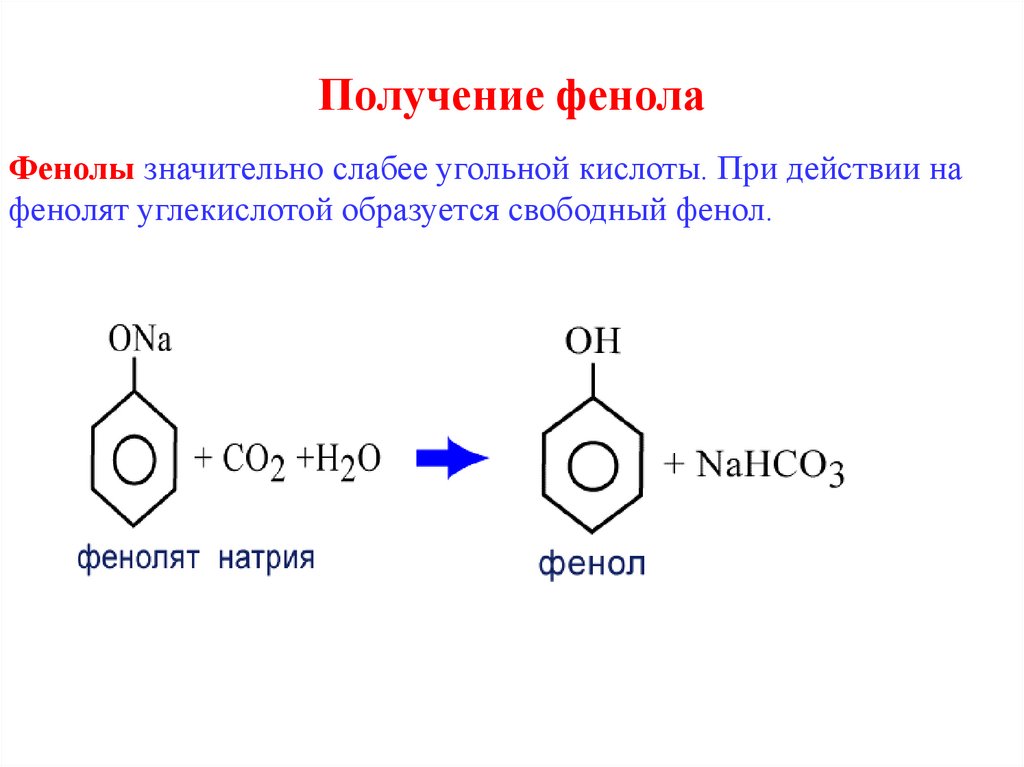
20. Получение фенола
Фенолы значительно слабее угольной кислоты. При действии нафенолят углекислотой образуется свободный фенол.
21. Применение фенола
Фенол является важным сырьем для производства пластмасс,пикриновой кислоты, синтетических красителей, биологически
активных веществ, моющих веществ, синтетических волокон, в
медицине и т.д.
Березовый деготь, содержащий
большое количество фенолов,
является сильным антисептическим
(противомикробным)
средством и применяется при
кожных заболеваниях.
22. Применение фенола
1-5-фенолоформальдегидная смола (линолеум 1, синтетическиеволокна 2,ДСП 3, мебель 4, клеи 5); 6,7- получение органических
соединений .
23. Генетическая связь между фенолом и углеводородами
Генетические связи различныхклассов соединений
представляют собой схему
возможных переходов
представителей разных классов
друг в друга, т.о. химические
свойства веществ одного класса
являются способами получения
веществ другого класса.
Стрелками показаны возможные
химические превращения.
Домашнее задание:
Составить схему генетической
связи и решить ее.
24. Литература
«1C: Образовательная коллекция. Органическая
химия. 10-11 классы».
Единая коллекция цифровых образовательных
ресурсов. http://www.edu.yar.ru
CD Уроки химии КиМ (10-11 класс).



















 Химия
Химия