Похожие презентации:
Строение атома. Распределение электронов в атоме
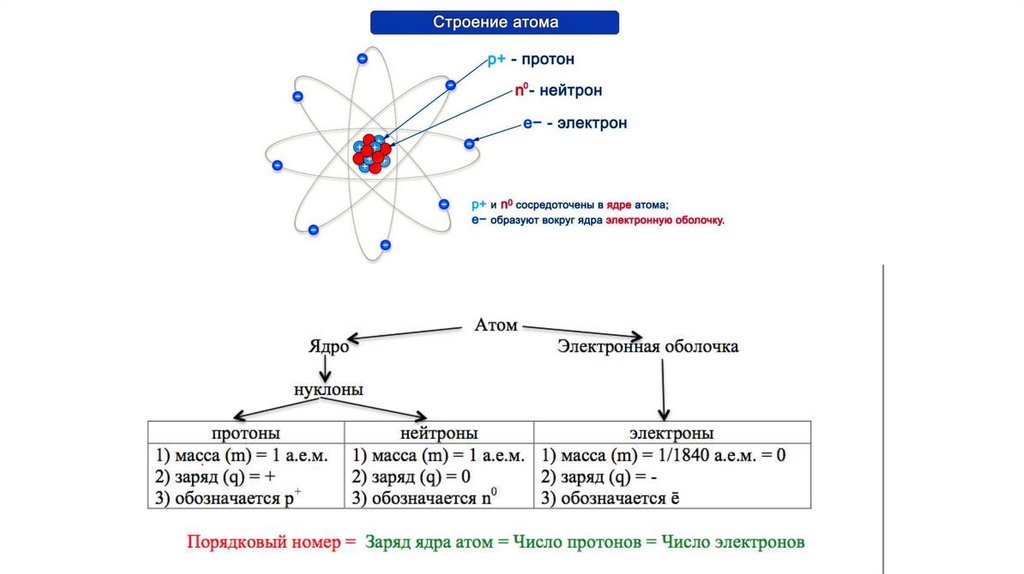
1.
СТРОЕНИЕ АТОМА.РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ
В АТОМЕ.
2.
3.
P.S. Считаем, что A=Ar , где Ar – относительная атомная масса4.
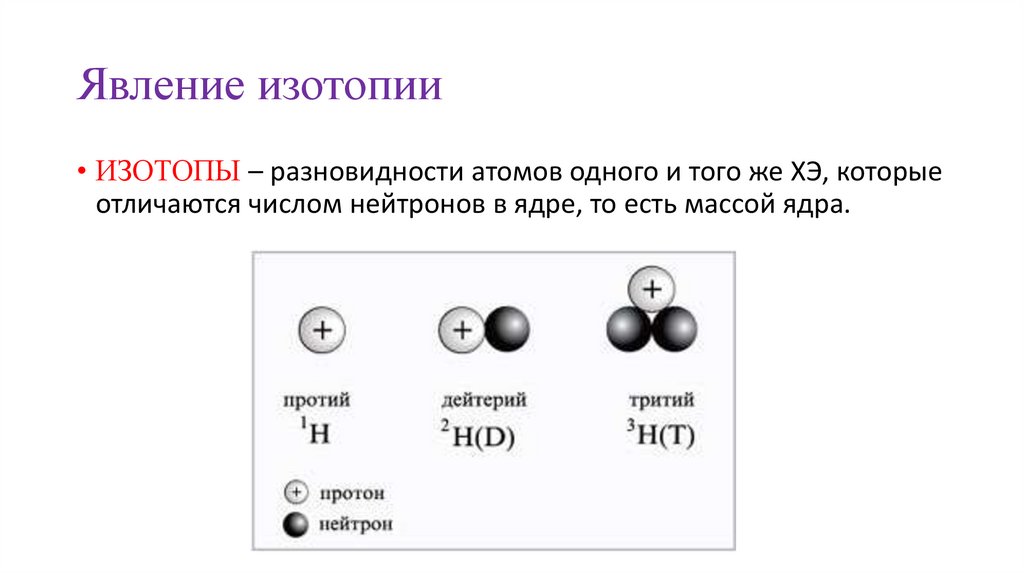
Явление изотопии• ИЗОТОПЫ – разновидности атомов одного и того же ХЭ, которые
отличаются числом нейтронов в ядре, то есть массой ядра.
5.
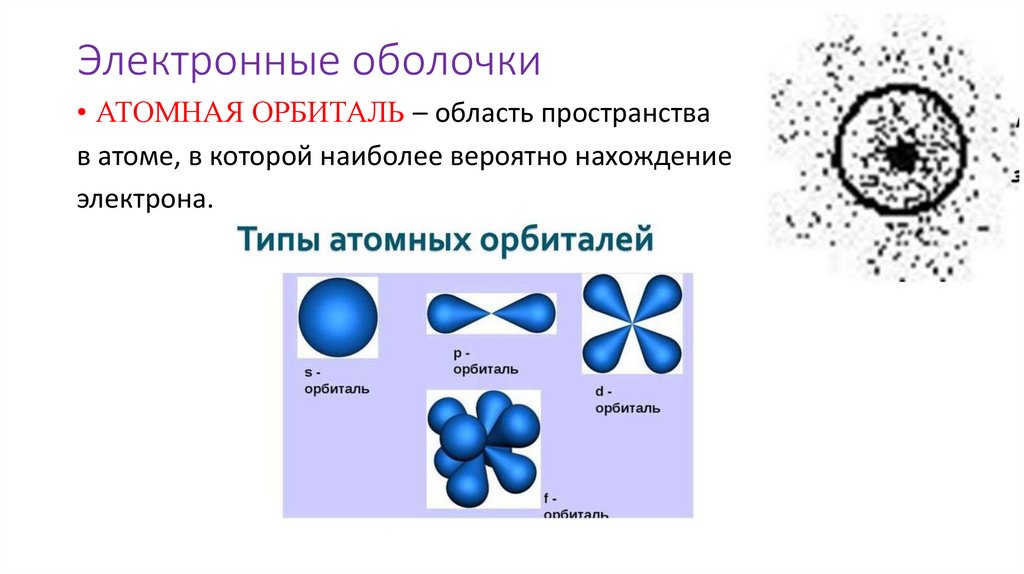
Электронные оболочки• АТОМНАЯ ОРБИТАЛЬ – область пространства
в атоме, в которой наиболее вероятно нахождение
электрона.
6.
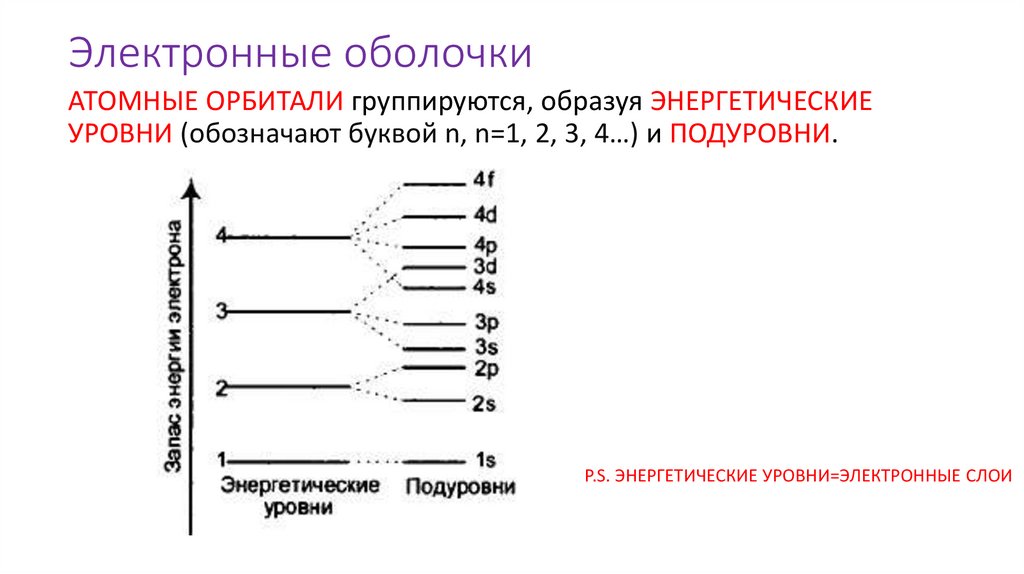
Электронные оболочкиАТОМНЫЕ ОРБИТАЛИ группируются, образуя ЭНЕРГЕТИЧЕСКИЕ
УРОВНИ (обозначают буквой n, n=1, 2, 3, 4…) и ПОДУРОВНИ.
P.S. ЭНЕРГЕТИЧЕСКИЕ УРОВНИ=ЭЛЕКТРОННЫЕ СЛОИ
7.
Электронные оболочкиАтомные орбитали заполняются в
следующем порядке:
*Кол-во энерг-х уровней в атоме = номер периода
*Кол-во эл-в в атоме = порядковый номер
*Кол-во эл-в на внешнем (последнем) энерг—м уровне = номер группы (для
главных подгрупп)
8.
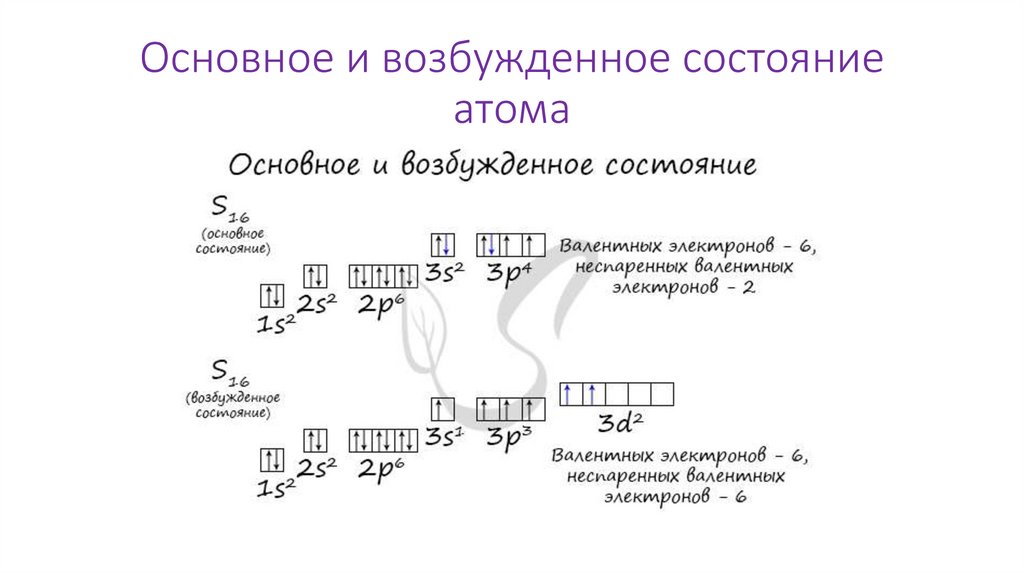
Основное и возбужденное состояниеатома
9.
• Задания по теме “Строение атома”1. Сколько электронов находится во внешнем электронном слое атома, в ядре
которого 14 протонов?
• 1) 2
• 2) 4
• 3) 8
• 4) 14
2. Распределению электронов в атоме химического элемента соответствует
ряд чисел: 2, 8, 3. В Периодической системе Д. И. Менделеева этот элемент
расположен:
• 1) в 3-м периоде, IIIА группе
• 2) в 3-м периоде, IIA группе
• 3) во 2-м периоде, IIA группе
• 4) во 2-м периоде, IIIA группе
10.
3. Заряд ядра атома химического элемента, расположенного во 2-м периоде,IVA группе равен
• 1) +4
• 2) +12
• 3) +8
• 4) +6
4. Химический элемент, в атомах которого распределение электронов по
слоям: 2, 8, 4, образует водородное соединение:
• 1) CH4
• 2) NH3
• 3) SiH4
• 4) H2S
11.
5. В атоме элемента два энергетических уровня заполнены электронами, а натретьем находятся 4 электрона. Какой это элемент?
• 1) кремний
• 2) углерод
• 3) кислород
• 4) сера
6. В атоме химического элемента содержится 15 электронов. Сколько из них
находятся на внешнем энергетическом уровне?
• 1) 1
• 2) 3
• 3) 5
• 4) 7
12.
7. Какие два элемента имеют одинаковое число электронов на внешнемуровне?
• 1) Be и B
• 2) B и Al
• 3) O и F
• 4) Na и Cl
8. На внешнем энергетическом уровне элемента 2-го периода – в два раза
больше электронов, чем на внутреннем уровне. Этот элемент –
• 1) литий
• 2) бериллий
• 3) углерод
• 4) кислород
13.
9. Элементы фтор и хлор имеют одинаковое• 1) общее число электронов
• 2) число завершённых энергетических уровней
• 3) число электронов на внешнем уровне
• 4) число протонов в ядре
10. Элемент 3-го периода имеет на внешнем уровне 4 электрона. Чему равен
порядковый номер элемента?
• 1) 4
• 2) 8
• 3) 12
• 4) 14
14.
Внешние и валентные электроны – одно и то же?15.
Ионы. Электронные конфигурации ионов16.
• Задания по теме “Электронные конфигурации ионов”1. Электронную конфигурацию 1s22s22p63s23p6 имеет ион
• 1) Cl−
• 2) Al3+
• 3) O2−
• 4) Mn2+
2. Электронная конфигурация 1s22s22p63s23p6 соответствует частице
• 1) N3• 2) Ca2+
• 3) F• 4) Al3+
17.
3. Одинаковую электронную конфигурацию имеют частицы• 1) N3- и Аl3+
• 2) Са2+ и Mg2+
• 3) F- и Ar0
• 4) Cl0 и S+4
4. Такое же число электронов как и в атоме Ne, содержит частица
• 1) N5+
• 2) C2−
• 3) Mg2+
• 4) Li+
18.
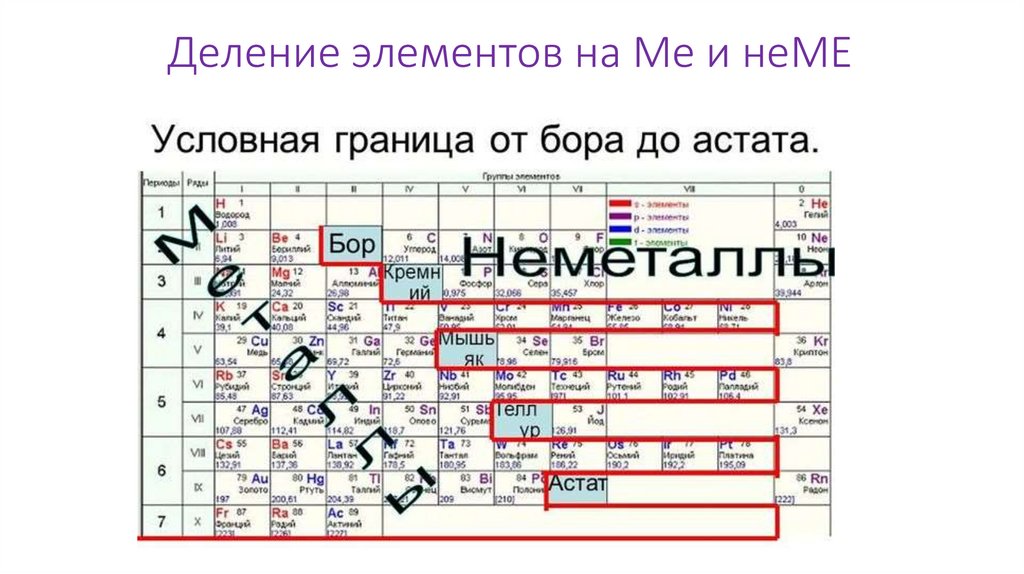
Деление элементов на Ме и неМЕМеталлы – “альтруисты” ПСХЭ. На внешнем уровне у элементов Ме
находится от 1 до 3 электронов, поэтому они с лёгкостью их отдают и
становятся положительными ионами, проявляя при этом
восстановительные свойства (когда заряд или степень окисления
повышается).
Атомы неМе “жадные”, они не любят отдавать электроны. На внешнем
уровне у элементов неМе находится от 4 до 8 электронов, поэтому они
“любят принимать подарки” в виде электронов от атомов Ме,
становятся при этом отрицательными ионами и проявляют
окислительные свойства (когда заряд или степень окисления
уменьшается)













 Физика
Физика Химия
Химия








