Похожие презентации:
Строение атома
1.
2. Демокрит (Δημοκριτειο) из Абдеры во Фракии (ок. 470/60 – 360-е до н.э.)
В основе философии Демокрита лежит учениеоб атомах и пустоте как двух принципах,
порождающих многообразие космоса.
Атом есть мельчайшее «неделимое» тело, не
подверженное никаким изменениям.
Всем атомам присуще свойство непрерывного
движения, и даже внутри макротел, – которые
образованы благодаря сцеплению атомов между
собой, – они совершают колебательные
движения. Первопричиной этого движения
являются соударения атомов, начавшиеся во
время спонтанного «Вихря», благодаря которому
возник наш космос.
Друг от друга атомы, число которых бесконечно,
отличаются тремя свойствами: «фигурой»,
«размером» и «поворотом» (положением в
пространстве).
Демокрит одним из первых указал на
зависимость качеств вещей от способа их
познания.
3.
Электрон. Первые указания о сложном строении атомабыли получены при изучении процессов прохождения
электрического тока через жидкости и газы. Опыты
выдающегося английского ученого М. Фарадея в 30-х гг
XIX в навели на мысль о том, что электричество
существует в виде отдельных единичных зарядов.
Величины этих единичных зарядов электричества были
определены в более поздних экспериментах по
пропусканию электрического тока через газы (опыты с так
называемыми катодными лучами).
Было установлено, что катодные лучи — это поток
отрицательно заряженных частиц, которые
получили название электронов.
4. Модели строения атома
19031904
1907
5. Модель Резерфорда 1911 г.
6.
Атом — электронейтральная системавзаимодействующих элементарных частиц,
состоящая из ядра (образованного протонами и
нейтронами) и электронов.
Химические свойства элемента определяются
строением его атома.
Хотя атомы образуются при взаимодействии всего
лишь трех типов элементарных частиц, при их
сочетании возникает большой набор разнообразных
устойчивых или неустойчивых (радиоактивных!) систем.
7. Атомные частицы и их свойства
Атом состоит из трёх видов частиц:1.
2.
3.
4.
Электрон - (е) - заряд отрицательный,
q=-1,6 . 10-19Кл. Масса mе =9,1.10-31кг
Протон – (р)- заряд положительный
q = 1,6 . 10-19Кл, Масса mр = 1840 mе
Нейтрон –(n)- не заряжен,
Масса mn≈ mр
.
.
8. Строение атома
Ядро атома - образование из протонов и нейтронов,находящееся в центральной части атома. Содержит в себе весь
положительный заряд и большую часть массы атома
(>99,95%).
Количество протонов в ядре, которое равно порядковому
номеру элемента в Периодической системе Д.И.Менделеева и
поэтому называется атомным номером элемента, определяет
благодаря электронейтральности атома число электронов, а
следовательно, электронное строение и определяемые им
химические свойства элемента.
Количество нейтронов в ядрах атомов одного элемента может
различаться; такие атомы называются изотопами этого
элемента
9. Строение атома
Задание А1: число нейтронов в ядре атомаизотопа углерода с относительной атомной
массой равной 12
1) 4;
2)12;
3)6;
4)2
10.
Двойственная природа электронаВ основе современной теории строения атома лежат
следующие основные положения:
1. Электрон имеет двойственную (корпускулярно
волновую) природу. Он может вести себя и как
частица, и как волна: подобно частице, электрон
обладает определенной массой и зарядом; в то же время
движущийся поток электронов проявляет волновые
свойства, например характеризуется способностью к
дифракции.
2. Для электрона невозможно одновременно точно
измерить координату и скорость.
Чем точнее мы измеряем скорость, тем больше
неопределенность в координате, и наоборот.
11.
3. Электрон в атоме не движется по определенным траекториям,а может находиться в любой части околоядерного пространства,
однако вероятность его нахождения в разных частях этого
пространства неодинакова.
Атомная орбиталь — область пространства вокруг ядра, в
которой наиболее вероятно нахождение электрона.
Электроны, обладающие близкими значениями энергии образуют
энергетический уровень. Он содержит строго определенное число
электронов – максимально 2n2.
Энергетические уровни подразделяются на s-, p-, d- и f- подуровни; их
число равно номеру уровня.
12.
Квантовые числа.Главное квантовое число n определяет общую энергию электрона
на данной орбитали. Оно может принимать целые значения,
начиная с единицы (n = 1, 2, 3,...).
В пределах определенных уровней энергии электроны могут
отличаться своими энергетическими подуровнями.
Существование различий в энергетическом состоянии электронов,
принадлежащих к различным подуровням данного энергетического
уровня, отражается побочным (иногда его называют
орбитальным) квантовым числом l. Это квантовое число может
принимать целочисленные значения от 0 до n - 1 (l = 0, 1, ..., п - 1).
Побочное (орбитальное) квантовое число l характеризует
различное энергетическое состояние электронов на данном уровне,
определяет форму электронного облака, а также орбитальный
момент р — момент импульса электрона при его вращении вокруг
ядра (отсюда и второе название этого квантового числа —
орбитальное)
13.
Обычно численные значения l принято обозначать буквеннымисимволами.
Таким образом, электрон, обладая свойствами частицы и волны, с
наибольшей вероятностью движется вокруг ядра, образуя
электронное облако, форма которого в s-, p-, d- ,f-, g-состояниях
различна.
Форма электронного облака зависит от значения побочного
квантового числа l. Так, если l = 0 (s-орбиталь), то электронное
облако имеет сферическую форму (шаровидную симметрию) и не
обладает направленностью в пространстве. При l = 1 (р-орбиталь)
электронное облако имеет форму гантели, т. е. форму тела
вращения, полученного из “восьмерки”. Формы электронных облаков
d- ,f- и g-электронов намного сложнее.
14. Формы атомных орбиталей
Расположение электронных облаков первых двухслоев в атоме
15.
Движение электрического заряда (электрона) но замкнутой орбитевызывает появление магнитного поля. Состояние электрона,
обусловленное орбитальным магнитным моментом электрона (в
результате его движения по орбите), характеризуется третьим квантовым
числом — магнитным ml. Это квантовое число характеризует
ориентацию орбитали в пространстве, выражая проекцию
орбитального момента импульса на направление магнитного поля.
Соответственно ориентации орбитали относительно направления вектора
напряженности внешнего магнитного поля магнитное квантовое число ml
может принимать значения любых целых чисел, как положительных, так и
отрицательных, от -l до +l. включая 0, т.е. всего (2l + 1) значений.
Например, при l = 0 ml = 0; при l = 1 ml = -1, 0, +1;
при l = 3, например, магнитное квантовое число может иметь семь
(2l + 1 = 7) значений: -3, -2, -1, 0, +1, +2,+3.
Таким образом, ml характеризует величину проекции вектора орбитального
момента количества движения на выделенное направление. Например, рорбиталь (“гантель”) в магнитном поле может ориентироваться в
пространстве в трех различных положениях, так как в случае l = 1
магнитное квантовое число может иметь три значения: -1, 0, +1. Поэтому
электронные облака вытянуты по координатным осям х, у и z, причем ось
каждого из них перпендикулярна двум другим.
16.
На рис. 1 показан переход от электронной структуры молекулы кэлектронной структуре вещества на примере щелочного металла.
Рис. 1.
Образование энергетической зоны МО
в кристалле щелочного металла
17.
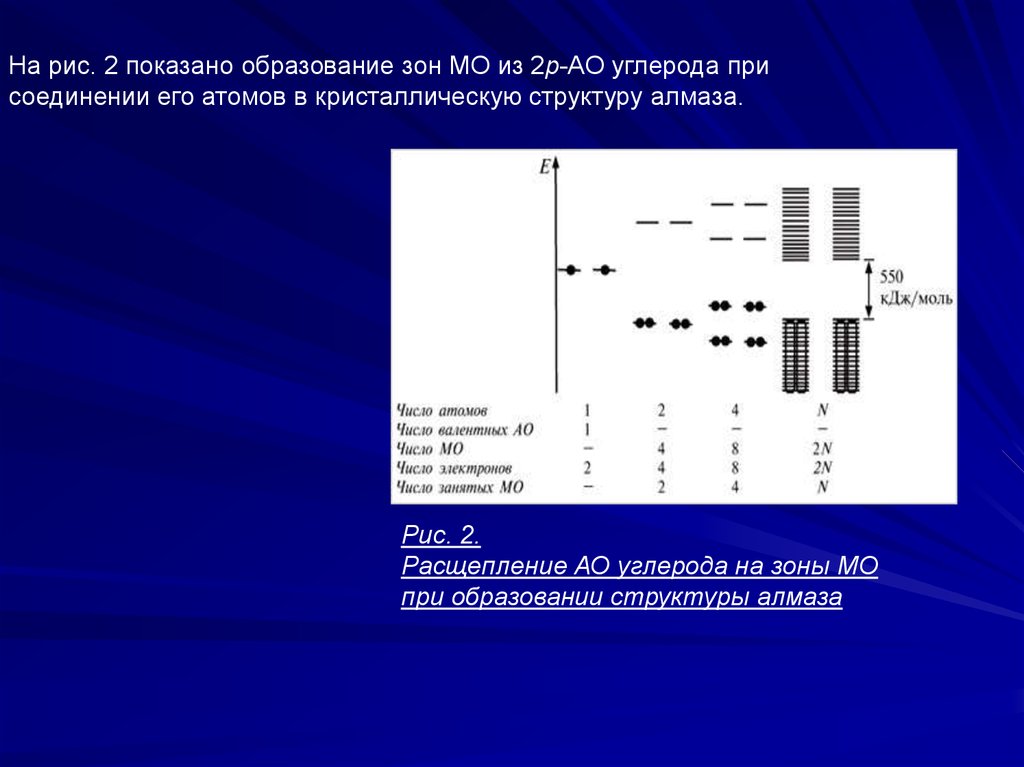
На рис. 2 показано образование зон МО из 2р-АО углерода присоединении его атомов в кристаллическую структуру алмаза.
Рис. 2.
Расщепление АО углерода на зоны МО
при образовании структуры алмаза
18.
Зонное строение кристалла кремния, имеющего те же валентныеэлектроны, что и углерод, то же, что и у алмаза. Но атомы кремния
значительно больше, чем атомы углерода. Следовательно, разность
энергий между занятой и свободной зонами МО (запрещенная зона)
значительно меньше (около 100 кДж/моль). Электроны сравнительно
легко ее преодолевают за счет тепловой энергии, и кремний обладает
свойствами полупроводника. Его электронное строение, как у неметалла,
и в то же время возможна электронная электропроводимость, как у
металла (рис. 3).
Рис. 3.
Зонное строение полупроводника
кремния
19.
Для полного объяснения всех свойств атома была выдвинутагипотеза о наличии у электрона так называемого спина.
Спин — это чисто квантовое свойство электрона, не
имеющее классических аналогов. Спин — это собственный
момент импульса электрона, не связанный с движением в
пространстве. Для всех электронов абсолютное значение спина
всегда равно s = ½. Проекция спина на ось z (магнитное спиновое
число ms) может иметь лишь два значения: ms = + ½ или ms = -1/2.
Первые три характеризуют движение электрона в
пространстве, а четвертое - вокруг собственной оси.
Так как при химических реакциях ядра реагирующих атомов
остаются без изменения (за исключением радиоактивных
превращений), то физические и химические свойства атомов
зависят, прежде всего, от строения электронных оболочек атомов.
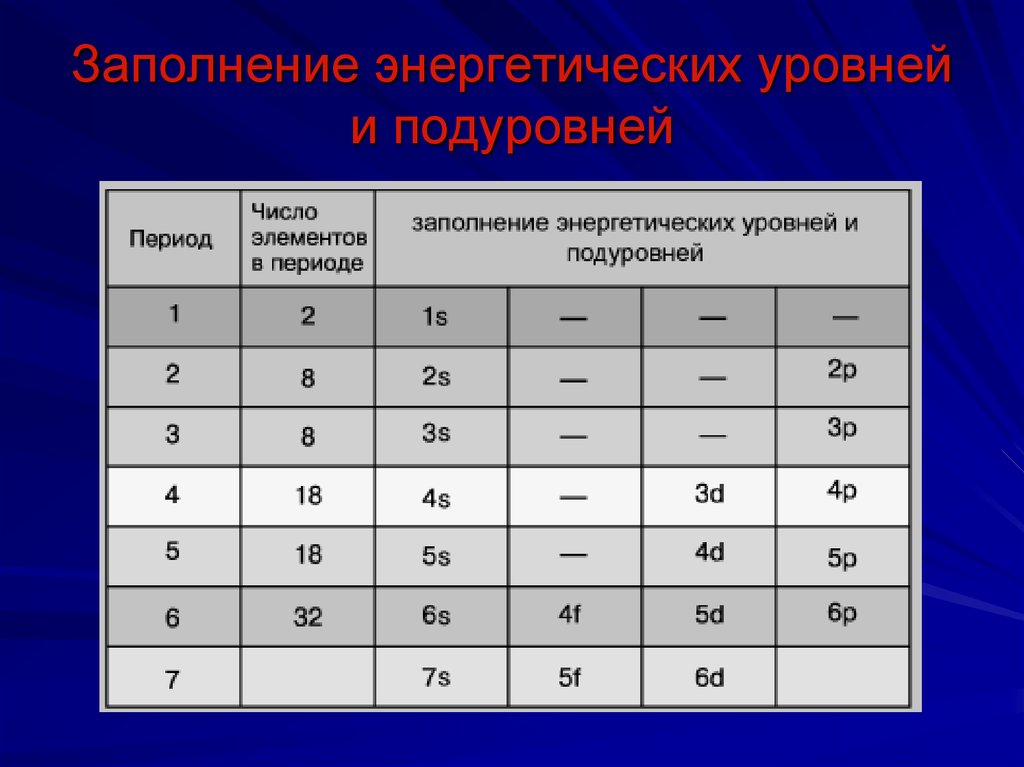
20. Заполнение энергетических уровней и подуровней
21. Правила заполнения энергетических уровней
Принцип минимума энергииЭлектроны заполняют атомные орбитали, начиная с
подуровня с меньшей энергией
Например, энергия электрона на подуровне 4s меньше, чем на
подуровне 3d, так как в первом случае
n + l = 4 + 0 = 4, а во втором n + l = 3 + 2 =5;
на подуровне 5s (n + l = 5 + 0 = 5) энергия меньше, чем на
4d (n + l = 4 + 2 = 6);
на 5р (n + l = 5 + 1 = 6) энергия меньше, чем на
4f (n + l = 4 + 3 = 7) и т.д.
Последовательность в нарастании энергии определяется рядом:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
22. Правила заполнения энергетических уровней
Правило Клечковского (1961 г. )Меньшей энергии электрона отвечает состояние, которое
характеризуется меньшей суммой главного и орбитального
квантовых чисел.
При равенстве сумм (n + l ) электрон заполняет орбиталь с
меньшим значением n.
Например, на подуровнях Зd, 4р, 5s сумма значений
n и l равна 5.
В этом случае происходит сначала заполнение подуровней с
меньшими значениями n, т.е. Зd - 4р – 5s и т.д.
23. Правила заполнения энергетических уровней
Запрет ПаулиВ атоме не может быть двух электронов с одинаковым
набором всех четырех квантовых чисел.
•На одной АО могут находится не более, чем два электрона,
которые должны иметь различные спиновые квантовые числа.
Запрещено!
Разрешено
24. Правила заполнения энергетических уровней
Правило ХундаПри данном значении l (т.е. в пределах определенного
подуровня) электроны располагаются таким образом, чтобы
суммарный спин был максимальным.
Если, например, в трех
p-ячейках атома азота необходимо
распределить три электрона, то они
будут располагаться каждый в
отдельной ячейке, т.е. размещаться
на трех разных
p-орбиталях:
в этом случае суммарный спин равен
3/2.
25. Строение атомов элементов I и II периодов
26. Строение атома углерода
27.
К3валентные
электроны
Группы
главные А
побочные В
N
Периоды
малые
большие
К3
Структура ПСХЭ
атомный №
К2
Положение в ПС
Периодический закон и
ПСХЭ Д.И. Менделеева
элементы-аналоги
высшая валентность =
= № группы
Открытие явления
радиоактивности
ПЗ будет всегда жить, развиваться, уточняться и
руководить исканиями.
К5
Атом
Сделаны открытия
в естественных науках
Систематизация элементов на основе
периодического закона с учетом их
атомных масс и химических свойств
,
Открытие ряда элементов,
прогнозирования их свойств
К8
Электронная схема
ядро A = Z + N
атом состоит…
№ периода
Формулировка
К4
Характеристика
хим. элемента
К5
Период
К6
Новые определения
К7
Группа
значение закона
Содержание
К8
Валентность
протоны
(+) Z
№ группы
свойства элементов
и их соединений
К1
высший
оксид
неметаллы
периодическая
зависимость
электроны (-)
К4
n = 8-№ гр
переходный
элемент
относит. атомная
масса (Менделеев)
HnR
электронные
слои (1-7)
нейтроны
металлы
заряд атомных
ядер
(современная)
3-8 неметалл
1-2 металл
благородный газ
К2
Ме (основные) св-ва
увеличиваются, НеМе
(кислотные) –
уменьшаются
Изотопы
Химический элемент
Относительная
атомная масса
Радиоактивность
К6
К7
28. Строение атома
Составьте электронную формулухимического элемента № 17
29. Строение атома
1. Элемент № 17 называется хлор и имеет химический символ Cl.2. Элемент хлор находится в третьем периоде.
3. Внешним энергетическим уровнем в атоме хлора является уровень
под номером 3.
4. Элемент хлор находится в группе номер VII.
5. Хлор входит в подгруппу А.
6. На внешнем электронном уровне атома хлора имеется 7 электронов.
7. Заряд ядра атома элемента хлора равен +17.
8. На трёх энергетических уровнях атома хлора располагаются 17
электронов.
9. На первом энергетическом уровне атома хлора располагаются 2
электрона.
10. Первый электронный уровень любого атома периодической
системы, кроме атома водорода, можно представить так: 1s2.
30. Строение атома
11. На втором энергетическом уровне атома хлора находится 8электронов.
17 - (2 + 7) = 8
12. На втором энергетическом уровне имеются два подуровня s и р.
13. Число электронов в атоме хлора на втором s - подуровне равняется
2.
14. Число электронов в атоме хлора на втором р - подуровне равняется
6.
8-2=6
15. Число электронов находящихся на одной р -орбитали не может быть
больше чем 2.
16. На втором энергетическом уровне в атоме хлора имеется три р орбитали, расположенных перпендикулярно друг-другу.
17. Расположение электронов на втором энергетическом уровне можно
записать так: 2s22p6. Если прибавить эту запись к ранее сделанной
записи первого энергетического уровня, то получится:
1s22s22p6
31. Строение атома
18. На третьем энергетическом уровне в атоме хлора имеетсятри подуровня s, р, d. Из них заполняется семью
электронами только два s и р, d - подуровень остаётся
пустым.
19. Расположение электронов на третьем энергетическом
уровне можно записать так: 3s23p5. Если добавить эту запись
к ранее сделанной записи первого и второго
энергетического уровней, то получится электронная
формула атома хлора:
1s22s22p63s23p5
Ответ: электронная формула атома хлора 1s22s22p63s23p5.
32. Строение атома
Напишите электронную формулу атоматехнеция. Сколько электронов находится на
d-подуровне предпоследнего электронного
слоя? К какому электронному семейству
относится элемент?
33. Строение атома
Атом Tc в таблице Менделеева имеет порядковыйномер 43. Следовательно, в его оболочке
содержится 43 электрона. В электронной формуле
распределяем их по подуровням согласно порядку
заполнения (в соответствии с правилами
Клечковского) и учитывая емкость подуровней:
Tc1s22s22p63s23p63d104s24p64d55s2. При этом порядок
заполнения подуровней следующий:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d.
Последний электрон располагается на 4d-подуровне,
значит, технеций относится к семейству d-элементов.
На d-подуровне предпоследнего (4-го) слоя
находится 5 электронов.
Ответ: 5, d.
34. Строение атома
Атом какого элемента имеетэлектронную конфигурацию
1s22s22p63s23p63d104s24p64d105s25p1?
35. Строение атома
Решение.Количество электронов в оболочке
нейтрального атома составляет 49.
Поэтому его заряд ядра и,
следовательно, порядковый номер,
также равны 49. В периодической
системе Д.И.Менделеева находим, что
этот элемент – индий.
Ответ: In.
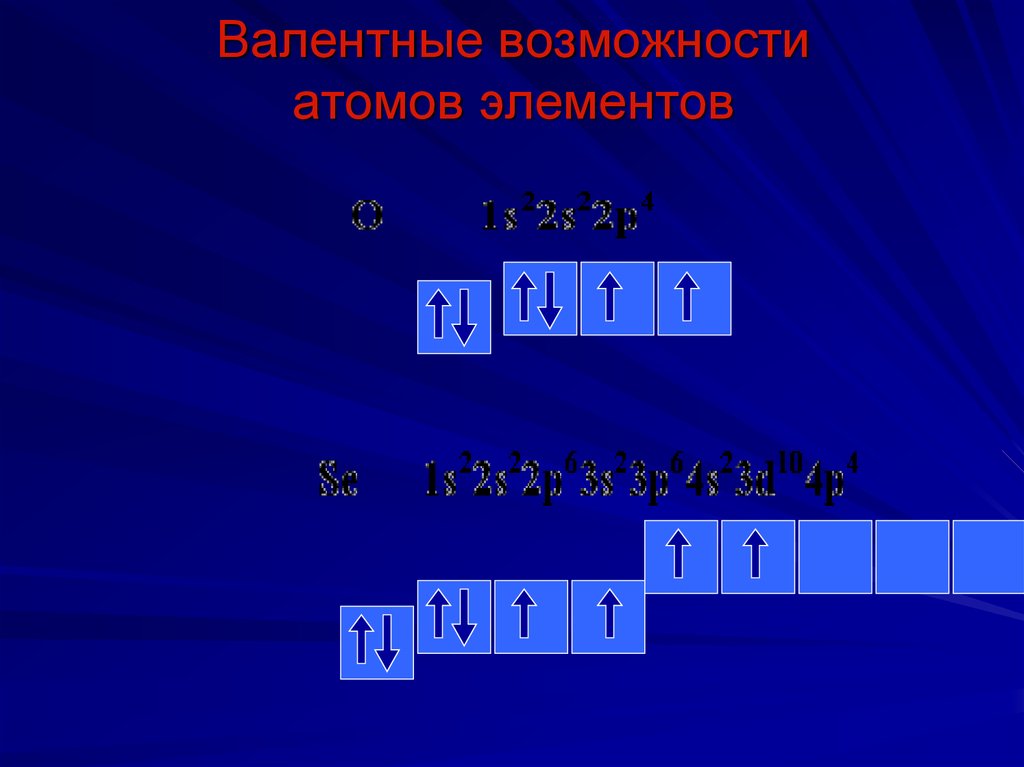
36. Валентные возможности атомов элементов
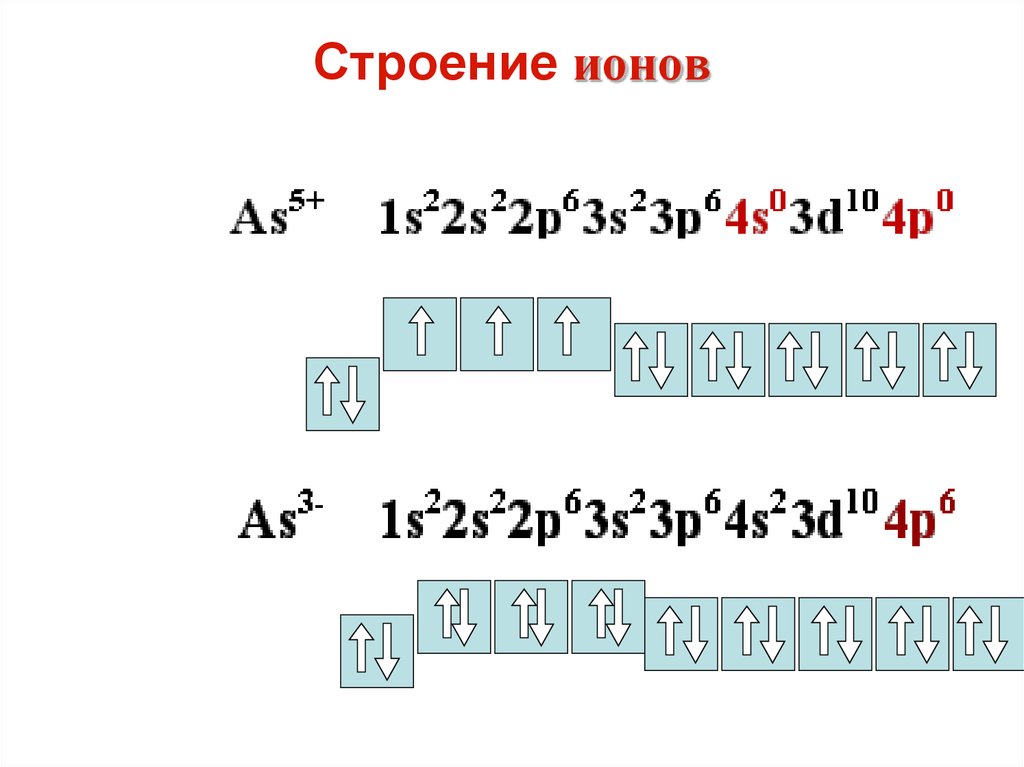
37. Строение ионов
38. Строение ионов
электронная формула иона Br1)…2)….
3)…
4)…
39. Строение ионов
электронная формула атома брома Br01s22s22p63s23p63d104s24p5
атома брома Br0 превращается в ион
брома Br – присоединяя 1 e
электронная формула иона брома Br1s22s22p63s23p63d104s24p6
40. Строение атома
Атом металла имеет электроннуюконфигурацию 1s2 2s2 2p6 3s2, формула
оксида, гидроксида и сульфата этого
элемента
1)ЭО; Э(ОН)2;ЭSO4
3)ЭО; ЭОН;ЭSO4
2) Э2О; ЭОН;Э2SO4
4)Э 2 О 2; Э(ОН)2;Э 2 SO4
41. Строение атома
1s2 2s2 2p6 3s2Э+2
+2
-2
+2
+2
-2
1)Э О ; Э (ОН) 2;Э SO4
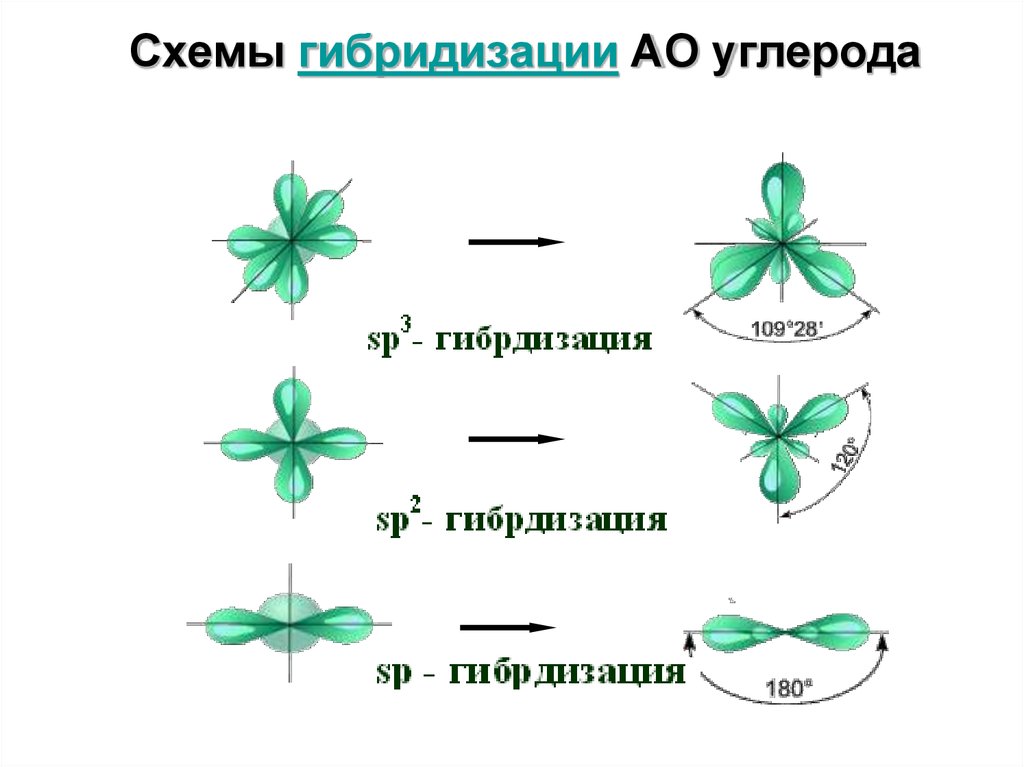
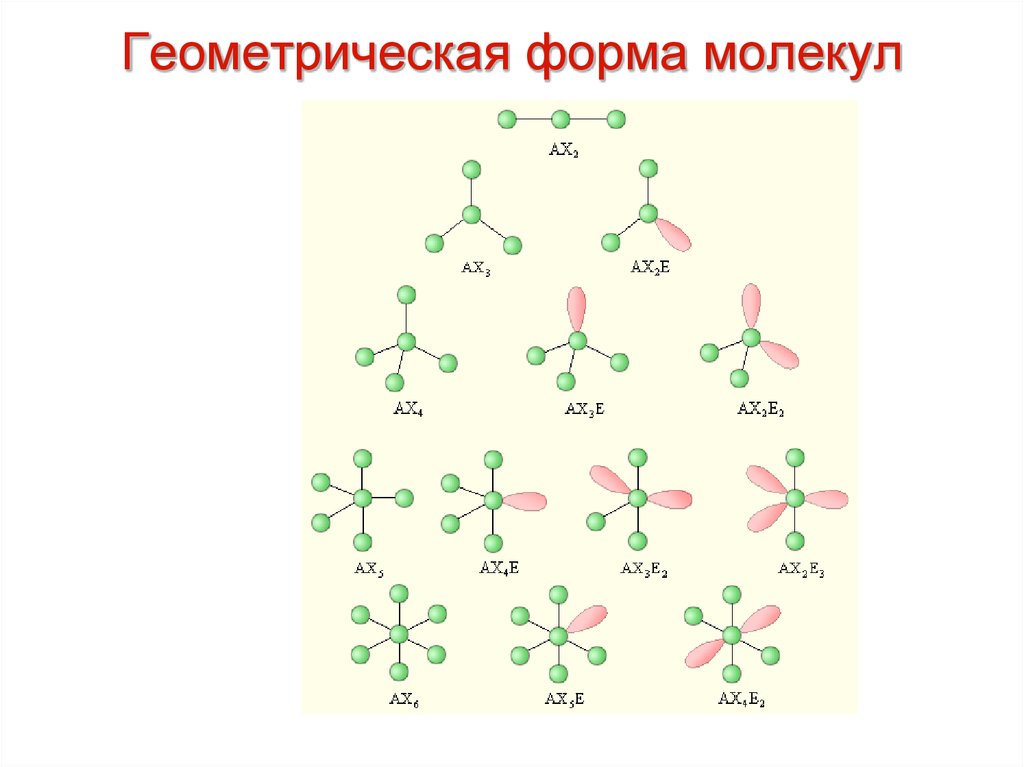
42. Типы гибридизации и форма молекул
43. Схемы гибридизации АО углерода
44. Геометрическая форма молекул
45. Типы гибридизации и форма молекул
Укажите типгибридизации орбиталей бора в
молекуле BBr3.
46. Типы гибридизации и форма молекул
В образовании трех ковалентныхсвязей между бором и атомами брома
участвуют одна s- и две p-орбитали атома
бора, свойства которых различаются.
Поскольку все химические связи в молекуле
BBr3 равноценны, атом бора
подвергается гибридизации. В ней
принимают участие указанные выше
три орбитали внешнего электронного слоя.
Следовательно, тип гибридизации – sp2.
Ответ: sp2.
47. Виды химической связи
Под химической связью понимают такое взаимодействиеатомов, которое связывает их в молекулы, ионы,
радикалы, кристаллы
При образовании химической связи атомы стремятся
приобрести устойчивую восьмиэлектронную (или
двухэлектронную) внешнюю оболочку, соответствующую
строению атома ближайшего инертного газа.
Различают следующие виды химической связи:
ковалентная (полярная и неполярная; по обменному и
донорно-акцепторному механизмам),
ионная,
водородная,
металлическая.
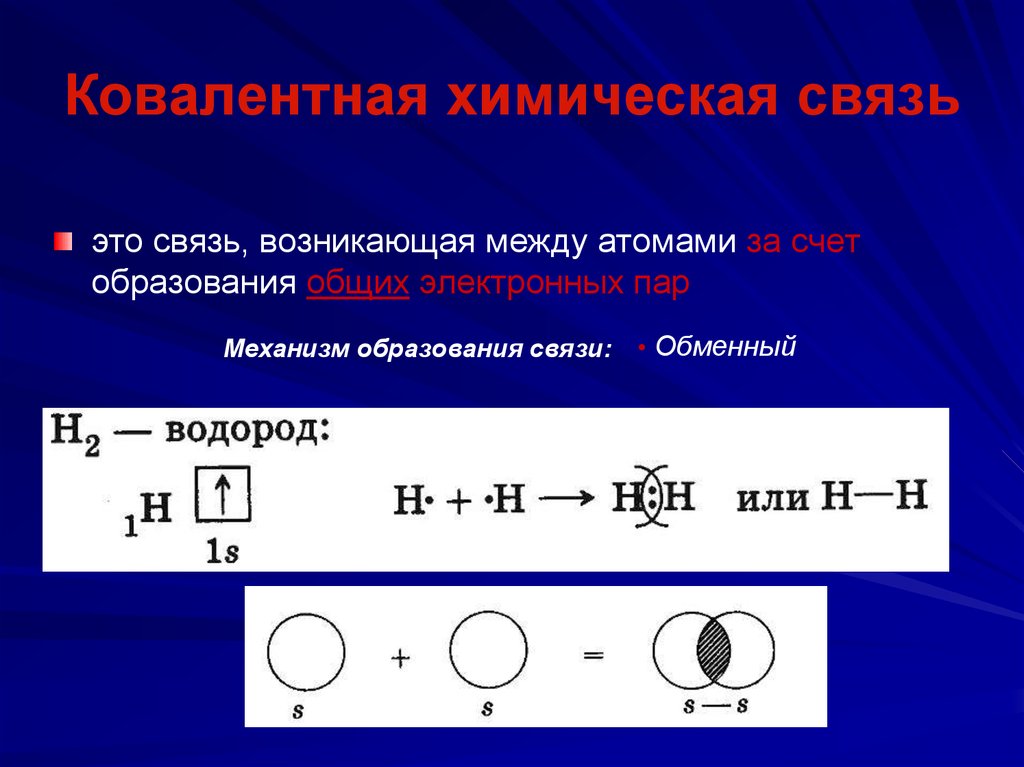
48. Ковалентная химическая связь
это связь, возникающая между атомами за счетобразования общих электронных пар
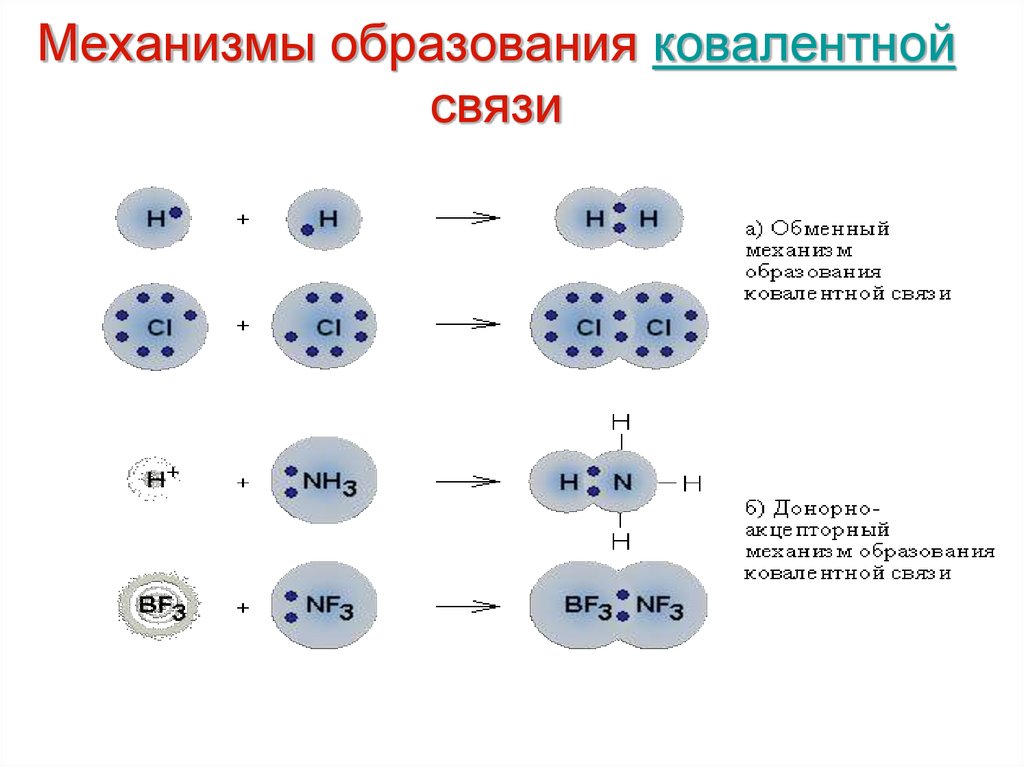
Механизм образования связи:
• Обменный
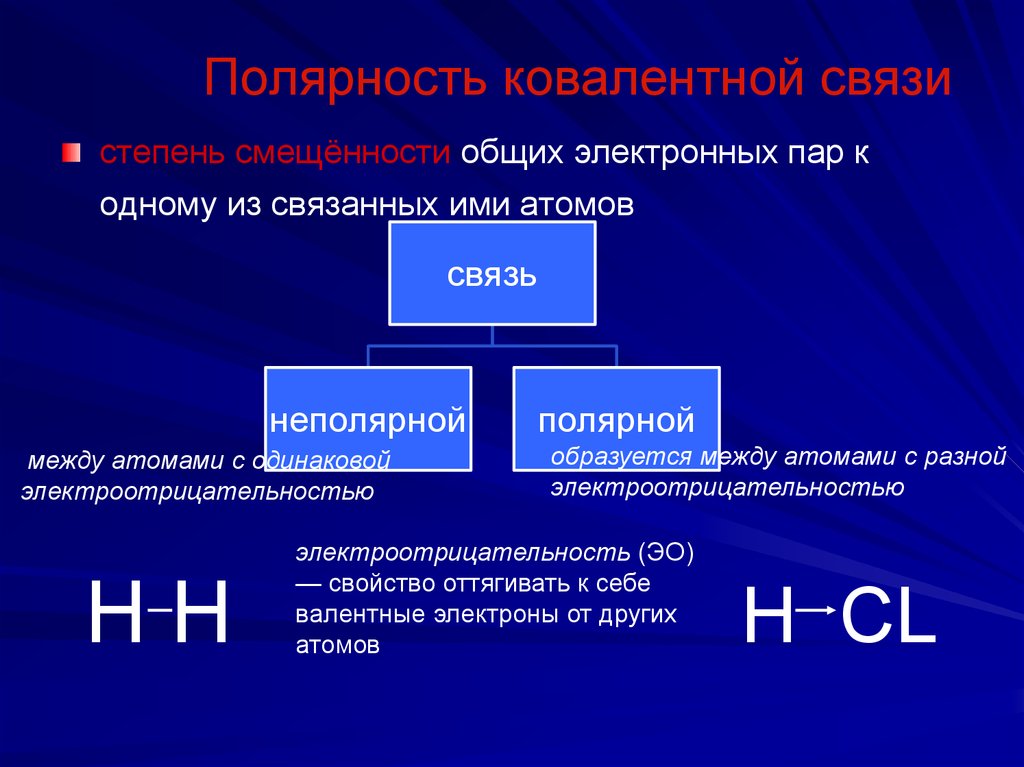
49. Полярность ковалентной связи
степень смещённости общих электронных пар кодному из связанных ими атомов
связь
неполярной
между атомами с одинаковой
электроотрицательностью
HH
полярной
образуется между атомами с разной
электроотрицательностью
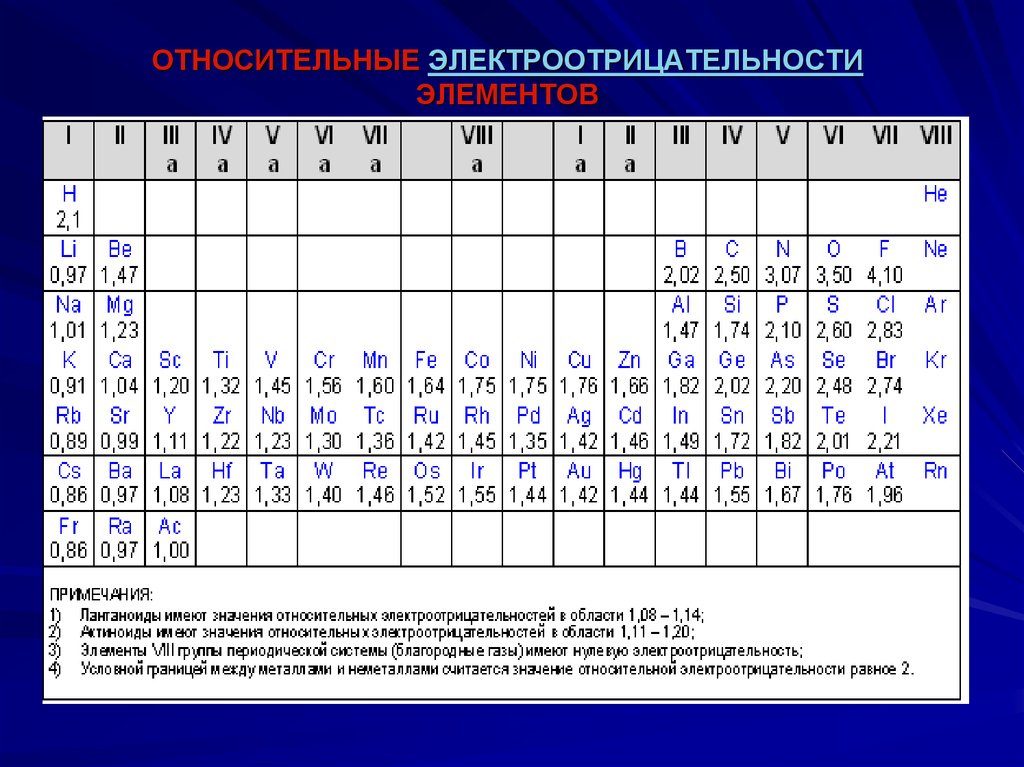
электроотрицательность (ЭО)
— свойство оттягивать к себе
валентные электроны от других
атомов
H СL
50. ОТНОСИТЕЛЬНЫЕ ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ ЭЛЕМЕНТОВ
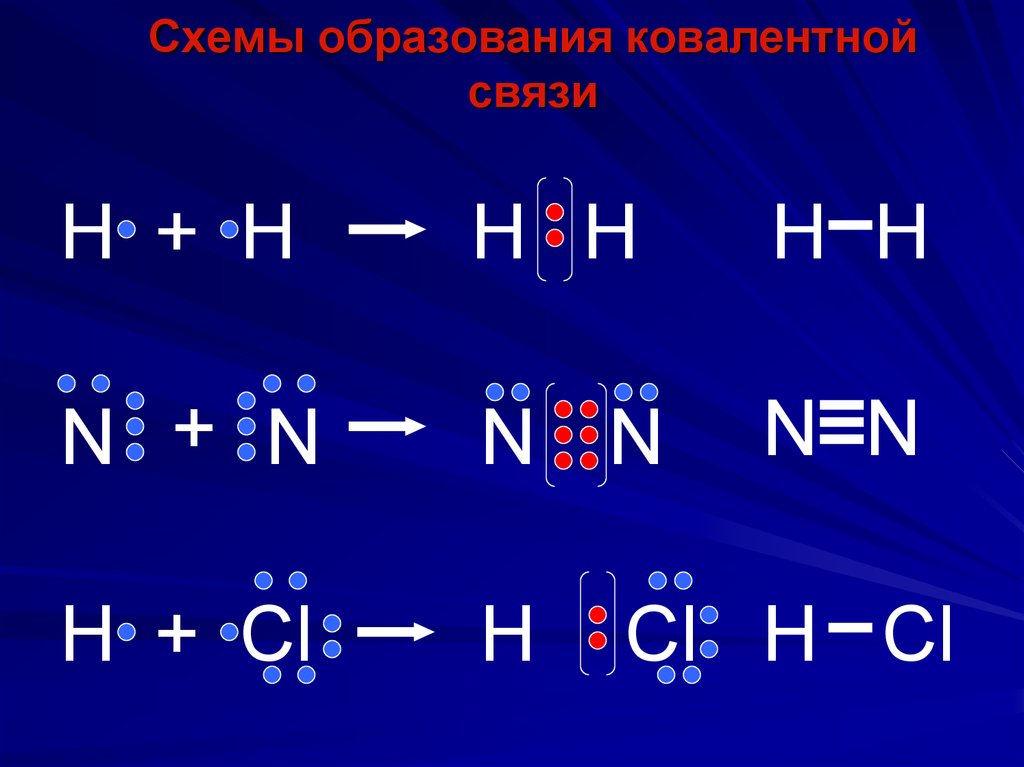
51. Схемы образования ковалентной связи
Н + НН Н
Н Н
N + N
N N
N N
H + Cl
H
Cl H Cl
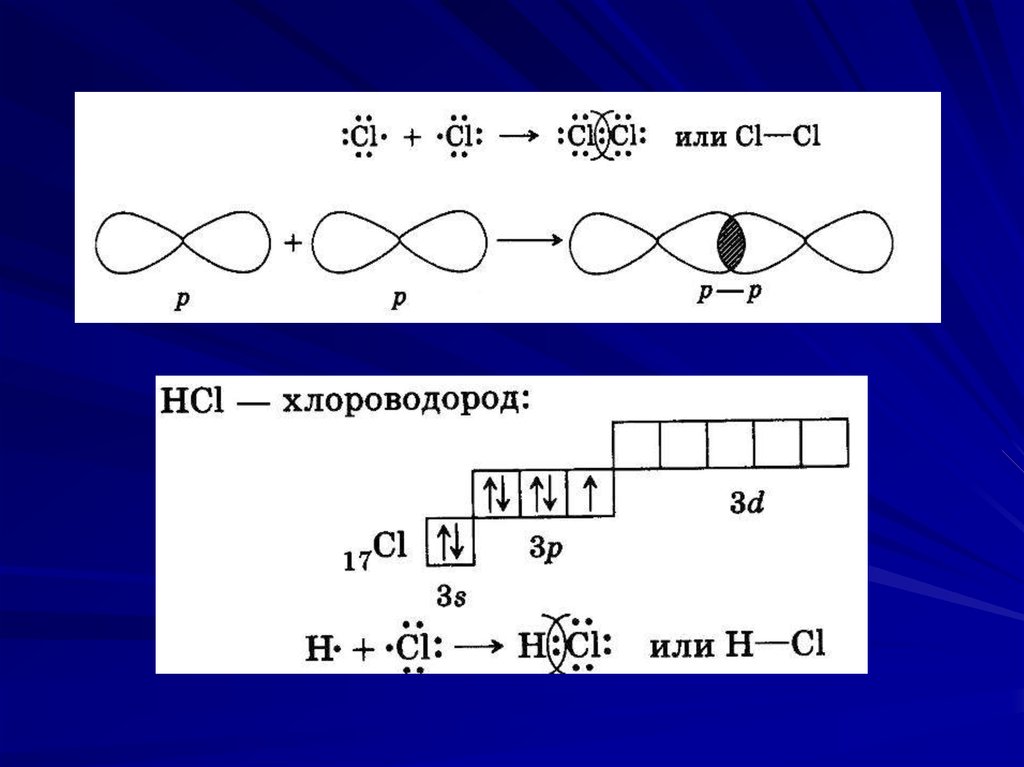
52.
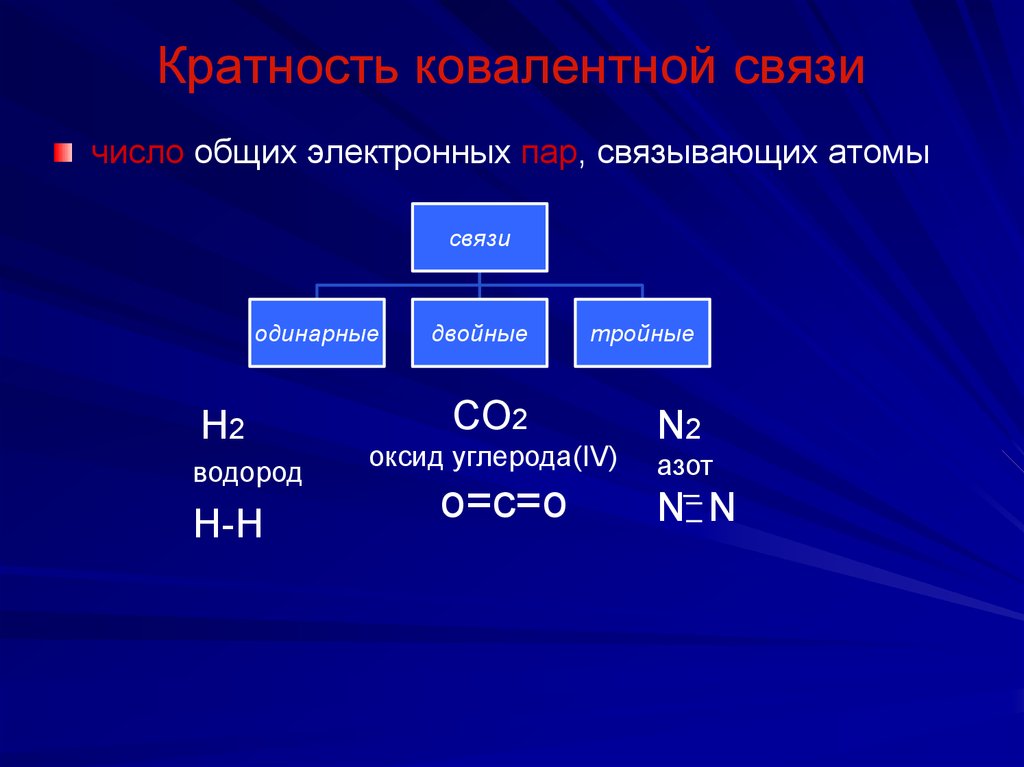
53. Кратность ковалентной связи
число общих электронных пар, связывающих атомысвязи
одинарные
H2
водород
H-H
двойные
тройные
CO2
N2
оксид углерода(IV)
о=с=о
азот
N N
54. Механизмы образования ковалентной связи
55. ИОННАЯ СВЯЗЬ
Если разность электроотрицательностей атомов велика,то электронная пара, осуществляющая связь, переходит
к одному из атомов, и оба атома превращаются в ионы.
Na
+ S
Na
+
2-
+
Na [ S ] Na
Ионная связь образуется только между атомами таких элементов, которые
значительно отличаются по своей электроотрицательности (разность >1,7).
Однако полного перехода электронов от одних атомов к другим не
происходит.
56. Ионная химическая связь
это связь, образовавшаяся за счетэлектростатического притяжения
катионов к анионам
Задание:
Выпишите формулы веществ с ионной связью.
РСl3; С2Н2; Na3P; ССl4, MgCl2; СН4; K3N; NaBr.
57. Металлическая связь
связь в металлах и сплавах, которуювыполняют относительно свободные
электроны между ионами металлов в
металлической кристаллической решетке
Схема образования металлической связи:
о
М — пе
п+
М
Задание:
Выпишите формулы веществ, в которых присутствует металлическая связь
Na, KF, NH3, C2H2, CH3-COOH, H2S, AL, NaCl.
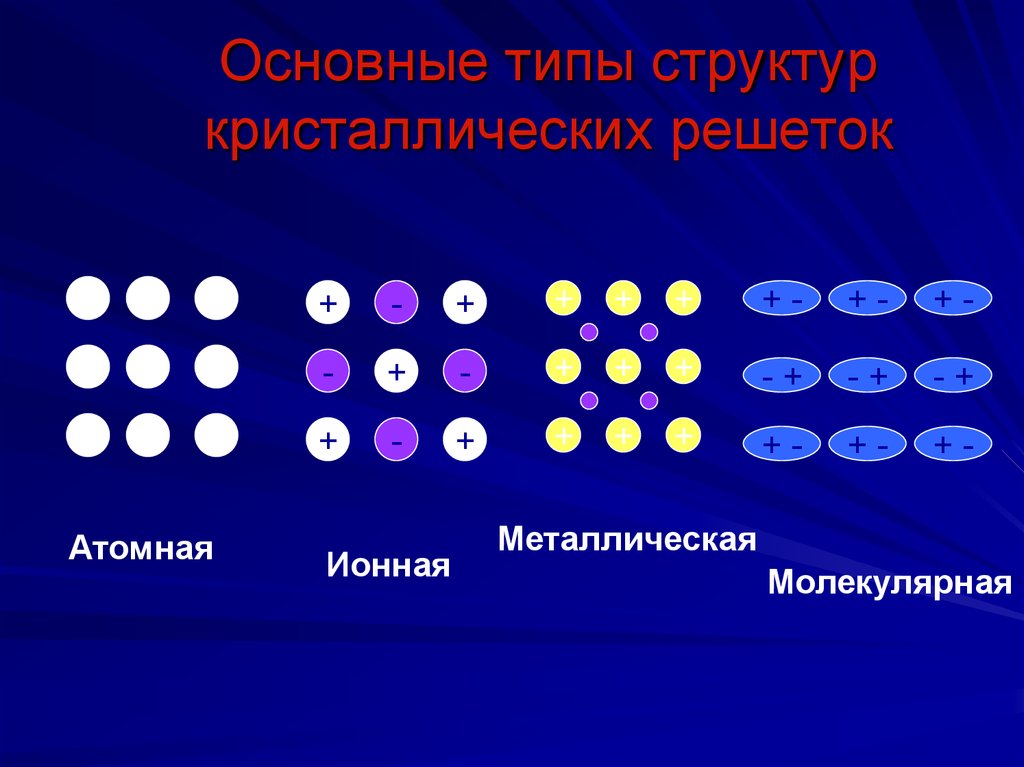
58. Основные типы структур кристаллических решеток
Атомная+
-
+
+
+
+
+-
+-
+-
-
+
-
+
+
+
-+
-+
-+
+
-
+
+
+
+
+-
+-
+-
Ионная
Металлическая
Молекулярная
59. Зависимость свойств веществ от типа кристаллической решёток
Тип решеткиИонная
Виды частиц
Вид связи
в узлах
между частицами
решетки
Ионы
Ионная – связь прочная
Атомная
Атомы
Молекулярная
Молекулы
Металлическая
Атом-ионы
Примеры веществ
Физические свойства
веществ
Соли, галогениды (IA,
IIA),оксиды и
гидроксиды типичных
металлов
Твердые, прочные,
нелетучие, хрупкие,
тугоплавкие, многие
растворимы в воде,
расплавы проводят
электрический ток
Очень твердые, очень
тугоплавкие, прочные,
нелетучие, не
растворимы в воде
1. Ковалентная не
Простые вещества:
полярная – связь очень алмаз (C), графит (C) ,
прочная
бор (B), кремний (Si).
2. Ковалентная
Сложные вещества:
полярная – связь очень оксид алюминия (Al2O3),
прочная
оксид кремния (IV) –
SiO2
Между молекулами –
Твердые вещества при
Непрочные, летучие,
слабые силы
особых условиях,
легкоплавкие, способны
межмолекулярного
которые при обычных –
к возгонке, имеют
притяжения, а вот
газы или жидкости (О2, небольшую твердость
внутри молекул –
Н2, Cl2, N2, Br2, H2O, CO2,
прочная ковалентная
HCl);
связь
сера, белый фосфор,
йод; органические
вещества
Металлическая – разной
Металлы и сплавы
Ковкие, обладают
прочности
блеском,
пластичностью, тепло- и
электропроводны
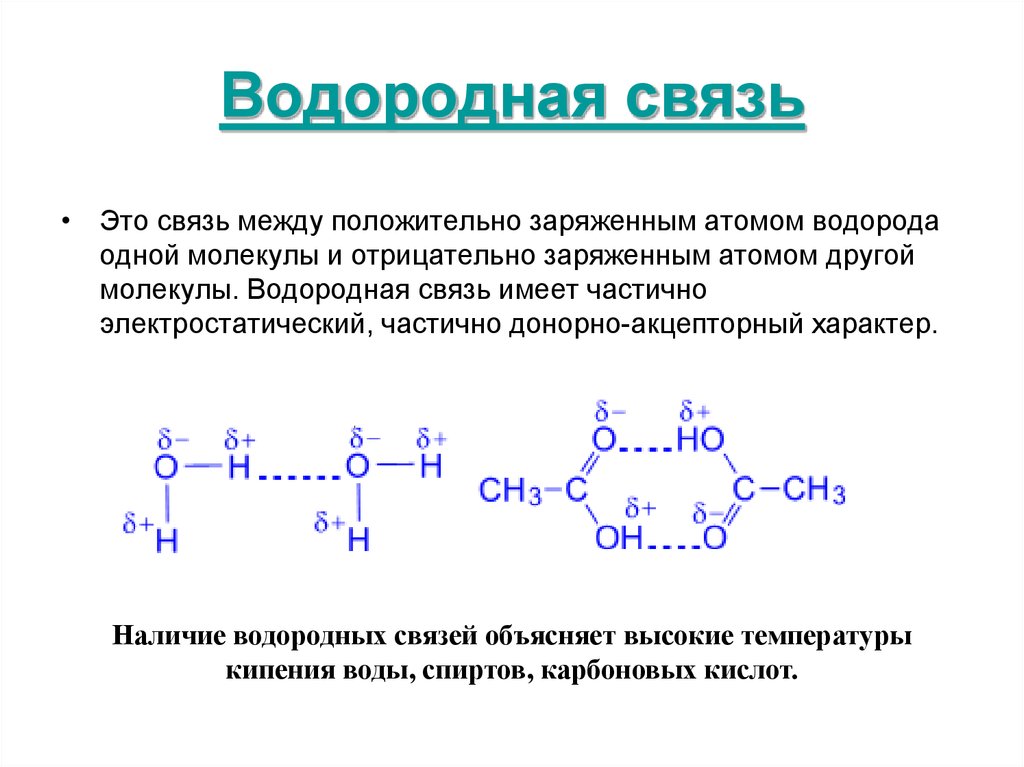
60. Водородная связь
• Это связь между положительно заряженным атомом водородаодной молекулы и отрицательно заряженным атомом другой
молекулы. Водородная связь имеет частично
электростатический, частично донорно-акцепторный характер.
Наличие водородных связей объясняет высокие температуры
кипения воды, спиртов, карбоновых кислот.
61.
К3Уменьшение энергии
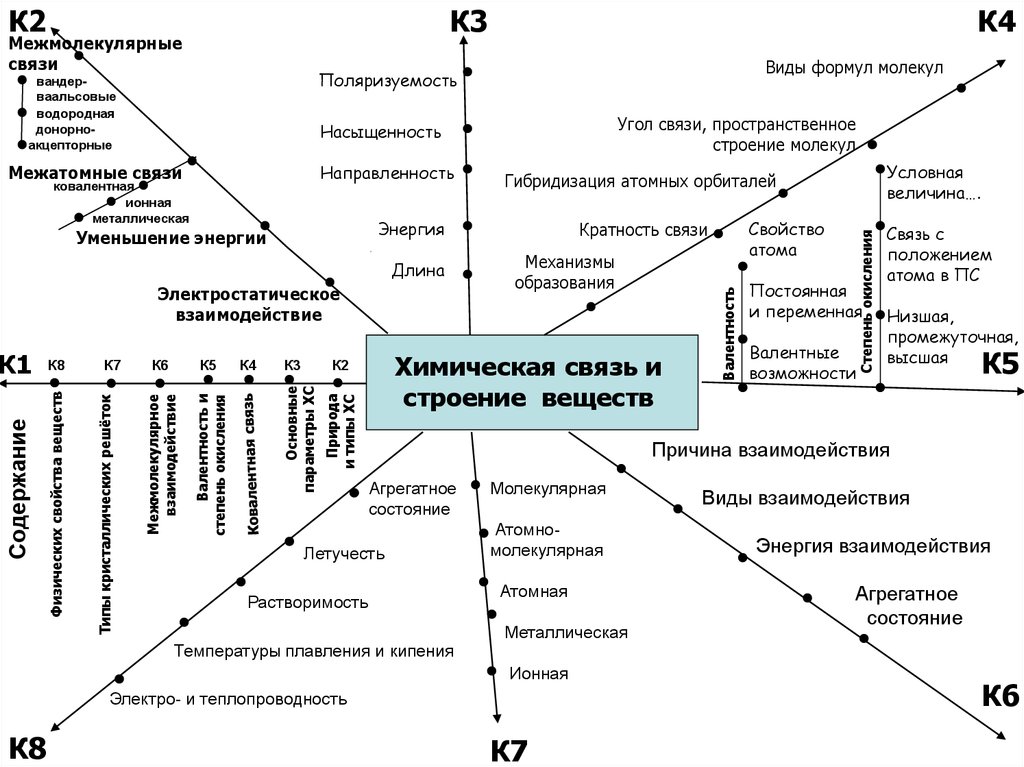
Длина
К4
К3
Между ат. НеМе
Общие
электр. пары
Химическая связь и
строение веществ
К2
Природа
и типы ХС
К5
Основные
параметры ХС
К6
Ионная связь
К7
Типы кристаллических решёток
Физических свойства веществ
Содержание
К8
Металлическая связь
Электростатическое
взаимодействие
К1
Механизмы образования
Энергия
Молекулярная
Легкоплавкие
Атомная
К5
пр. в-ва Ме, сплавы
Ме0 - ne- Ме+n
Летучие (запах)
Хорошо растворимы
Малые прочность
и твёрдость
Металлическая
общие электроны
электронный газ
Ионная
К6
Электро- и теплопроводность
К8
ФЕ
ковалентная
ионная
металлическая
Ионные кристаллы
Направленность
Межатомные связи
Соединения Ме
Насыщенность
м-лы полярные или неполярные
По полярности
пр. в-ва
неполярные м-лы
Электропо группе умен-ся
отрицательность
по периоду увел-ся
Кратность связи
Me0 + НеМе0 Ме+n НеМе-m
Поляризуемость
неполярная
Между ионами
Межмолекулярные
связи
К4
полярная
сл. в-ва
А0– или + ne- И +-
К2
К7
62.
К3Межмолекулярные
связи
Энергия
Уменьшение энергии
Длина
К3
Механизмы
образования
Постоянная
и переменная
Валентные
возможности
Связь с
положением
атома в ПС
Низшая,
промежуточная,
высшая
К5
Причина взаимодействия
Агрегатное
состояние
Летучесть
Растворимость
Температуры плавления и кипения
Молекулярная
Атомномолекулярная
Атомная
Металлическая
Ионная
Электро- и теплопроводность
К8
Свойство
атома
Кратность связи
Химическая связь и
строение веществ
К2
Природа
и типы ХС
К4
Основные
параметры ХС
К5
Валентность и
степень окисления
Типы кристаллических решёток
Физических свойства веществ
Содержание
К6
Межмолекулярное
взаимодействие
Электростатическое
взаимодействие
Условная
величина….
Гибридизация атомных орбиталей
Валентность
Направленность
ковалентная
ионная
металлическая
К7
Угол связи, пространственное
строение молекул
Насыщенность
Межатомные связи
К8
Виды формул молекул
Поляризуемость
вандерваальсовые
водородная
донорноакцепторные
К1
К4
Степень окисления
К2
К7
Виды взаимодействия
Энергия взаимодействия
Агрегатное
состояние
К6
63. Самостоятельная работа
1) Выпишите отдельно структурные формулывеществ с ковалентной полярной и неполярной
связью. Укажите при помощи стрелки
полярность.
Вг2; НСl; КВг; H2SO4; Ba; SO3; Li3N; P4; C2H4.
2) Определите типы химических связей между
атомами в веществах.
CaВг2; НСl; К; H2SO3; BaO; SO2; LiNО3;
S2; C2H2; Na; HCОOК.
64. Виды химической связи
Какие виды химической связи имеютсяв молекуле NH4I ?
65. Виды химической связи
Молекула NH4I состоит из ионов NH4+ иI–, между которыми имеется ионная
связь. В ионе NH4+ четыре связи
являются ковалентными полярными,
причем одна из них образована
по донорно-акцепторному типу.
Ответ: ионная, ковалентная полярная,
донорно-акцепторная.

















































 Химия
Химия








