Похожие презентации:
Общая характеристика щелочных металлов
1.
.......щелочь начала плавиться, а из нее выпрыгивалималенькие металлические шарики. В первую минуту они
казались похожими на ртуть, но затем взрывались или
покрывались белым налетом и теряли свой
металлический блеск. Так в щелочи был открыт новый
металл, о существовании которого еще никто из ученых
мира и не подозревал.
Позднее ученые нашли этот металл в соде, поваренной
соли. Это серебристый металл, который не тонет в воде,
а плавает на ее поверхности.
Позднее Берцелиус предложил назвать этот элемент от
арабского «натрун» - сода, а еще один элемент открытый
Дэви, получил название от арабского «алкали» - щелочь.
2.
Общая характеристикащелочных металлов
3.
I. Характеристика атомов1. 1 группа, главная подгруппа
2. ns1
s-элемент, r атомов увеличивается от Li к Fr
3. металлические свойства
в периодах убывают, в подгруппе усиливаются
4. +1
4.
II. Характеристика простых веществ1. Строение простых веществ
Схема
Кристаллическая
Химическая связь образования
химической связи решетка
5.
II. Характеристика простых веществ1. Строение простых веществ
Химическая
связь
металлическая
Схема
Кристаллическая
образования
решетка
химической связи
Me - 1e
Me +1
металлическая
6.
2. Физические свойствасходство
различия
7.
2. Физические свойствасходство
серебристо-белые
металлический блеск
мягкие
хорощо проводят
электрический ток
различия
плотность увеличивается (от
Li к Fr)
температура плавления
уменьшается (от Li к Fr)
8.
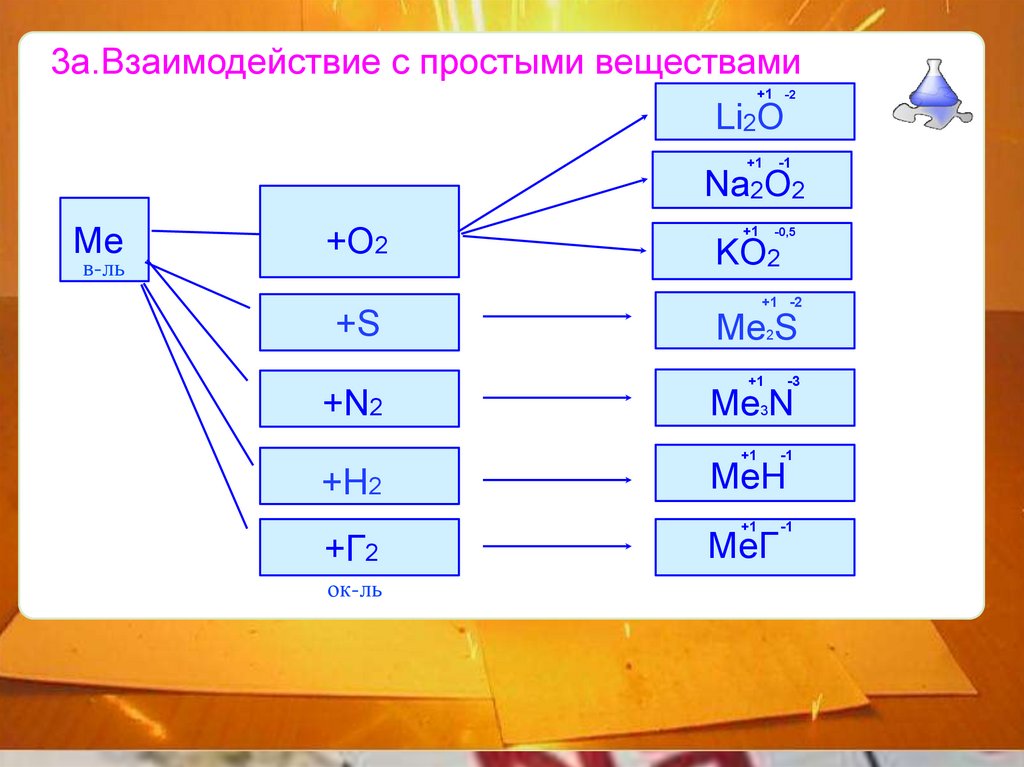
3а.Взаимодействие с простыми веществами+1 -2
Li2O
+1
-1
Na2O2
Me
в-ль
+O2
+1
-0,5
KO2
+1 -2
+S
Me S
2
+1
+N2
-3
Me N
3
+1
-1
+H2
MeH
+Г2
+1
-1
ок-ль
MeГ
9.
Взаимодействие с простыми веществами6 K + N2 → 2K3N
2 Na + S → Na2S
4 Li + O2 → 2Li2O
10.
3б.Взаимодействие металлов с водойЩелочные металлы
+ H2O → щелочь + H2
11.
Взаимодействие металлов с водой2 Li + 2 H2O → 2LiOH + H2
2 Na +2 H2O → 2NaOH + H2
2 K + 2 H2O →
2KOH + H2
12.
4. Получение щелочных металловАнод +
Катод -
2NaCL
расплав
Na+
эл.ток
2Na + Cl2
Na+
Cl-
ClCl-
Na+
4NaOH
расплав
эл.ток
4Na +2H2O + O2
13.
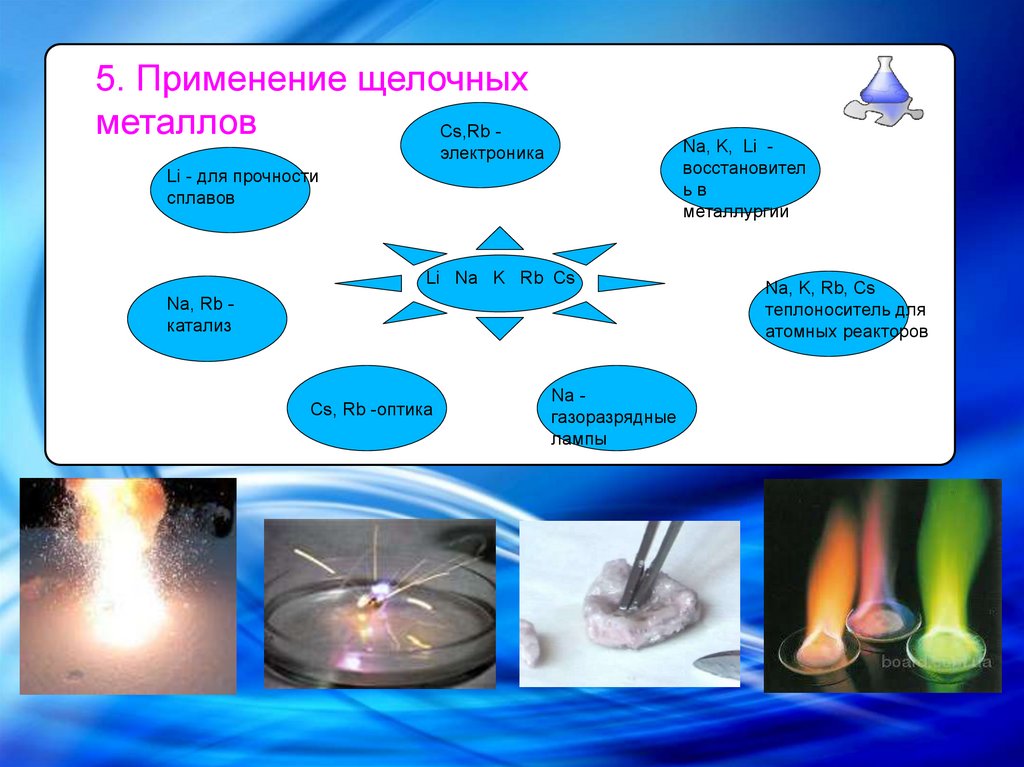
5. Применение щелочныхметаллов
Cs,Rb -
Na, K, Li восстановител
ьв
металлургии
электроника
Li - для прочности
сплавов
Li Na K Rb Cs
Na, Rb катализ
Cs, Rb -оптика
Na газоразрядные
лампы
Na, K, Rb, Cs
теплоноситель для
атомных реакторов
14.
Проверим знанияПроявляет наиболее сильные
восстановительные свойства?
1.
3.
Li
Rb
2.
Na
4.
K
Образуют оксид при
взаимодействии с кислородом?
1.
K
3.
Cs
2.
4.
В результате взаимодействия
металла с водой образуются щелочь и
водород
1.
Сu
2.
K
3.
Fe
4.
Al
Получают электролизом
расплавов солей
Na
1.
Na
2.
Cu
Li
3.
Ag
4.
Zn
15.
Закончите фразуСегодня я узнал......
......
Было интересно ......
Было трудно .......
получилось ..
Меня удивило .....
.....
Теперь я могу
Я научился ........
У меня
Мне захотелось













 Химия
Химия








