Похожие презентации:
Сера. Аллотропия и свойства серы
1. Сера. Аллотропия и свойства серы
2. СЕРА В ПРИРОДЕ
Самородная сера- SЦинковая
обманка- ZnS
Пирит (железный
колчедан)- FeS2
ГипсCaSO4∙2H2O
Медный блескCuS
Глауберова сольNa2SO4·10H2O
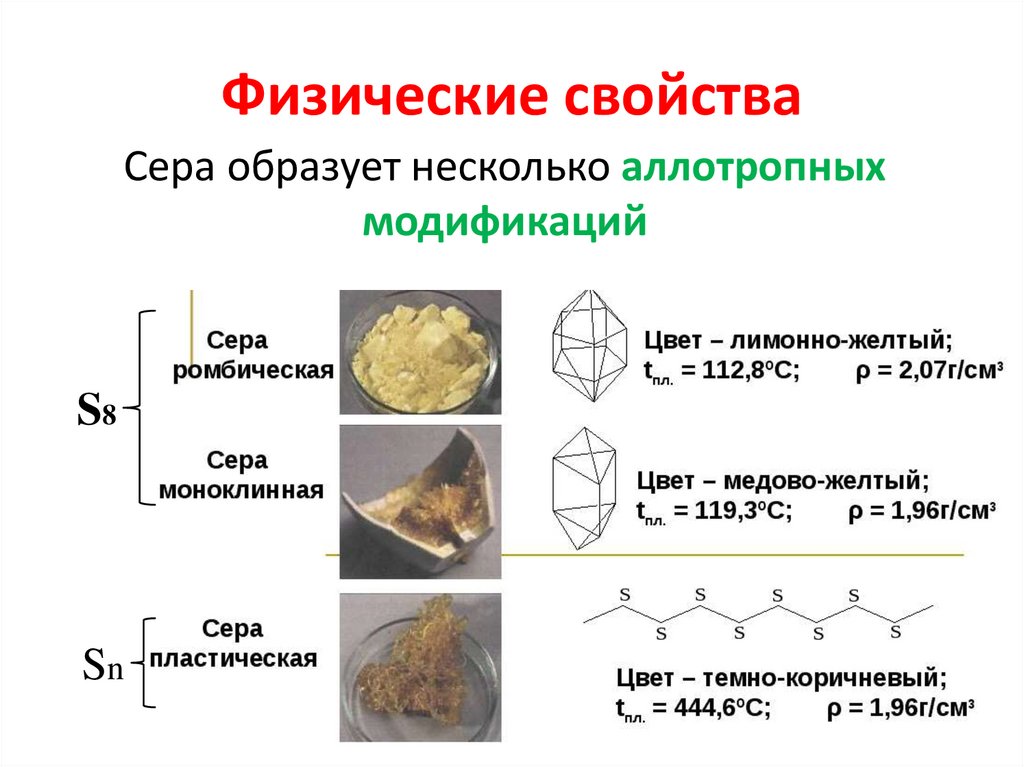
3. Физические свойства
Сера образует несколько аллотропныхмодификаций
S8
Sn
4. Физические свойства
В обычных условиях − хрупкоекристаллическое вещество желтого цвета,
нерастворимое в воде (даже не смачивается
ею), хорошо растворима в сероуглероде −CS2,
бензине, бензоле и других органических
растворителях. Плохо проводит тепло и
электрический ток
5. Химические свойства
Сера −типичный неметалл, по своейактивности уступает кислороду и галогенам.
Проявляет окислительновосстановительную двойственность
ВОЗМОЖНЫЕ СТЕПЕНИ ОКИСЛЕНИЯ СЕРЫ
-2
S
0
S
+4
S
+6
S
6. Химические свойства
• Как окислитель :1) +Ме (при t◦ ) кроме Au, Pt, Ir → сульфиды
При комнатной t◦ взаимодействуют с щелочными Ме
Na+ S →
Cu+S →
Zn+ S →
Hg+ S →
2) + H2 (при t◦ )
H2 + S →
3) + некоторые неМе
С+2S → CS2
2 P+ 5S → P2S5
P+ S(недост) →
7. Химические свойства
• Как восстановитель:1) +O2
S + O2 → SO2
2) + Hal2
S + 3F2 → SF6
S+ 2Cl2 →SCl4 (SCl2 )
S+ N2, I2, благородные газы →!!!!
8. Химические свойства
• Взаимодействие со сложными веществамиS + H2O (пар) → H2S + SO2
Электронный баланс
S + H2SO4(конц) → SO2 + H2O
S + H2SO4(р) →
Электронный баланс
S + HNO3(конц) → H2SO4 + NO2+ H2O
Электронный баланс
S + HNO3(р) → SO2 + NO+ H2O
Электронный баланс
S + NaOH → Na2S + Na2SO3 + H2O
Электронный баланс
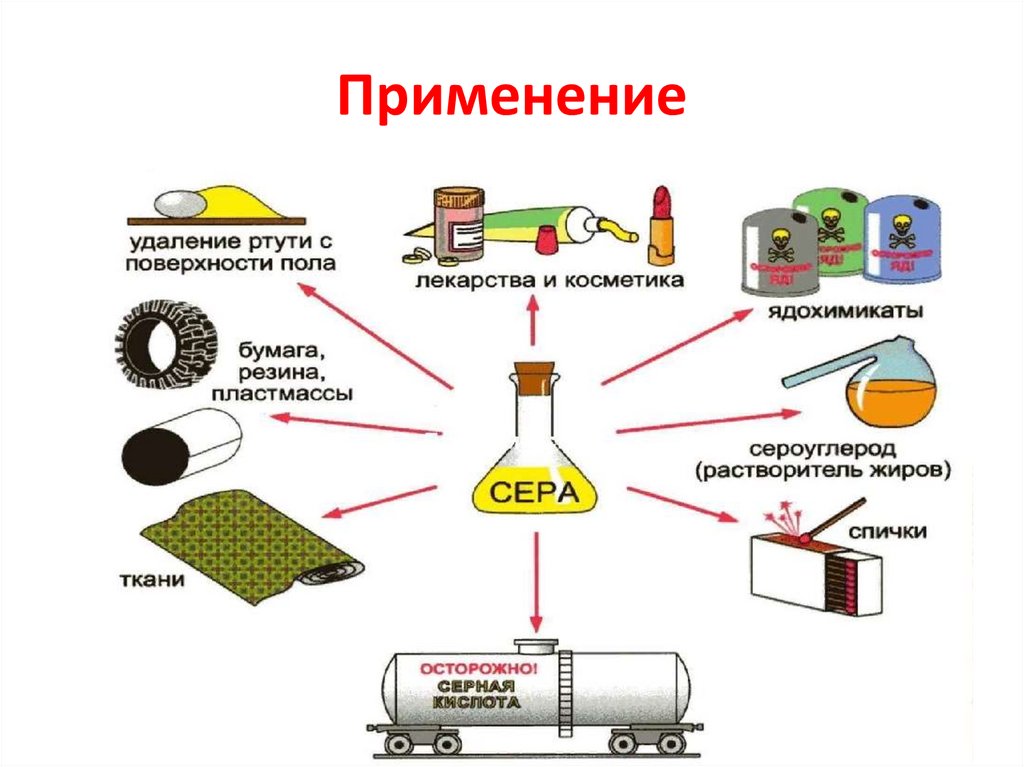
9. Применение
10. Домашнее задание
• П. 17• Осуществите превращения:
S → SO2→ SO3→ K2SO4→ BaSO4
• 10,8 г алюминия сплавили с серой, массой
14,4г. Полученный продукт обработали
избытком соляной кислоты. Вычислите
объем (н.у.) выделившихся при этом газов и
назовите их.








 Химия
Химия








