Похожие презентации:
Химическая энергия
1.
Презентацию выполнилстудент 12 группы
1 курса ДТК
Истратов Кирилл
2.
В современной жизнихимические источники тока
окружают нас повсюду: это
батарейки в фонариках,
аккумуляторы в мобильных
телефонах, водородные
топливные элементы,
которые уже используются в
некоторых автомобилях.
Бурное развитие
электрохимических
технологий может привести
к тому, что уже в ближайшее
время вместо машин на
бензиновых двигателях нас
будут окружать только
электромобили, телефоны
перестанут быстро
разряжаться, а в каждом
доме будет свой
собственный
электрогенератор на
топливных элементах.
3.
Сначала разберемся, почему химическуюэнергию вообще можно использовать для
получения электричества. Все дело в том, что
при окислительно-восстановительных
реакциях происходит перенос электронов
между двумя разными ионами. Если две
половины химической реакции разнести в
пространстве, чтобы окисление и
восстановление проходили отдельно друг от
друга, то можно сделать так, чтобы электрон,
который отрывается от одного иона, не сразу
попадал на второй, а сначала прошел по
заранее заданному для него пути. Такую
реакцию можно использовать как источник
электрического тока.
4.
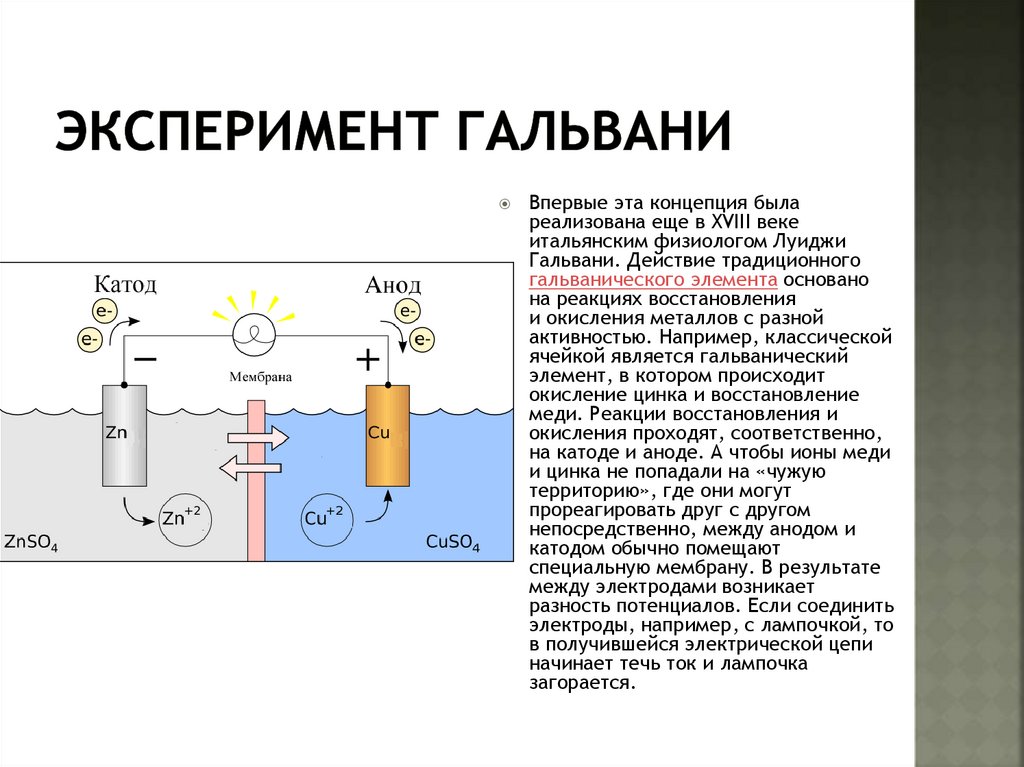
Впервые эта концепция былареализована еще в XVIII веке
итальянским физиологом Луиджи
Гальвани. Действие традиционного
гальванического элемента основано
на реакциях восстановления
и окисления металлов с разной
активностью. Например, классической
ячейкой является гальванический
элемент, в котором происходит
окисление цинка и восстановление
меди. Реакции восстановления и
окисления проходят, соответственно,
на катоде и аноде. А чтобы ионы меди
и цинка не попадали на «чужую
территорию», где они могут
прореагировать друг с другом
непосредственно, между анодом и
катодом обычно помещают
специальную мембрану. В результате
между электродами возникает
разность потенциалов. Если соединить
электроды, например, с лампочкой, то
в получившейся электрической цепи
начинает течь ток и лампочка
загорается.
5.
Первым шагом к расширениювозможностей химических
источников тока стало
создание аккумулятора —
источника тока, который
можно перезаряжать и поэтому
использовать многократно.
Для этого ученые просто
предложили использовать
обратимые химические
реакции. Полностью разрядив
аккумулятор в первый раз,
с помощью внешнего
источника тока прошедшую в
нем реакцию можно запустить
в обратном направлении. Это
восстановит исходное
состояние, так что после
перезарядки батарею можно
будет использовать заново.
6.
На сегодня создано многоразличных типов
аккумуляторов, которые
отличаются типом
происходящей в них
химической реакции.
Наиболее распространенными
типами аккумуляторов
являются свинцово-кислотные
(или просто свинцовые)
аккумуляторы, в основе
которых лежит реакция
окисления-восстановления
свинца. Такие устройства
обладают довольно
длительным сроком службы,
а их энергоемкость составляет
до 60 ватт-часов
на килограмм. Еще более
популярными в последнее
время являются литий-ионные
аккумуляторы, основанные на
реакции окислениявосстановления лития.
Энергоемкость современных
литий-ионных аккумуляторов
сейчас превышает 250 ваттчасов на килограмм.
7.
Батарея(фр. batterie) — два
или более
соединённых параллельно
или
последовательно электричес
ких элементов. Обычно под
этим термином
подразумевается
соединение
электрохимических
источников электроэнергии
или электрического тока.
8.
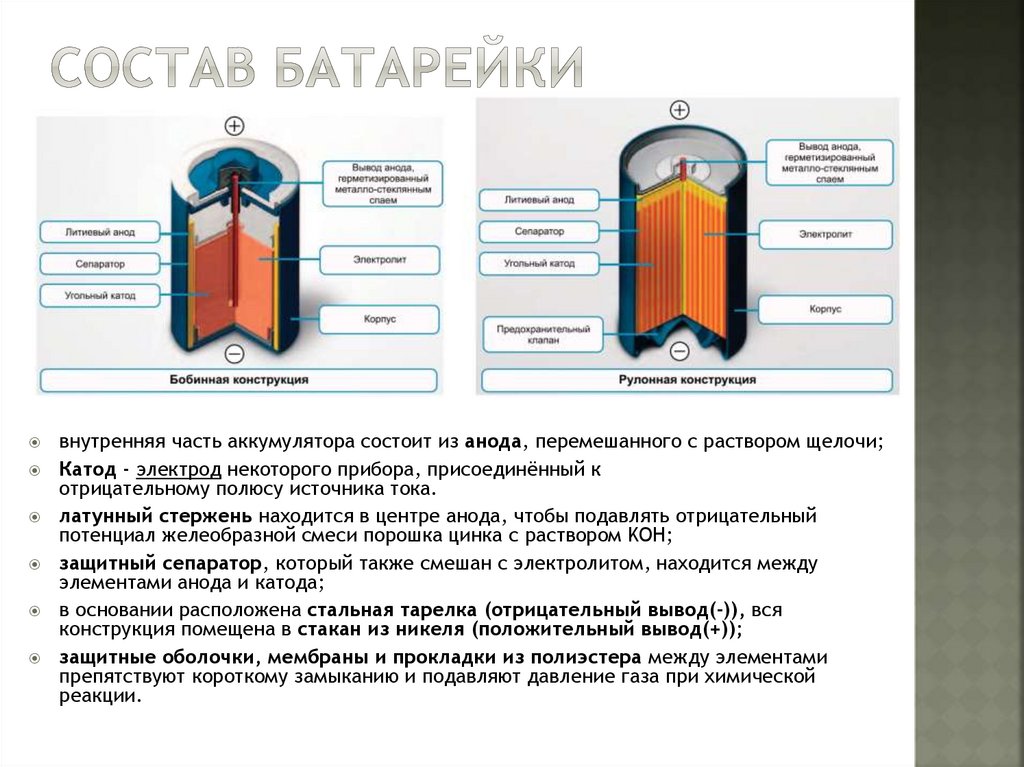
внутренняя часть аккумулятора состоит из анода, перемешанного с раствором щелочи;Катод - электрод некоторого прибора, присоединённый к
отрицательному полюсу источника тока.
латунный стержень находится в центре анода, чтобы подавлять отрицательный
потенциал желеобразной смеси порошка цинка с раствором KOH;
защитный сепаратор, который также смешан с электролитом, находится между
элементами анода и катода;
в основании расположена стальная тарелка (отрицательный вывод(-)), вся
конструкция помещена в стакан из никеля (положительный вывод(+));
защитные оболочки, мембраны и прокладки из полиэстера между элементами
препятствуют короткому замыканию и подавляют давление газа при химической
реакции.
9.
Таблетки (маркировка CR) — устройства круглой формы с диаметром 0,3-0,47 см, металлическийзащитный корпус и маленькие размеры обуславливают сферу применения (используются для
наручных часов, кухонных весов, пультов сигнализации);
микропальчиковые (маркировка ААА) — элементы цилиндрической формы длиной 4,45 см, весом до
15 г, за счет небольших размеров и высокой производительности распространены в бытовых
приборах (игрушках, технике, пультах управления);
пальчиковые (маркировка АА) — цилиндрические аккумуляторы длиной 5 см, весом до 20 г, также
широко используются в быту (преимущественно в радио- или фототехнике, радиоуправляемых
моделях);
кроны — по названию одноименных батареек производства СССР, прямоугольные элементы высотой
до 5 см и весом до 55 г, со штекером и гнездом с двух сторон, применяются в радиотехнике;
бочонки (маркировка D) — устройства питания весом 60-140 г для приборов с повышенным
потреблением тока (акустические системы, бумбоксы, фонари).
10.
техника для взвешивания (бытовые,напольные, торговые или
лабораторные весы);
пульты управления (для
телевизоров, кондиционеров,
видео- и аудиотехники);
часы (электронные настенные,
настольные или напольные);
модели на радиоуправлении;
медицинское оборудование
(электронные приборы для
измерения артериального
давления, температуры тела,
слуховые аппараты, холтеры и пр.);
радиоприемники, магнитофоны,
бумбоксы, портативные колонки;
цифровые фотоаппараты.
11.
Запоследние 200 лет человечество
совершило большой скачок в получении и
накоплении энергии. Трудно представить
мегаполис без источника автономного
электропитания – аккумулятора. Возможно, в
недалеком будущем дома, освещения,
парковки, магазины – все, что потребляет
энергию, будет работать от аккумуляторов.
Самым востребованным изобретением в наши
дни являются промышленные аккумуляторы,
их значение сложно переоценить.










 Химия
Химия








