Похожие презентации:
Химические источники тока. Гальванические элементы
1. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА.
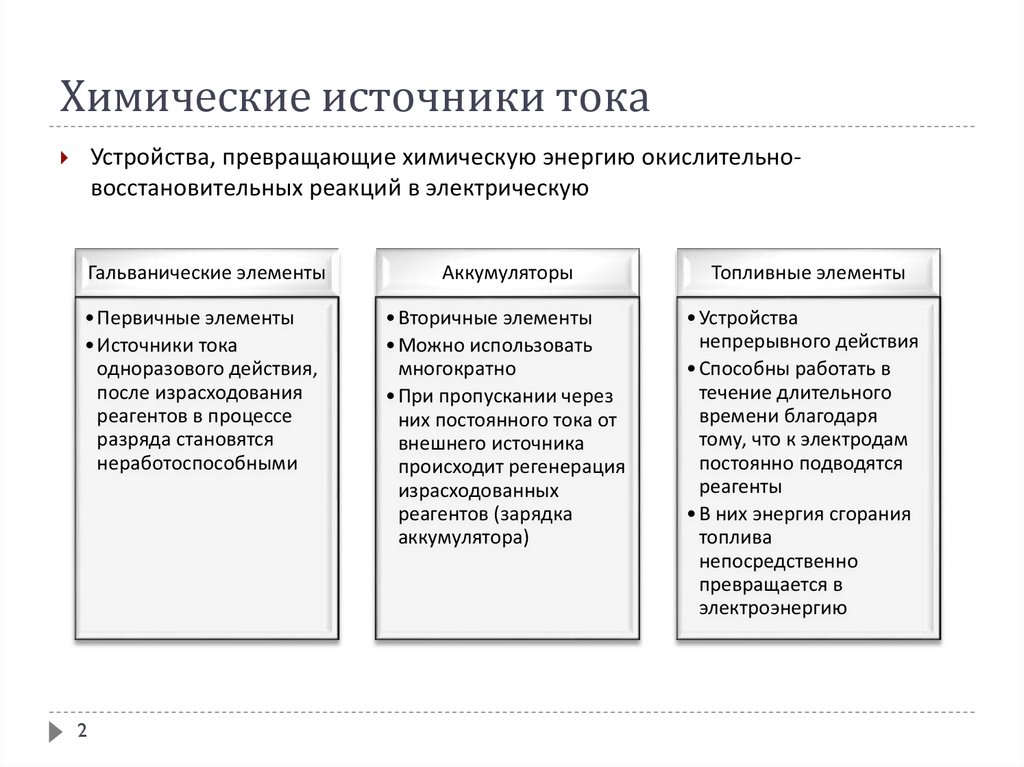
2. Химические источники тока
Устройства, превращающие химическую энергию окислительновосстановительных реакций в электрическуюГальванические элементы
Аккумуляторы
Топливные элементы
• Первичные элементы
• Источники тока
одноразового действия,
после израсходования
реагентов в процессе
разряда становятся
неработоспособными
• Вторичные элементы
• Можно использовать
многократно
• При пропускании через
них постоянного тока от
внешнего источника
происходит регенерация
израсходованных
реагентов (зарядка
аккумулятора)
• Устройства
непрерывного действия
• Способны работать в
течение длительного
времени благодаря
тому, что к электродам
постоянно подводятся
реагенты
• В них энергия сгорания
топлива
непосредственно
превращается в
электроэнергию
2
3.
Гальванический элемент - химический источникэлектрического тока, основанный на взаимодействии
двух металлов и/или их оксидов в электролите,
приводящем к возникновению в замкнутой цепи
электрического тока. Назван в честь Луиджи Гальвани.
Переход химической энергии в электрическую энерги
ю происходит в гальванических элементах.
3
4. Литиевые элементы
В современных условиях большоераспространение получили литиевые
химические источники тока
Литиевый анод, органический
электролит и катоды из различных
материалов.
Обладают очень большим сроком
хранения, высокой плотностью энергии
и сохраняют работоспособность в
широком интервале температур (от –25
до +85 °C), поскольку не содержат воды
Так как литий имеет наивысший
отрицательный потенциал по
отношению к остальным металлам,
следовательно, он имеет наибольшее
номинальное напряжение при
минимальных размерах
4
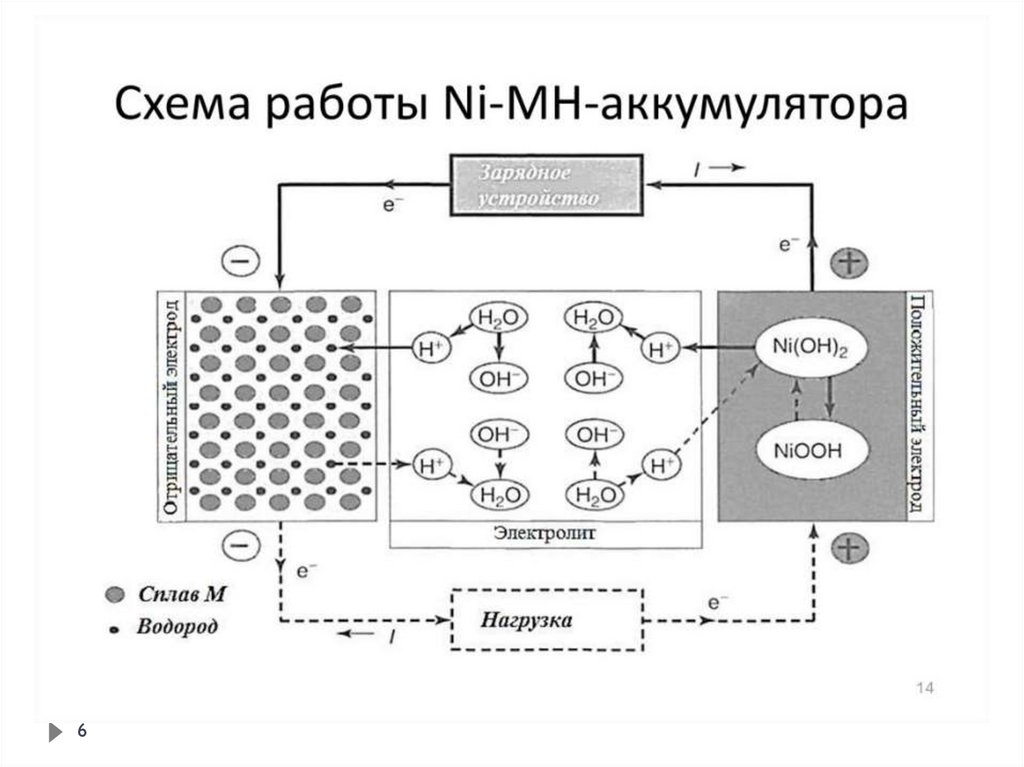
5. Аккумуляторы
Устройства, в которых поэтапнопроисходит преобразование
электрической энергии в химическую, а
химической - в электрическую
Агрегат многоразового действия,
сочетающий в себе гальванический
элемент и электролизёр
Процесс накопления химической
энергии под действием внешнего
постоянного тока называют зарядкой
аккумулятора (работает как
электролизёр)
Процесс превращения химической
энергии в электрическую называют
разрядкой аккумулятора (работает как
гальванический элемент)
5
6.
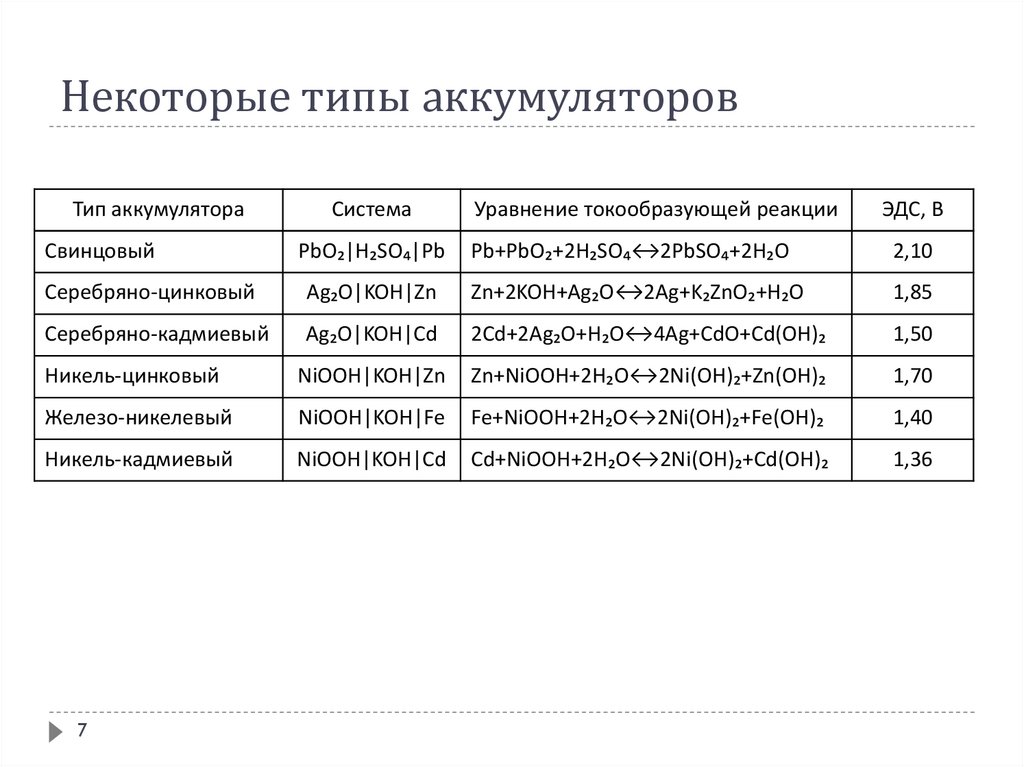
67. Некоторые типы аккумуляторов
Тип аккумулятораСвинцовый
Система
PbO₂|H₂SO₄|Pb
Уравнение токообразующей реакции
ЭДС, В
Pb+PbO₂+2H₂SO₄↔2PbSO₄+2H₂O
2,10
Серебряно-цинковый
Ag₂O|KOH|Zn
Zn+2KOH+Ag₂O↔2Ag+K₂ZnO₂+H₂O
1,85
Серебряно-кадмиевый
Ag₂O|KOH|Cd
2Cd+2Ag₂O+H₂O↔4Ag+CdO+Cd(OH)₂
1,50
Никель-цинковый
NiOOH|KOH|Zn
Zn+NiOOH+2H₂O↔2Ni(OH)₂+Zn(OH)₂
1,70
Железо-никелевый
NiOOH|KOH|Fe
Fe+NiOOH+2H₂O↔2Ni(OH)₂+Fe(OH)₂
1,40
Никель-кадмиевый
NiOOH|KOH|Cd
Cd+NiOOH+2H₂O↔2Ni(OH)₂+Cd(OH)₂
1,36
7
8. Топливные элементы
В них энергия реакции горения топлива непосредственнопревращается в электрическую энергию
Окисление топлива происходит на поверхности индифферентных
электродов (графит, платина, серебро, никель и др.), содержащих
катализатор
В качестве топлива применяют водород, уголь, углеводороды, оксид
углерода, метанол, гидразин N₂H₄ и другие органические соединения
Топливо является восстановителем
Окислителем является кислород или воздух
Были источником энергии на кораблях «Аполло» американской
лунной программы
8
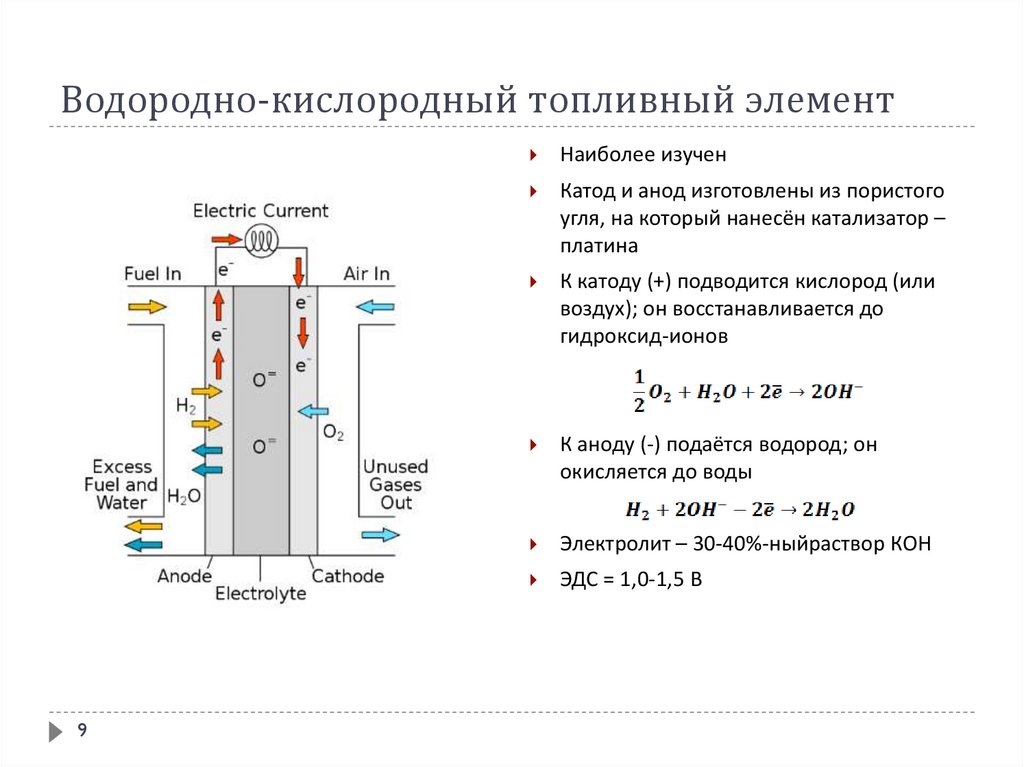
9. Водородно-кислородный топливный элемент
9Наиболее изучен
Катод и анод изготовлены из пористого
угля, на который нанесён катализатор –
платина
К катоду (+) подводится кислород (или
воздух); он восстанавливается до
гидроксид-ионов
К аноду (-) подаётся водород; он
окисляется до воды
Электролит – 30-40%-ныйраствор КОН
ЭДС = 1,0-1,5 В
10.
Электродный потенциал.Критерий протекания окислительновосстановительных реакций.
10
11.
Химические процессы могут сопровождатьсяразличными явлениями — поглощением и
выделением теплоты, света, звука и т.д. В
частности, они могут приводить к
возникновению электрического тока или
вызываться им. Такие процессы называются
электрохимическими, и их открытие сыграло
существенную роль, как в химии, так и в
физике.
11
12.
Алессандро Вольтаопытным путём
установил ряд
напряжений металлов:
Zn, Pb, Sn, Fe, Cu, Ag, Au.
Сила гальванического
элемента оказывалась
тем больше, чем дальше
стояли друг от друга
члены ряда. Но причина
этого в те годы была
неизвестна.
12
13.
В 1853 г. русский учёный,один из основоположников
физической химии Николай
Николаевич Бекетов
(1827-1911)
сделал в Париже сообщение
на тему "Исследование над
явлениями вытеснения
одних элементов другими".
13
14.
Со временем накапливалось всё большесвидетельств того, что некоторые "правила
вытеснения" могут нарушаться. Как обнаружил
Бекетов, водород под давлением 10 атм. вытесняет
серебро из раствора AgNO3.
Английский химик Уильям Одлинг (1829-1921)
описал множество случаев подобного "обращения
активности". Например, медь вытесняет олово из
концентрированного подкисленного раствора
SnCl2 и свинец - из кислого раствора PbCl2. Медь,
олово и свинец находятся в ряду правее кадмия,
однако могут вытеснять его из кипящего слабо
подкисленного раствора CdCl2.
14
15.
Теоретическую основуряда активности (и рядa
напряжений) заложил
немецкий физикохимик
Вальтер Нернст
(1864-1941).
15
16. Вместо качественной характеристики - "склонности" металла и его иона к тем или иным реакциям - появилась точная количественная
Вместо качественной характеристики - "склонности"металла и его иона к тем или иным реакциям - появилась
точная количественная величина, характеризующая
способность каждого металла переходить в раствор в виде
ионов, а также восстанавливаться из ионов до металла на
электроде. Такой величиной является стандартный
электродный потенциал металла, а соответствующий ряд,
выстроенный в порядке изменения потенциалов,
называется рядом стандартных электродных потенциалов.
16
17.
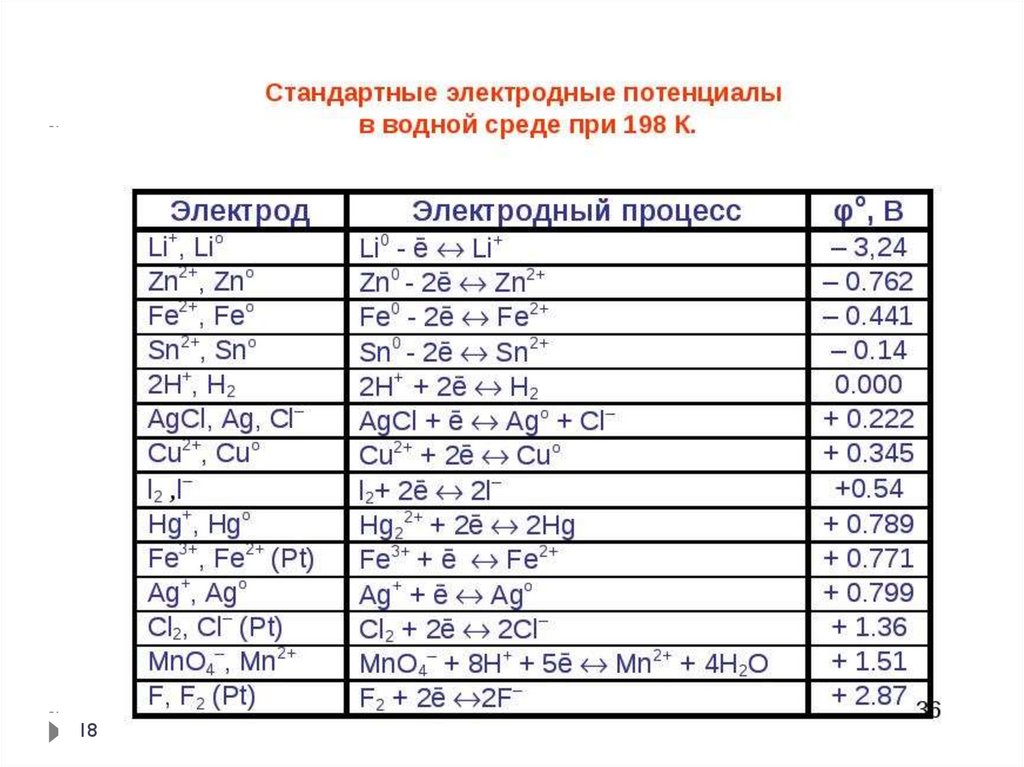
1718.
1819.
Значение окислительно-восстановительных реакцийтрудно переоценить.
Они являются основой жизнедеятельности.
С ними связаны процессы дыхания и обмена веществ в
живых организмах, гниение и брожение, фотосинтез.
Их можно наблюдать при сгорании топлива, в процессах
коррозии металлов и при электролизе.
Они лежат в основе металлургических процессов и
круговорота элементов в природе.
С их помощью получают многие ценные продукты
(аммиак, щелочи, азотную, соляную, серную кислоты и
т. д.).
Благодаря окислительно-восстановительным реакциям
происходит превращение химической энергии в
электрическую в гальванических элементах и
аккумуляторах.
Они же лежат в основе мероприятий по охране природы.
19














 Химия
Химия








