Похожие презентации:
Химические реакции. Химические источники тока
1.
2. Химические реакции2.4.
Химия 9
Химические источники
тока
Бодина О.Г.
2.
Химические источники тока1. Источники тока
1.1 Батарейки, аккумуляторы и другие Задание со свободным ответом
1.2 История создания Лента времени
1.3 Классификация химических источников тока И-схема типа «Дерево»
1.4 ЭДС элемента Определение
1.5 Принцип действия гальванического элемента И-рисунок
1.6 Работа гальванического элемента Задание на указание объектов на сцене
1.7 Утилизация гальванических элементов Задание на квалификацию
2. Электролиз
2.1 Электролиз Определение
2.2 Процесс электролиза И-анимация
2.3 Применение электролиза И-схема типа «Звезда»
2.4 Электролиз расплавов И-видео
2.5 Получение щелочи Задание с пошаговым решением
3.
1.1 Батарейки, аккумуляторы и другиезадания со свободным ответом
Что объединяет эти предметы ?
4.
1.2 История созданиялента времени
Полностью сценарий дан в отдельном файле ([ML-Chem -9] 2.4 Химические
источники тока Бодина doc)
5.
1.3 Классификация химических источников токаи-схема типа «Дерево»
Полностью сценарий дан в отдельном файле ([ML-Chem -9] 2.4 Химические
источники тока Бодина doc)
6.
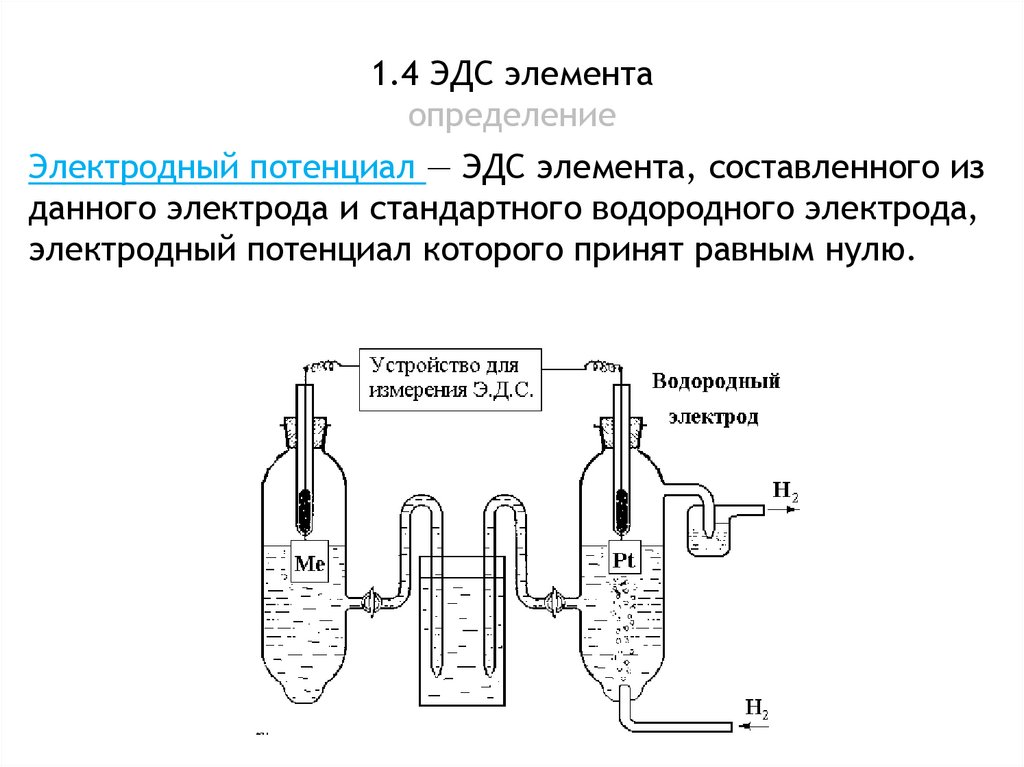
1.4 ЭДС элементаопределение
Электродный потенциал — ЭДС элемента, составленного из
данного электрода и стандартного водородного электрода,
электродный потенциал которого принят равным нулю.
7.
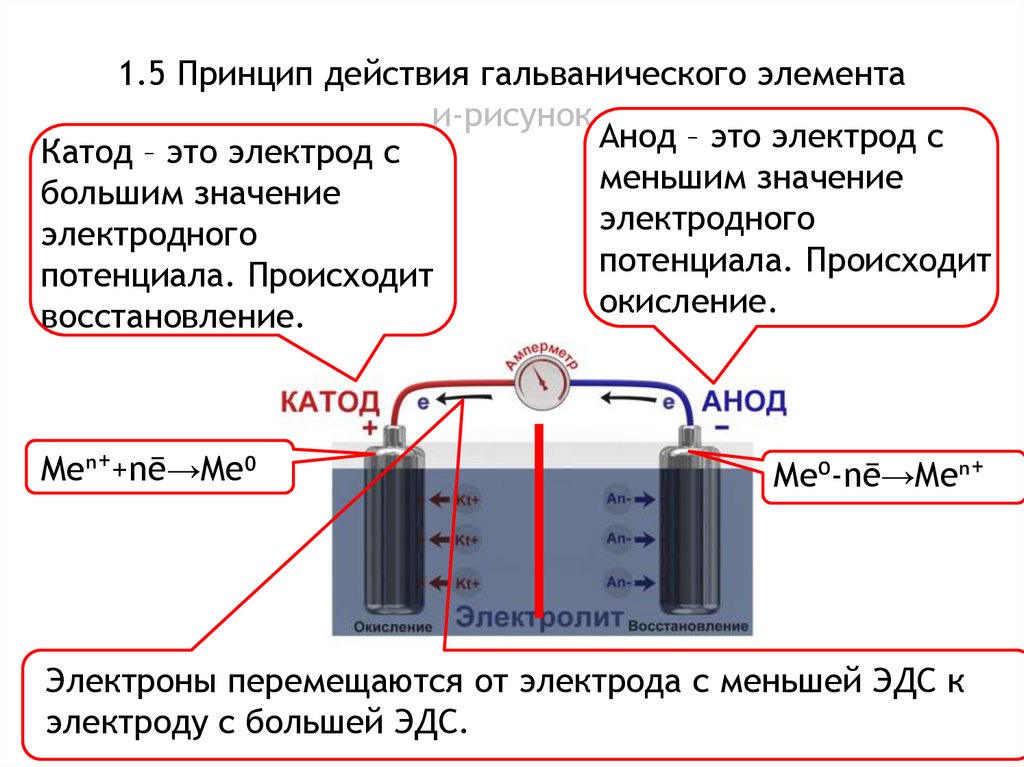
1.5 Принцип действия гальванического элементаи-рисунок
Анод – это электрод с
Катод – это электрод с
меньшим значение
большим значение
электродного
электродного
потенциала. Происходит
потенциала. Происходит
окисление.
восстановление.
Меⁿ⁺+nē→Me⁰
Ме⁰-nē→Meⁿ⁺
Электроны перемещаются от электрода с меньшей ЭДС к
электроду с большей ЭДС.
8.
1.6 Работа гальванического элементазадание на указание объектов на сцене
Определите, в каком направлении будут перемещаться
электроны в гальваническом элементе. Для этого
используйте таблицу электродных потенциалов.
От цинка к меди
От меди к цинку
9.
1.7 Утилизация гальванических элементовзадание со свободным ответом
Почему гальванические элементы необходимо
утилизировать отдельно от других веществ?
10.
2.1 Электролизопределение
Электролиз – это физико-химический окислительновосстановительный процесс, протекающий в растворах
или расплавах электролитов под действием
электрического тока, заключающийся в выделении на
электродах составных частей растворённых веществ или
других веществ - продуктов вторичных реакций на
электродах.
11.
2.2 Процесс электролизаи-анимация
Полностью сценарий дан в отдельном файле ([ML-Chem -9] 2.4 Химические
источники тока Бодина doc)
12.
2.3 Применение электролизаи-схема типа «Звезда»
Электролиз
Полностью сценарий дан в отдельном файле ([ML-Chem -9] 2.4 Химические
источники тока Бодина doc)
13.
2.4 Электролиз расплавови-видео
задание со свободным ответом
Для получения каких веществ можно использовать
данный процесс?
ID: 331686 Видео 0:0-3:21
14.
2.5 Получение щелочизадание с пошаговым решением
Сколько выделится щелочи при электролизе водного
раствора хлорида лития с инертными электродами,
если на аноде выделяется 10,08 л водорода (н.у.)
2LiCl + 2H₂O (электролиз) → H₂↑ + Cl₂↑ + 2LiOH.
Полностью сценарий дан в отдельном файле ([ML-Chem -9] 2.4 Химические
источники тока Бодина doc)











 Химия
Химия








