Похожие презентации:
Как ферменты ускоряют химические реакции?
1.
Как ферментыускоряют химические
реакции?
Выполнил: ст. гр. МТБ02-23-01
К.А. Жулин
Проверил: проф., д.х.н
В.В. Зорин
1
2.
ФерментыФерменты – это белковые молекулы, которые синтезируются
живыми клетками. В каждой клетке насчитывается более сотни
различных ферментов. Роль ферментов в клетке
колоссальна. С их помощью химические реакции идут с
высокой скоростью, при температуре, подходящей для
данного организма.
То есть ферменты – это биологические катализаторы,
которые облегчают протекание химической реакции и за счет
этого увеличивают её скорость. Как катализаторы они не
изменяют направление реакции и не расходуются в процессе
реакции.
Ферменты-биокатализаторы – вещества, увеличивающие
скорость химических реакций.
2
3.
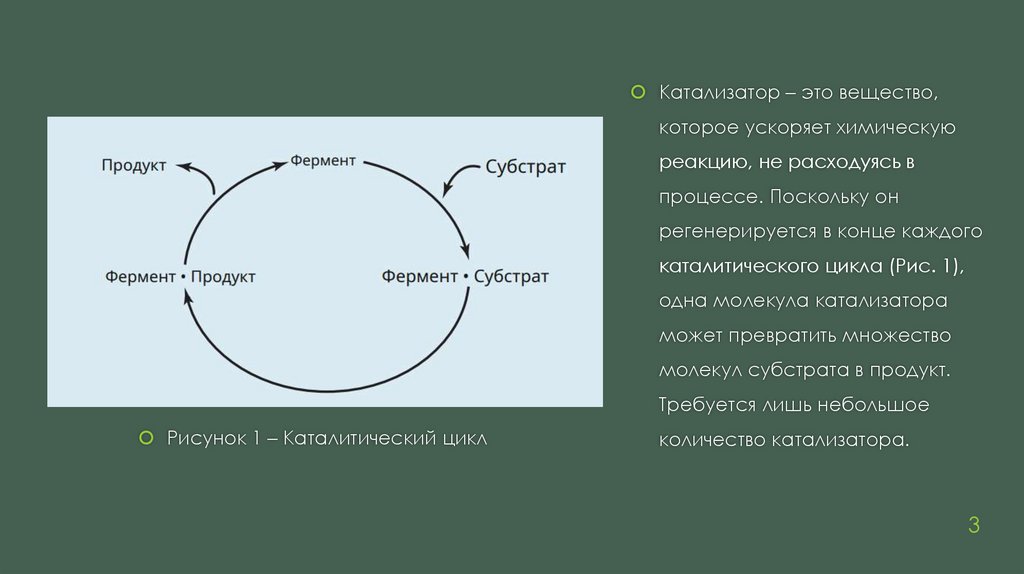
Катализатор – это вещество,которое ускоряет химическую
реакцию, не расходуясь в
процессе. Поскольку он
регенерируется в конце каждого
каталитического цикла (Рис. 1),
одна молекула катализатора
может превратить множество
молекул субстрата в продукт.
Требуется лишь небольшое
Рисунок 1 – Каталитический цикл
количество катализатора.
3
4.
Ферменты отличаются от химическихкатализаторов следующими свойствами:
1) высокой эффективностью действия – ферментативный катализ ускоряет протекание
химических реакций в 106−1014 раз;
2) высокой специфичностью действия – способностью связываться с определенным
субстратом и катализировать реакцию определенного типа;
3) «мягкими» условиями протекания ферментативных реакций – нормальное атмосферное
давление, температура 30−40°С, рН ~ 7, водная среда;
4) способностью
к регуляции своей активности, которая
позволяет
клеткам
четко
координировать осуществление многочисленных разветвленных метаболических реакций,
обеспечивая наиболее высокий и экономный уровень обмена веществ, а также быструю
приспособляемость к меняющимся условиям окружающей среды.
4
5.
Существует 2 основных способаповышения скорости химических реакций
Повышение
температуры
Добавление
катализатора
Ускорение теплового движения
молекул, обладающих
достаточной внутренней
энергией для достижения
переходного состояния (10 ˚С
ускоряет в 2-4 раза) – правило
Ван-Гоффа
Фермент на промежуточной стадии
реакции взаимодействует с
исходными реагентами А и В с
образование фермент-субстратного
комплекса АЕВ, переходному
состоянию которого соответствует
более высокая энергия активации
5
6.
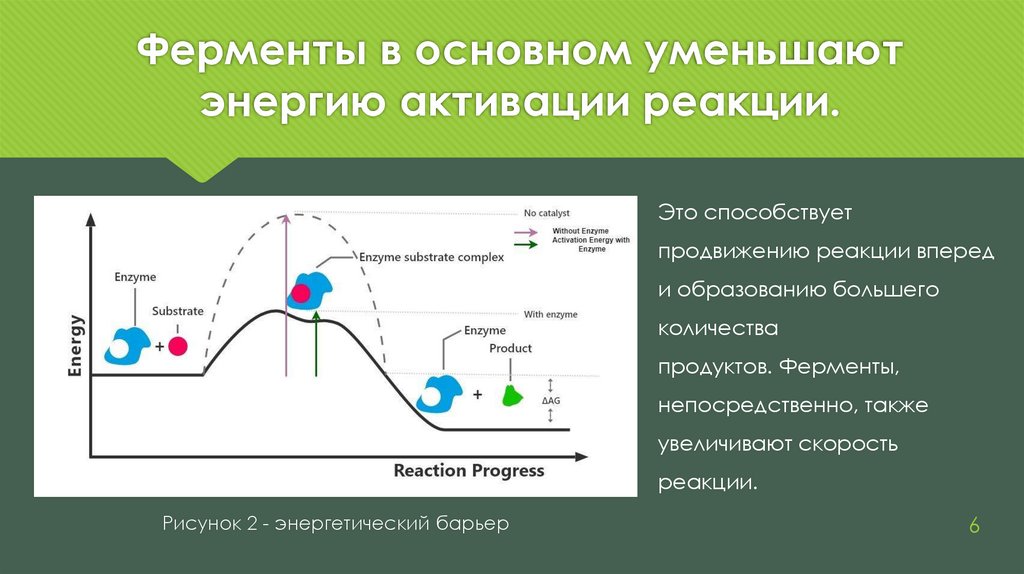
Ферменты в основном уменьшаютэнергию активации реакции.
Это способствует
продвижению реакции вперед
и образованию большего
количества
продуктов. Ферменты,
непосредственно, также
увеличивают скорость
реакции.
Рисунок 2 - энергетический барьер
6
7.
Влияние катализатора на величинуэнергетического барьера
Поскольку катализатор не входит в состав
исходных веществ, так и продуктов реакции, то он
не может оказывать влияние на изменение
энергии Гиббса ΔG . Следовательно, он не
может вызвать п р о т е к а н и е реакций, для
которых в данных условиях ΔG > 0 , а может лишь
ускорить скорость реакции в том случае, если ΔG
< 0.
Рисунок – 3 энергетический барьер
7
8.
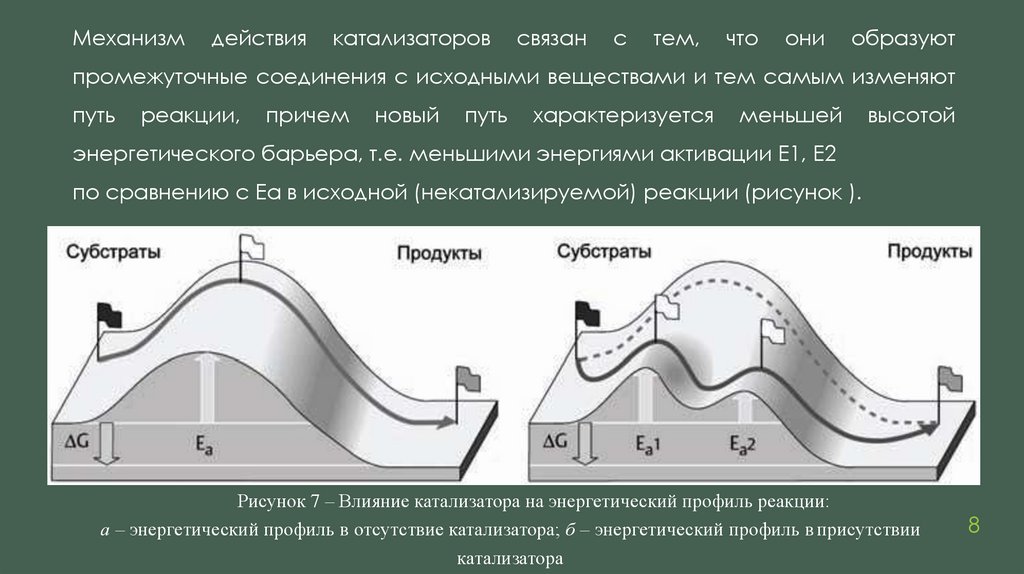
Механизмдействия
катализаторов
связан
с
тем,
что
они
образуют
промежуточные соединения с исходными веществами и тем самым изменяют
путь
реакции,
причем
новый
путь
характеризуется
меньшей
высотой
энергетического барьера, т.е. меньшими энергиями активации E1, E2
по сравнению с Ea в исходной (некатализируемой) реакции (рисунок ).
Рисунок 7 – Влияние катализатора на энергетический профиль реакции:
а – энергетический профиль в отсутствие катализатора; б – энергетический профиль в присутствии
катализатора
8
9.
o Промежуточноехимическое
взаимодействие
реагентов
с
катализатором
может
протекать слитно (а) или раздельно (б)
Рисунок 4 - Энергетический профиль реакции: а – при
слитном каталитическом процессе; б – при раздельном
каталитическом процессе
o Увеличение скорости при слитном механизме достигается в результате уменьшения
энергии активации. При раздельном механизме каталитический процесс осуществляется
поэтапно, в виде нескольких стадий.
9
10.
o Каталитическая активность A характеризует изменение скорости данной реакции, wк , привведении в реакционную систему катализатора.
A = wK - w0
Часто скорость реакции без катализатора w0 настолько мала, что вторым слагаемым
пренебрегают:
A = wK
o Если реакция протекает вблизи состояния равновесия и является двухсторонней, то за
меру каталитической активности принимают скорость протекания реакции в прямом
направлении.
o Удельной каталитической активностью называется каталитическая активность, отнесенная
к единице массы катализатора.
o Селективностью (избирательностью) катализатора называется его способность ускорять
один из возможных путей реакции, если она может протекать по разным направлениям с
образованием различных продуктов.
10
11.
Механизмы при связывании субстратас активным центром фермента
1) Образование ковалентных связей;
2) гидрофобные взаимодействия между неполярными (углеводородными) фрагментами
субстратной молекулы и дегидратированными (хотя бы частично) областями поверхностного
слоя глобулы
3)электростатические взаимодействия между заряженными группами субстрата и
ионизованными аминокислотными остатками полипептидных цепей;
4) образование водородных связей
11
12.
Образование ферментсубстратного комплекса12
13.
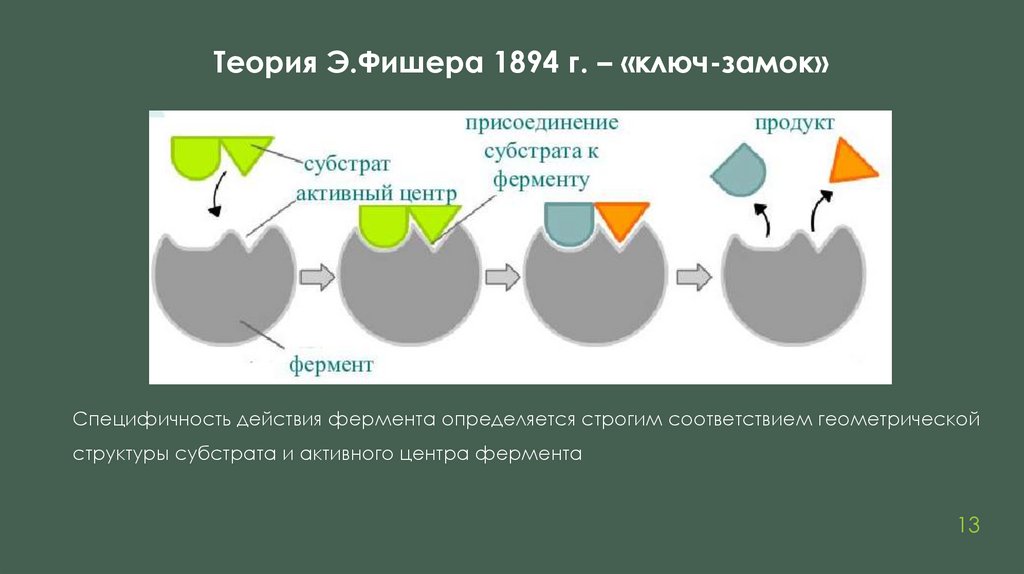
Теория Э.Фишера 1894 г. – «ключ-замок»Специфичность действия фермента определяется строгим соответствием геометрической
структуры субстрата и активного центра фермента
13
14.
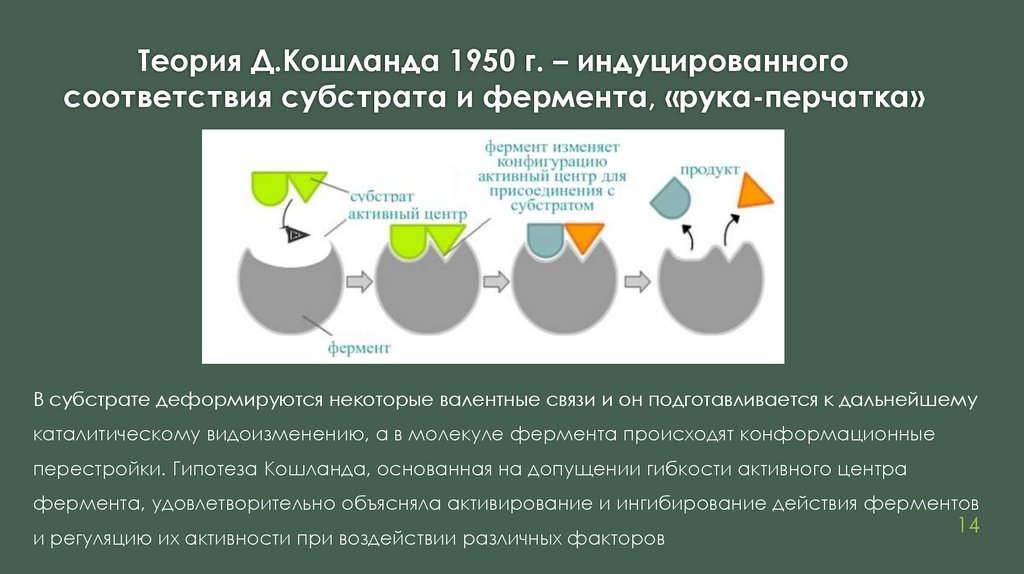
Теория Д.Кошланда 1950 г. – индуцированногосоответствия субстрата и фермента, «рука-перчатка»
В субстрате деформируются некоторые валентные связи и он подготавливается к дальнейшему
каталитическому видоизменению, а в молекуле фермента происходят конформационные
перестройки. Гипотеза Кошланда, основанная на допущении гибкости активного центра
фермента, удовлетворительно объясняла активирование и ингибирование действия ферментов
и регуляцию их активности при воздействии различных факторов
14
15.
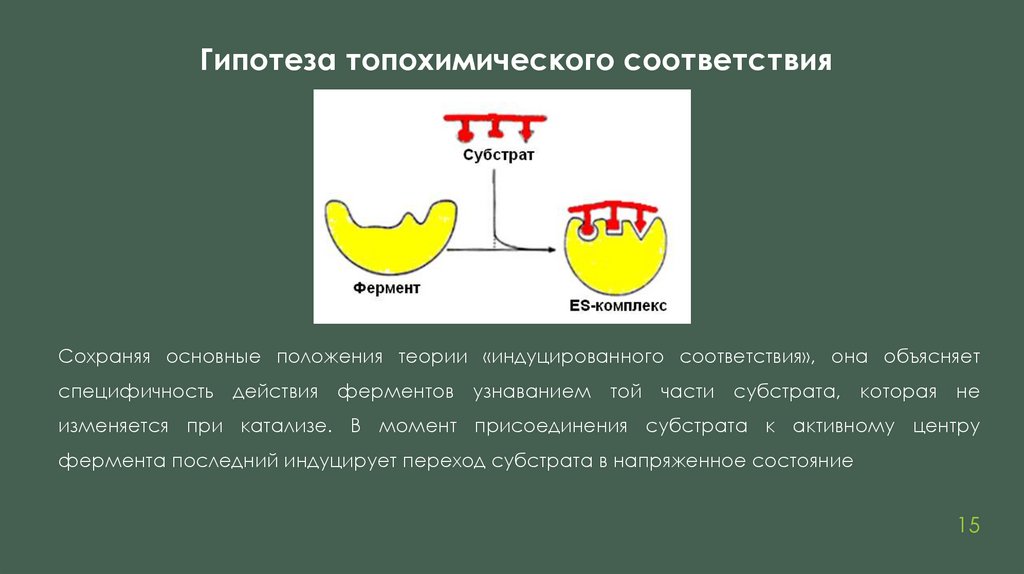
Гипотеза топохимического соответствияСохраняя основные положения теории «индуцированного соответствия», она объясняет
специфичность действия ферментов узнаванием той части субстрата, которая не
изменяется при катализе. В момент присоединения субстрата к активному центру
фермента последний индуцирует переход субстрата в напряженное состояние
15










 Биология
Биология Химия
Химия








