Похожие презентации:
Серная кислота
1.
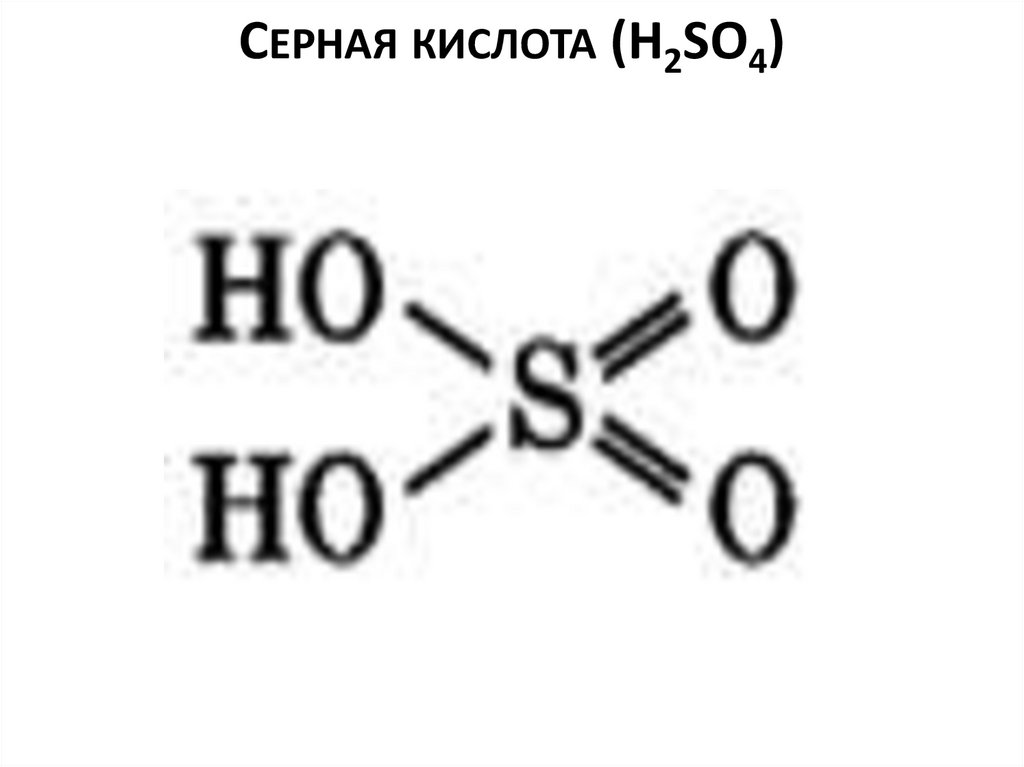
СЕРНАЯ КИСЛОТА (H2SO4)2.
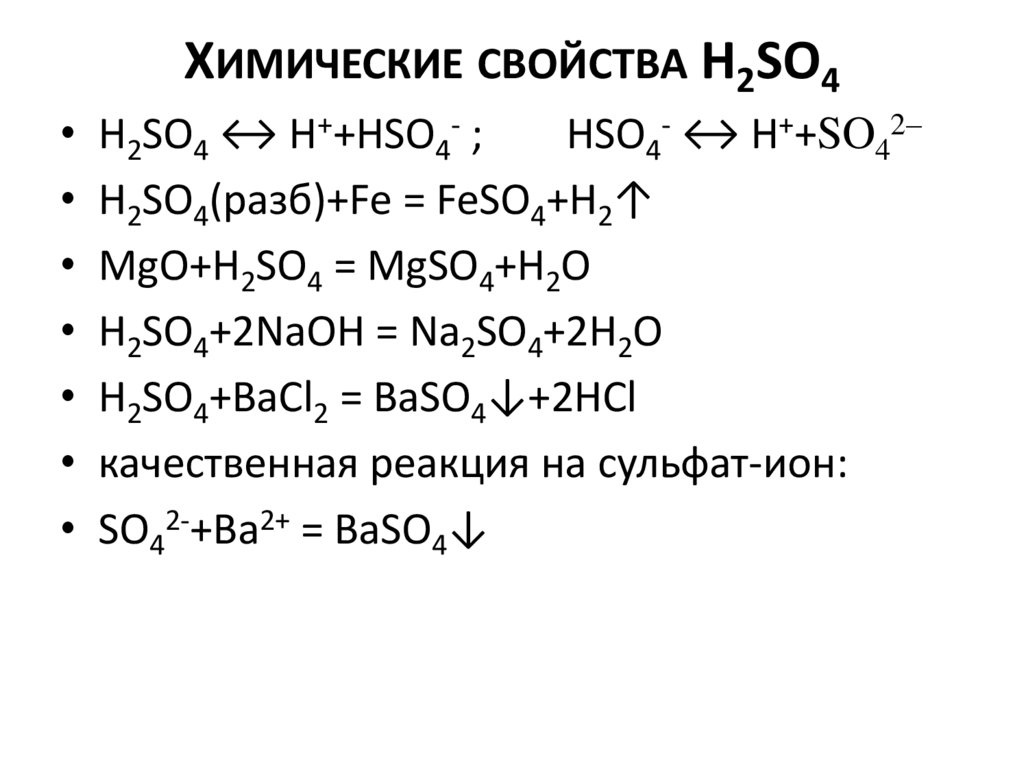
ХИМИЧЕСКИЕ СВОЙСТВА H2SO4• H2SO4 ↔ H++HSO4- ;
HSO4- ↔ H++SO42–
• H2SO4(разб)+Fe = FeSO4+H2↑
• MgO+H2SO4 = MgSO4+H2O
• H2SO4+2NaOH = Na2SO4+2H2O
• H2SO4+BaCl2 = BaSO4↓+2HCl
• качественная реакция на сульфат-ион:
• SO42-+Ba2+ = BaSO4↓
3.
Окислительные свойства• В окислительно-восстановительных реакциях серная
кислота выступает в роли окислителя, при этом, в
разбавленной H2SO4 роль окислителей играют катионы
водорода (H+), а в концентрированной - сульфат-ионы
(SO42-) (более сильные окислители, чем катионы
водорода).
• разбавленная серная кислота:
H2+1S+6O4-2
окислитель H+: 2H++2e- → H20↑
• концентрированная серная кислота:
H2+1S+6O4-2
окислитель S+6:
– S+6+2e- → S+4 (SO2)
– S+6+6e- → S0 (S)
– S+6+8e- → S-2 (H2S)
4.
Концентрированная H2 SO4• 2H2SO4(конц)+Cu = CuSO4+SO2↑+2H2O
5H2SO4(конц)+4Mg = 4MgSO4+H2S↑+4H2O
4H2SO4(конц)+3Zn = 3ZnSO4+S↓+4H2O
Концентрированная серная кислота
окисляет некоторые неметаллы,
восстанавливаясь до сернистого газа:
• 2H2S+6O4(конц)+S0 = 3SO2↑+2H2O
2H2S+6O4(конц)+C = C+4O2↑+2S+4O2↑+2H2O
5.
Контактный способ полученияH2SO4:
• На первом этапе получают сернистый газ
путем обжига серного
колчедана:4FeS2+11O2 = 2Fe2O3+8SO2↑
• На втором этапе, сернистый газ окисляют
кислородом воздуха до серного ангидрида,
реакция идет в присутствии оксида
ванадия, играющего роль
катализатора:2SO2+O2 = 2SO3
6.
• На третьем, последнем этапе, получаютолеум, для этого серный ангидрид
растворяют в концентрированной серной
кислоте:H2SO4+nSO3 ↔ H2SO4·nSO3
• В дальнейшем олеум транспортируется в
железных цистернах, а серная кислота
получается из олеума разбавлением
водой:H2SO4·nSO3+H2O → H2SO4
7.
СОЛИ СЕРНОЙ КИСЛОТЫ• Сульфаты хорошо растворяются в воде, исключение
составляют CaSO4, PbSO4, BaSO4 - первые два плохо
растворяются, а сульфат бария практически
нерастворим. Сульфаты, в состав которых входит вода,
называются купоросами (медный купорос CuSO4·5H2O).
• Отличительной особенностью солей серной кислоты
является их отношение к нагреванию, например,
сульфаты натрия, калия, бария устойчивы к нагреванию,
не разлагаясь даже при 1000°C, в то же время, сульфаты
меди, алюминия, железа разлагаются даже при
незначительном нагревании с образованием оксида
металла и серного ангидрида: CuSO4 = CuO+SO3.
• Горькая (MgSO4·7H2O) и глауберова (Na2SO4·10H2O) соль
используются в качестве слабительного средства.
Сульфат кальция (CaSO4·2H2O) гипс - при изготовлении
гипсовых повязок.





 Химия
Химия








