Похожие презентации:
Серная кислота как электролит
1.
Тема урока: «Серная кислотакак электролит».
Цель урока: изучить свойства
серной кислоты разной
концентрации.
2.
13
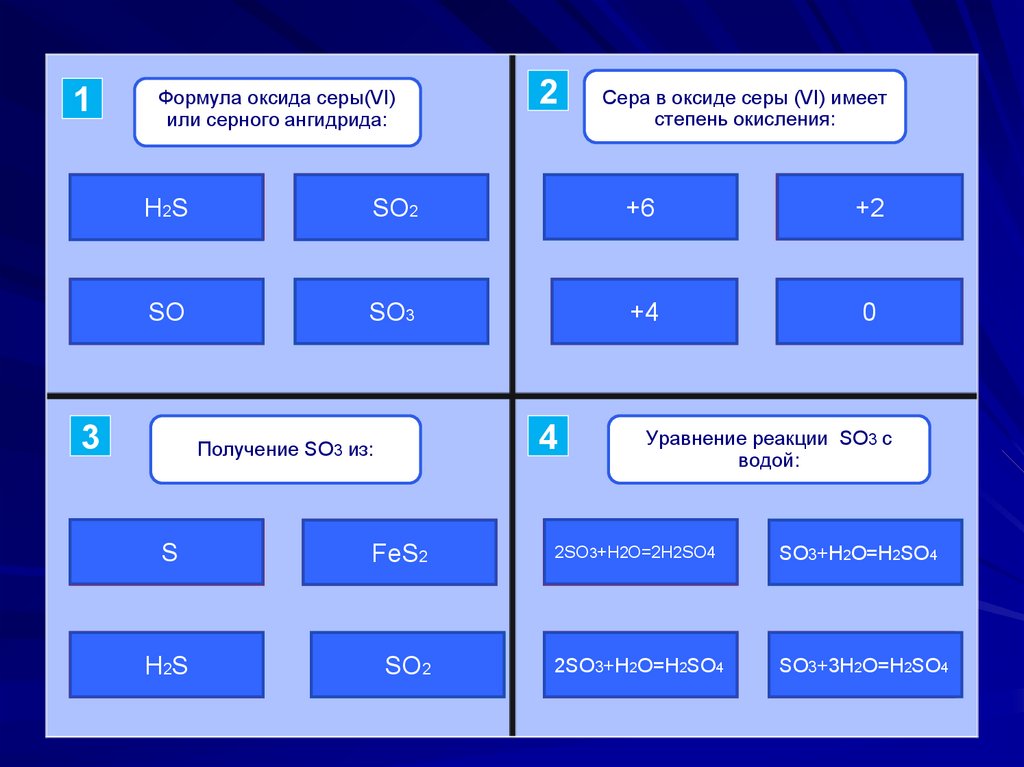
Формула оксида серы(VI)
или серного ангидрида:
2
Сера в оксиде серы (VI) имеет
степень окисления:
подумай
H2S
ошибка
SO2
верно
+6
подумай
+2
ошибка
SO
верно
SO3
ошибка
+4
ошибка
0
Получение SO3 из:
S
подумай
ошибка
FeS2
ошибка
H2S
верно
SO2
4
Уравнение реакции SO3 с
водой:
2SO3подумай
+H2O=2H2SO4
SO3+H
2O=H2SO4
верно
2SO3ошибка
+H2O=H2SO4
SO3ошибка
+3H2O=H2SO4
3.
Разбавление серной кислотыводой.
• 034.wmv
4.
Физические свойства сернойкислоты
• Образование гидратов, при взаимодействии серной
кислоты с водой:
H2SO4 + nH2O = H2SO4 * nH2O +Q
Серная кислота — бесцветная маслянистая жидкость,
почти вдвое (ρ=1,83 г/см3) тяжелее воды, не имеет
запаха. Гигроскопична. Поглощает влагу с выделением
большого количества теплоты.
5.
Химические свойства сернойкислоты.
Свойства
1. Индикатор: (5 группа)
а) лакмус
б) метиловый оранжевый
2. С металлами, стоящими в
электрохимическом ряду напряжений до и
после Н2 (1 группа)
3. С основными оксидами (2 группа)
4. С основаниями (3 группа)
5. С солями. Качественная реакция на SO42(4 группа)
6. С неметаллами (5 группа)
H2SO4 разб. H2SO4 конц
красный
розовый
не изменяет
окраску
индикатора.
6.
Химические свойства серной кислоты.свойства
С металлами,
стоящими в
электрохимич
еском ряду
напряжений
до Н2
после Н2
С основными
оксидами
разб. H2SO4
конц. H2SO4
4H2S+6O4+3Zn0 =3Zn+2SO4+S0↓+4H2O
+6
H2+SO4 +Zn0 =Zn+2SO4 +H2↑ S – окислитель
0 – восстановитель
Zn
+
H – окислитель
5H2SO4 + 4Ca=4CaSO4 + H2S↑+ 4H2O
Zn0 – восстановитель
На холоде пассивирует Fe,Cr,Ni,Al.
НЕ РЕАГИРУЕТ с металлами
после водорода.
2H2S+6O4+Cu0 =Cu+2SO4 + S+4O2 +2H2O
S+6 – окислитель
Cu0 – восстановитель
Не реагирует с Au и Pt
H2SO4 + MgO = MgSO4 + H2O
MgO + 2H+ + SO42– → Mg2+ + SO42– + H2O
MgO + 2H+ → Mg2+ + H2O
7.
Химические свойстваконцентрированной серной
кислоты.
• mmlab.chemistry.404i.oms
8.
Химические свойства серной кислоты.свойства
С основаниями:
Растворимыми
Нерастворимыми
С солями.
Качественная
реакция на SO42С неметаллами
Органические
вещества
разб. H2SO4
конц. H2SO4
H2SO4 + 2NaOH = Na2SO4 + 2H2O
2H+ + SO42– + 2Na+ + 2OH– = 2Na+ + SO42– + 2H2O
H+ + OH– = H2O
H2SO4 + Cu(OH)2↓ = CuSO4 + 2H2O
2H+ + SO42– + Cu(OH)2↓ = Cu2+ + SO42– + 2H2O
2H+ + Cu(OH)2↓ = Cu2+ + 2H2O
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
2H+ + SO42– + Ba2+ + 2Cl– = BaSO4↓ + 2H++ 2ClSO42– + Ba2+ = BaSO4↓
НЕ РЕАГИРУЕТ
НЕ РЕАГИРУЕТ
2H2S+6O4 + S0 = 3S+4O2 + 2H2O
S+6 – окислитель
S0 – восстановитель
обугливание древесины, сахарозы
C12H22O11 + H2SO4 => 12C + H2 SO4*11 H2O +Q
9.
Химические свойстваконцентрированной серной
кислоты.
• mmlab.chemistry.404i.oms
10.
Химические свойстваконцентрированной серной
кислоты.
• 032.wmv
11.
ВЫВОД:H2SO4
- сильный окислитель.
Свойства разбавленной и концентрированной серной
кислоты отличаются, так как разные окислители:
в разбавленной окислителем является ион
в концентрированной
S+6 .
H+
12.
13
Сера в серной кислоте
имеет степень окисления:
2
Лакмус в растворе серной
кислоты:
подумай
0
ошибка
+2
красный
верно
подумай
зеленый
ошибка
+4
верно
+6
ошибка
синий
желтый
ошибка
Серная кислота (р-р)
взаимодействует с :
4
С образованием СО2 серная
кислота (к) взаимодействует с :
Cu
подумай
ошибка
Au
Fe
подумай
верно
С
ошибка
Hd
верно
Zn
ошибка
Ti
ошибка
S
13.
Домашнее задание.§20, стр. 98-104.
•Упражнение № 1-2, стр. 105 – на «3».
Упражнение № 4, стр. 105 – на «4».
Упражнение № 5, стр. 105 – на «5».
•Творческое задание №7, стр. 108 (по
желанию).
Желаю успеха!
14.
ПРОВЕРЬ СЕБЯ:1. В двух одинаковых сосудах без этикеток налиты
равные объемы разбавленной и
концентрированной серной кислоты. Предложите
простейший способ идентификации (определения)
жидкостей.
2. В не очень далекие времена иногда между стеклами
в двойных оконных рамах на зиму ставили
стаканчик с концентрированной серной кислотой,
чтобы стекла не потели. Какова роль серной
кислоты?
3. С какими из перечисленных металлов при
температуре 200С не реагирует концентрированная
серная кислота:
1) Cu, 2) Zn, 3) Mg, 4) Au.
4.С образованием СО2 концентрированная серная
кислота взаимодействует с:
1) Fe 2) Ti 3) C
4) S
15.
СПАСИБОЗА ВНИМАНИЕ!














 Химия
Химия








