Похожие презентации:
Кремний и его соединения
1.
Кремний и егосоединения
2.
Задание1) Ознакомьтесь с презентацией, прочитайте
параграф 33.
2) Сделайте опорный конспект по теме.
3) Упр. 2,7 стр. 180 письменно.
4) Пришлите фото выполненного задания на
адрес tonyawawilowa@gmail.com
5) Готовьтесь к тесту по теме «Подгруппа
углерода».
3.
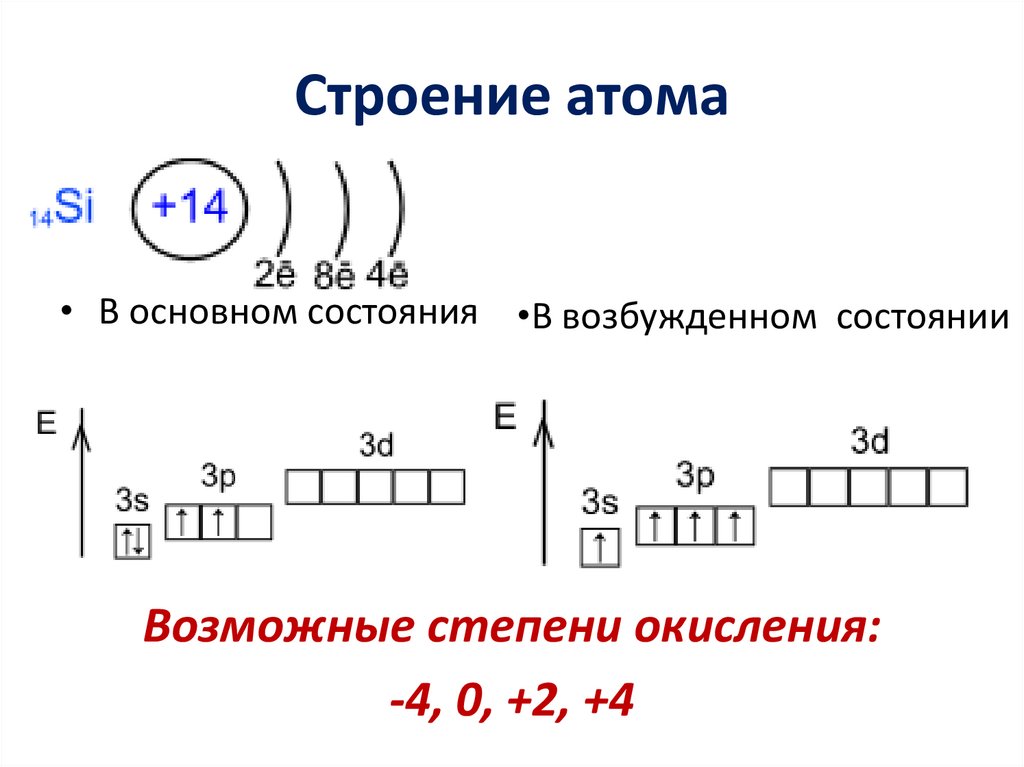
Строение атома• В основном состояния •В возбужденном состоянии
Возможные степени окисления:
-4, 0, +2, +4
4.
Нахождение в природе• В организме присутствует как
микроэлемент
• Второй по распространенности на
земном шаре после кислорода (по массе
его в земной коре - 27,6%)
5.
• В природе находится в связанном виде – ввиде SiO2
Песок
Горный
хрусталь
Кварц
В составе
глин
6.
или силикатов: асбест, тальк,Изумруд
Топаз
7.
Аллотропные модификацииАморфный кремний
- Бурый порошок
- Не имеет упорядоченной
структуры и определенной
температуры плавления
Кристаллический кремний
• Темно-серый с
металлическим блеском
• Тугоплавок
• Хрупок
• Слабо проводит
электрический ток
• Инертен при обычных
условиях
НЕМЕТАЛЛ
8.
Получение кремния1. В промышленности - восстановлением диоксида
кремния коксом в электрических печах:
SiO2+2C=Si+2CO
2. В лаборатории кремний получают прокаливанием с
магнием или алюминием белого песка:
SiO2 + 2Mg = 2MgO + Si
3SiO2 + 4Al = 2Al2О3 + 3Si
9.
Химические свойстваSi-4
Si
Si+4
Окислитель Восстановитель
1. С металлами (продукты – 1. С галогенами (с хлором при
силициды)
нагревании)
t
Si + 2Mg = Mg2Si
Si + 2F = SiF
2
4
2.С кислородом:
Si + O2 = SiO2
3.С другими неметаллами:
t
Si + C = SiC
4. Восстанавливает металлы из
оксидов
t
2FeO + Si = 2Fe + SiO2 + Q
5. Со щелочами
Si + 2NaOH + H2O = Na2SiO3 + 2H2
10.
Оксид кремния (IV)Твёрдое, кристаллическое, тугоплавкое
вещество с атомной кристаллической
решеткой
11.
Химические свойства• Кислотный оксид
НО! Не реагирует с водой.
1. С основными оксидами:
t˚
SiO2 + CaO → CaSiO
CaSiO
33
2. Со щелочами:
t˚
SiO2 + 2NaOH → Na
Na2SiO
3 3++HH
2O
2SiO
2O
3. С солями:
t˚
SiO2 + K2CO3 → K2KSiO
CO
CO
2SiO
3+
3+
2 2
12.
Кремниевая кислотаФизические свойства: непрочная,
малорастворимая, не имеет кислого вкуса.
Получение:
Действие сильных кислот на силикаты
Na2SiO3 + 2HCl → 2NaCl + H2SiO3↓
Выделяется в виде силикагеля
Применяющегося для поглощения водяных
паров.
Химические свойства: Слабее угольной!
При нагревании разлагается:
t
H2SiO3 → H2O + SiO2











 Химия
Химия








