Похожие презентации:
Классификация химических реакций в органической и неорганической химии
1. Классификация химических реакций в органической и неорганической химии
2.
• Цели урока:• обобщить представления о химической реакции
как о процессе превращения одного или
нескольких веществ в другие вещества;
• рассмотреть
классификацию
химических
реакций в органической и неорганической
химии, применять ее при характеристике
химических реакций
3.
Химическая реакция (или химическое явление) –это процесс, в результате которого из одних
веществ
образуются
другие
вещества,
отличающиеся от исходных по составу или
строению, а следовательно, и по свойствам.
Например:
CaO H 2 O Ca(OH ) 2
,
4. Типы химических реакций
• По числу и составу реагирующих иобразующихся веществ;
• По направлению (признаку обратимости);
• По признаку изменения степеней
окисления атомов элементов;
• По тепловому эффекту;
• По фазовому составу (агрегатному
состоянию веществ);
• По использованию катализатора;
• По механизму
5. По числу и составу исходных веществ и продуктов реакции
Реакциисоединения
Реакции
разложения
Реакции
замещения
Реакции
обмена
Из нескольких
веществ образуется
одно новое вещество
Из одного вещества
образуется несколько
новых веществ
Атомы простого
вещества замещают
атомы одного из
элементов в сложном
веществе
Два сложных
вещества
обмениваются своими
составными частями
Zn + 2HCl =
NaOH + HCl =
= NaCl + H2O
где NaOH – гидроксид
натрия,
NaCl – хлорид натрия
S + O2 = SO2
где SO2 - оксид серы (IV)
t
CaCO3 CaO CO2
где CaCO3 - карбонат
кальция
= ZnCl2 + H2↑
где HCl – соляная
кислота,
ZnCl2 - хлорид цинка
6. По признаку обратимости
• Обратимые реакции протекаютодновременно в двух
противоположных
направлениях
3H 2 N 2 2 NH 3
Гидрирование – дегидрирование
Гидратация-дегидратация
Полимеризация – деполимеризация
Этерификация- гидролиз
• Необратимые реакции протекают только в одном
направлении
Признаки необратимости:
образование осадка
• выделение газа,
• образование
малодиссоциирующего
вещества (например воды)
H 2 SO4 BaCl 2 BaSO 4 2 HCl
СН3СООН+Na2CO3=CН3СООNa +
СО2+Н2О
7. По признаку изменения степени окисления
• 1) протекают с изменением степени окисления(ОВР)
0
1 1
2
Fe 2 H Cl Fe Cl2 1 H 20
СН3СНО + Н2 = СН3СН2ОН
• 2) протекают без изменения степени окисления
элементов
НСООН + СН3ОН = НСООСН3+Н2О(этерификации)
6
2
3
SO
1
2
2
H O H
1
2
6
S O4 2
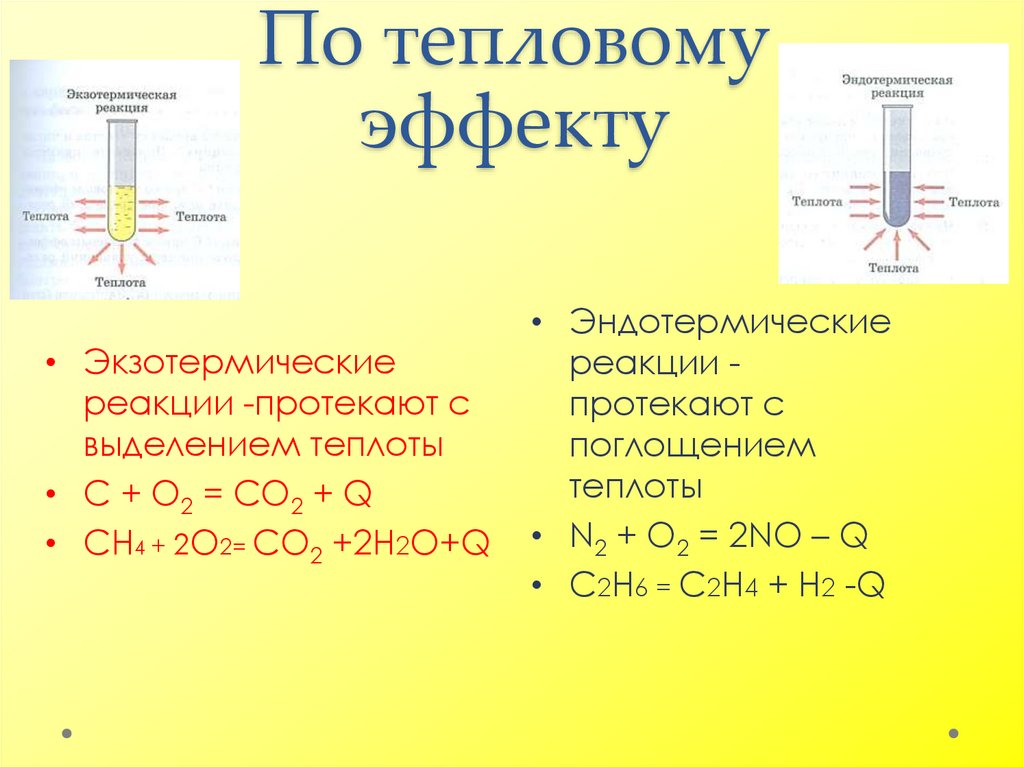
8. По тепловому эффекту
• Экзотермическиереакции -протекают с
выделением теплоты
• С + O2 = СO2 + Q
• СН4 + 2О2= СO2 +2Н2О+Q
• Эндотермические
реакции протекают с
поглощением
теплоты
• N2 + O2 = 2NO – Q
• C2Н6 = С2Н4 + Н2 -Q
9. По агрегатному состоянию веществ
• 1)Гетерогенные
реакции
протекают
в
неоднородной среде, на поверхности раздела фаз
(т-г, т-ж, ж-г)
Fe(т) CuSO 4 (р - р) Cu(т) FeSO4 (р - р)
• СаС2(т) +2Н2О (ж) = С2Н2(г) + Са(ОН)2 (р-р)
• 2) Гомогенные реакции - протекают между
веществами в однородной среде, где нет
поверхности раздела фаз
H2 (г)+ Cl2 (г) = 2HCl (г)
СН3СООН (р-р) + NaОН(р-р)= СН3СООNa (р-р) + Н2О(ж)
10. По наличию катализатора
• 1) Каталитические реакции - протекают с участиемкатализатора
C 2 H 5 OH H SO
C 2 H 4 H 2 O
2
4
• 2) Некаталитические реакции - протекают без
участия катализатора
2Mg O2 2MgO
11. По механизму протекания
• Радикальные реакцииидут с участиемобразующихся в ходе
реакции
радикалов(частицы с
неспаренными
электронами)
Цепные реакции:
СН4+Cl2=СН3Cl+HCl
Cl2 = Cl* + Cl*
Cl* + CH4 = CH3* + HCl
• Ионные реакции – идут
между уже имеющимися
или образующимися в
ходе реакции ионами.
(реакции между
электролитами в воде)
12. Задание
Дайте характеристику для химическогоуравнения по признакам классификации:
MnO2
2Н2О2=2Н2О+О2 +Q
13. Даны вещества:
хлорид бариякарбонат кальция
цинк
сера
сульфат натрия
соляная кислота
кислород
этен
этан
водород
уксусная кислота
гидроксид натрия
хлор
метан
Напишите уравнения возможных реакций между
этими веществами, определите тип
химической реакции
14. Домашнее задание
• конспект• Дать характеристику реакции взаимодействия
азота с водородом по признакам
классификации.
• 3. Определите степени окисления, окислитель,
восстановитель в следующем уравнении
реакции:
СН3СНО + Ag2O = CН3СООН + 2 Ag













 Химия
Химия








