Похожие презентации:
Классификация химических реакций в органической и неорганической химии
1.
Тема. Классификация химическихреакций в органической и
неорганической химии
2. Термин «реакция» в переводе с лат.
«противодействие», «отпор», «ответное действие»«Химическая реакция» – ответное действие
вещества на воздействие на него извне
других веществ, учитывая факторытемпературу, свет, электрический ток,
излучение, механическое воздействие.
3. Химическая реакция (или химическое явление)
это процесс, в результате которого из однихвеществ образуются другие вещества, отличающиеся от исходных по составу или строение, а
следовательно, и по свойствам.
- Изменение веществ, при которых разрушаются
старые и образуются новые химические связи м
ежду частицами (атомами, ионами) из которых
построены вещества
Н2+Сl2= 2 НСl;
Н:Н+Сl:Cl=2HCl
4. Классификация химических реакций
1.По числу и составу реагирующих иобразующихся веществ;
2. По направлению (признаку обратимости);
3.По признаку изменения степеней окисления
атомов элементов;
4. По тепловому эффекту;
5. По фазовому составу (агрегатному состоян
ию веществ);
6. По использованию катализатора;
7.По механизму
5. По числу и составу реагентов и продуктов реакции
Реакции соединенияРеакции
разложения
Реакции
замещения
Реакции
обмена
Из нескольких веществ
образуется одно новое
вещество
Из одного вещества
образуется несколько
новых веществ
Атомы простого вещества
замещают атомы одного из
элементов в сложном
веществе
Два сложных
вещества
обмениваются
своими
составными
частями
S + O2 = SO2
СаСО3 =СаО + СО2
Zn + 2HCl = ZnCl2 + H2↑
NaOH + HCl =
= NaCl + H2O
где NaOH –
гидроксид натрия,
NaCl – хлорид
натрия
Реакция присоединения
где SO2 - оксид серы (IV)
С2Н4+Н2= С2Н6
где
кальция
- карбонат
где HCl – соляная кислота,
ZnCl2 - хлорид цинка
6. По признаку обратимости
Не обратимые(прямая)
Обратимые
3н2+ N2
ВаСl2 + Н2SO4 = ВаSO4 +2НСl
2NН3
7. По признаку изменения степени окисления
По признаку изменения степени окисления
1) протекают с изменением степени окис
ления (ОВР)
2) протекают без изменения
степени окисления элементов
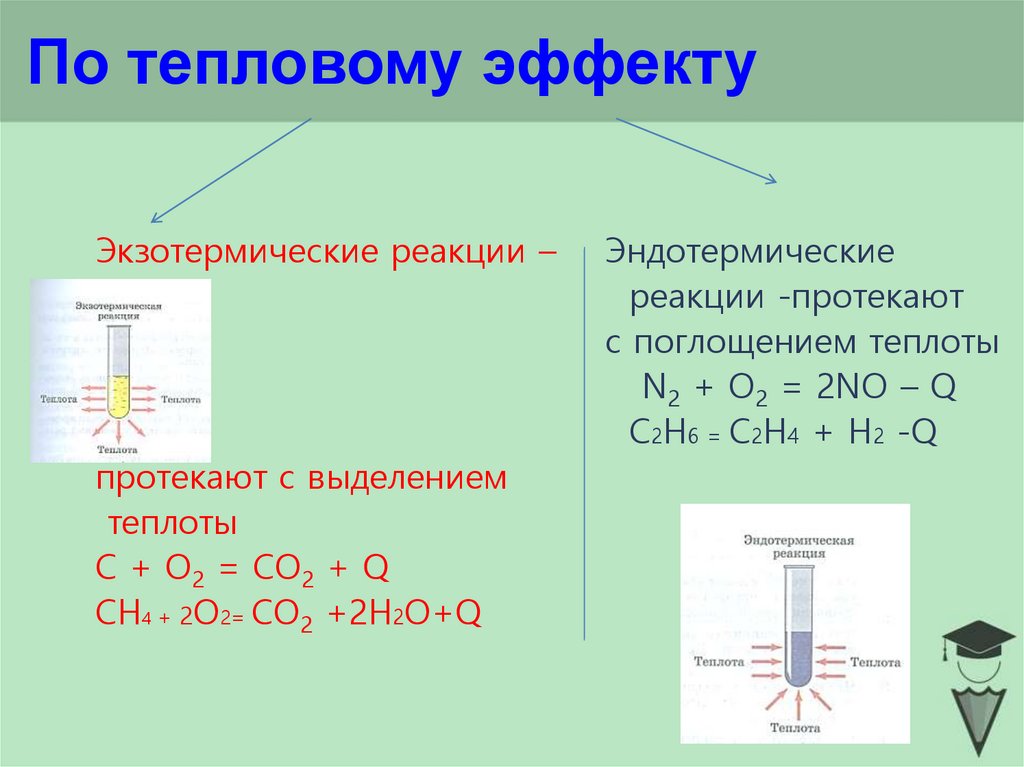
8. По тепловому эффекту
Экзотермические реакции –протекают с выделением
теплоты
С + O2 = СO2 + Q
СН4 + 2О2= СO2 +2Н2О+Q
Эндотермические
реакции -протекают
с поглощением теплоты
N2 + O2 = 2NO – Q
C2Н6 = С2Н4 + Н2 -Q
9. По агрегатному состоянию веществ
• 1) Гетерогенные реакции - протекают в неоднородной среде, на поверхности раздела фаз (т-г, тж, ж-г)
Fe(т) CuSO 4 (р - р) Cu(т) FeSO4 (р - р)
• СаС2(т) +2Н2О
(ж)
= С2Н2(г) + Са(ОН)2
(р-р)
• 2) Гомогенные реакции - протекают между веще
ствами в однородной среде, где нет поверхности
раздела фаз
H2 (г)+ Cl2 (г) = 2HCl (г)
СН3СООН
(р-р)
+ NaОН(р-р)= СН3СООNa
(р-р)
+ Н2О(ж)
10. По наличию катализатора
• 1) Каталитические реакции - протекают с участием катализатора
2 SO4
C 2 H 5 OH H
C 2 H 4 H 2 O
• 2) Некаталитические реакции - протекают без у
частия катализатора
2Mg O2 2MgO
11. Задание
Дайте характеристику для химического уравнения по признакам классификации:
MnO2
2Н2О2=2Н2О+О2 +Q
12. Определите типы реакций и рас- ставьте коэффициенты
Определите типы реакций и расставьте коэффициентыH + CuO = Cu + H2O
Zn + CuCl2 = Cu + ZnCl2
NH3 = N2 + H2
Cu + S = CuS
AgF + NaCl = AgCl + NaF
CaCO3 = CaO + CO2 ↑
CuBr2 + NaOH = Cu(OH)2 + NaBr
Fe + H2O = H2↑ + Fe2O3
2
13. Домашнее задание
П.12 изучитьзадания 2,3, 9-10 письменно с. 58
Тестовые задания с.58-59












 Химия
Химия








